Microbiote intestinal humain
Le microbiote intestinal humain, — du grec mikrós « petit », et biôtós, adjectif verbal de bióô « vivre »[2] — anciennement appelé flore intestinale humaine, est constitué des microorganismes (archées, bactéries et levures — et les virus qui les infectent) du tractus digestif humain, appelé microbiome intestinal, et de l'ensemble du système gastro-intestinal (estomac, selles, etc). Il représente le plus grand réservoir du microbiote de l'organisme humain et un réservoir d’activités enzymatiques essentiel pour la digestion et la physiologie humaines. À ce titre, il influe sur la santé.
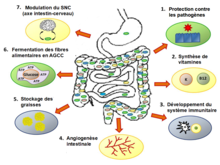
Ce microbiote et son hôte humain sont un exemple de symbiose mutualiste (coopération entre différentes sortes d’organismes impliquant un avantage pour chacun) et de commensalisme. Le microbiote peut réguler l’expression de certains gènes de l'hôte, ce qui fait évoquer des relations symbiotiques avancées[3],[4].
Chez un individu en bonne santé, l'activité métabolique de ce microbiote en fait l'équivalent d'un organe à part entière dans la physiologie humaine. Il est impliqué dans la maturation du système immunitaire et de l'épithélium intestinal de l'hôte[5]. Il intervient dans de nombreuses voies métaboliques fondamentales comme la fermentation des sucres et des protéines ainsi que le métabolisme des acides biliaires et des xénobiotiques[6].
En matière de nutrition, il permet aux systèmes digestifs de fermenter les fibres alimentaires et il synthétise des vitamines essentielles[7],[8].
En cas de dysbiose, c’est‐à‐dire de changement dans la composition ou la stabilité des populations bactériennes de l’intestin, le microbiote peut être associé à des maladies métaboliques telles que le diabète de type 2, l'obésité ou les maladies cardiovasculaires. Par ailleurs, certaines composantes du microbiote ont été associées aux maladies inflammatoires chroniques de l'intestin telles que la maladie de Crohn ou la rectocolite hémorragique[9],[10],[11], mais aussi au développement d'allergies[12] et au cancer colorectal[13].
Bien que les recherches aient progressé depuis les années 2000, grâce aux techniques de séquençage haut débit du matériel génétique, la connaissance dans ce domaine est encore exploratoire et scientifiquement incomplète. Ces hypothèses scientifiques ouvrent des pistes prometteuses, que la vulgarisation scientifique et médiatique simplifie parfois sous le terme de « deuxième cerveau »[14]. Les relations de cause à effet de corrélations observées doivent toutefois être généralement mieux établies.
Structure et écologie du microbiote intestinal
modifierL'intestin d'un humain adulte abrite environ 1 kg de bactéries actives sur une surface développée de 32 m2 (correspondant aux villosités et microvillosités). La mention d'une surface de 260 à 300 m2, équivalent à celle d'un terrain de tennis, a longtemps prévalu mais provenait de mesures réalisées sur des tissus morts[15]. La culture en laboratoire étant difficile, ce sont les techniques de biologie moléculaire associées à des outils bioinformatiques qui ont permis de décrire l'écologie et la structure du microbiote intestinal humain[16].
Dans un article paru dans l'American Journal of Clinical Nutrition en 1972[17], le nombre de cellules microbiennes était estimé à 10 fois le nombre de cellules humaines[18], soit cent mille milliards de microorganismes (1014)[19]. En tenant compte d'un vaste corpus de données expérimentales récentes, des chercheurs israéliens estiment plutôt que le nombre total de bactéries hébergées par « l'individu de référence » (un être humain âgé de 20 à 30 ans, pesant 70 kg et mesurant 1,70 m) est de 3,9 × 1013, à peu près autant que le nombre de cellules humaines, avec une marge d’erreur de 25 %[20].
De plus, le nombre des gènes du microbiote, le métagénome, est au moins 150 fois plus important que celui du génome humain, 22 000 pour ce dernier contre 3,3 millions pour le premier décompte publié sur le microbiome intestinal. Tout au long du tractus digestif, il existe un gradient de concentration en bactéries. La densité maximale est atteinte dans notre côlon distal avec 1011 bactéries pour un gramme de contenu[21],[22].
L’intestin bénéficie d’une protection immunitaire tout en évitant une réponse inflammatoire alors que la muqueuse intestinale est constamment exposée à deux entités allogènes, les aliments et le microbiote. C'est pourquoi il est considéré par les chercheurs comme un paradigme central du concept d’organe immunoprivilégié[23].
Saisonnalité et environnement
modifierSaisonnalité
modifierL'alimentation influe fortement sur le microbiote. Chez nos ancêtres chasseurs-cueilleurs — au moins dans les environnements aux saisons marquées —, le microbiote du tube digestif (et peut-être de la peau) devait évoluer saisonnièrement avec des profils bactériens, s'adaptant aux saisons sèches et humides ; ensuite, l'expansion de l'agriculture l'a probablement stabilisé[24].
Cette hypothèse a été récemment confirmée en 2017 par l'étude du microbiote de 188 membres du peuple Hadza parmi le millier environ vivant encore près du lac Eyasi dans la vallée du Rift en Tanzanie. Cette population a encore un mode de vie très traditionnel de chasseurs-cueilleurs, évitant presque l'agriculture pour vivre essentiellement de la chasse et de la cueillette[24]. En 2014, des anthropologues ont constaté que beaucoup de Hadza abritaient une population bactérienne intestinale bien plus variée que celle des Occidentaux modernes (et l'étude a montré au passage que les Hadza ne souffrent ni de cancer du côlon, ni de colite ni de la maladie de Crohn)[24]. Les bactéries intestinales des Hadza semblaient aussi s'être spécialisées dans la réduction de leur alimentation riche en fibres. L'alimentation des Hadza varie fortement selon les saisons : en saison humide, les baies et le miel dominent, alors que la viande (phacochère, antilope et girafe notamment) domine en saison sèche, mais certains tubercules ou fruits (celui du baobab par exemple) sont consommés toute l'année[24]. Les analyses ARN de leur microbiote intestinal ont montré que sa biodiversité augmente beaucoup en saison sèche (par rapport à celle de la saison des pluies) avec des bactéries du genre Bacteroides alors particulièrement abondantes. C'est la première étude qui prouve un cycle saisonnier dans le microbiome humain. Les enzymes biosynthétisés par ces bactéries (qui rendent digestibles les glucides végétaux) sont plus abondantes en saison sèche, ce qui semble contre-intuitif car les Hadza mangent alors plus de viande et moins de plantes[24].
Le protocole d'étude ne prévoyait pas de dresser la liste des aliments précisément ingérés par chaque donneur d'échantillon d'excrément, ce qui ne permet pas de préciser d'autres éventuels liens entre le régime alimentaire et le microbiote. Mais elle invite à penser que nos ancêtres humains avaient un microbiote évoluant saisonnièrement (comme celui d'autres animaux). L'intestin humain pourrait avoir un « biorythme » synchronisé avec le rythme d'évolution de ses ressources naturelles alimentaires, et dans les zones aujourd'hui très agricoles ou industrialisées, ce microbiote pourrait éventuellement être désynchronisé d'avec le cycle des saisons, peut-être (mais ce serait à confirmer) en affectant notre santé intestinale.
Les Hadza ne présentent pas un « microbiome ancestral » spécifique, c'est la diversité des bactéries qu'ils abritent qui est simplement plus grande et varie selon les saisons.
Les auteurs notent qu'il est de plus en plus difficile de faire ce type d'étude car les chasseurs-cueilleurs sont moins nombreux chaque année, quittant leur mode de vie pour s'intégrer dans les communautés villageoises ou urbaines voisines. En outre, les ONG et instances gouvernementales leur distribuent une aide alimentaire composée surtout de farine de blé et de maïs qui ne varie pas selon les saisons. Mieux connaître leur santé, leur biologie et leur état nutritionnel pourrait aider à améliorer la pertinence des aides alimentaires, plaident les auteurs.
Environnement et contexte
modifierUne autre étude, métagénomique, confirme en 2018 une étude de 2016[25], selon laquelle l'environnement joue un rôle important dans la structuration du microbiote, et ce rôle prédomine largement (par rapport à l'ascendance génétique de l'hôte) comme déterminant de la formation du microbiote intestinal humain. Ce travail montre aussi que plusieurs phénotypes humains sont aussi fortement associés à leur microbiome intestinal qu'à la génétique de l'hôte[26]. Cette étude repose sur les données génotypiques et microbiomatiques de 1 046 sujets sains, ayant des origines ancestrales distinctes. En 2013, Song et ses collègues avaient d'ailleurs déjà montré que les personnes d'une famille cohabitant sous un même toit partagent une partie de leurs microbiote intestinal, y compris avec leur chien[27]. L'étude de 2018 confirme que ceci est également vrai pour des personnes génétiquement non apparentées[26].
Les Coréens et les Japonais seraient mieux protégés des cancers, obésité et maladies cardiovasculaires, du fait de leur consommation d'algue alimentaire. Selon une étude réalisée à la station biologique de Roscoff en 2010, la digestion des algues du genre Porphyra — parmi les ingrédients culinaires Nori — induirait un transfert de gènes de bactéries marines aux bactéries du microbiome intestinal, avec un effet favorable pour défenses immunitaires humaines[28].
Le régime alimentaire, mais aussi les médicaments (antibiotiques en particulier), jouent un rôle important pour expliquer les différences de microbiote observés entre des personnes proches et vivant dans un même environnement[26].
Connaitre le microbiome d'une personne améliore significativement la précision de prédiction pour de nombreux traits humains dont le taux de glucose sanguin (modulé par le microbiote[29]) et le risque d'obésité, bien mieux que les modèles uniquement basés sur des données génétiques et sur l'environnement de l'hôte[26].
Ces résultats suggèrent qu'il doit être possible de manipuler le microbiote pour améliorer la santé, dans différents contextes génétiques[26].
Écologie et composition
modifierLe microbiote intestinal est composé dans une très large majorité de bactéries anaérobies. La quantité d'Archaea et de Fungi est plus faible. La diversité des virus présents dans le microbiote est très importante (plus de 140 000 bactériophages identifiés dans une étude métagénomique en 2021)[30] mais elle reste à être explorée et faible par rapport à la diversité dans le sol (abritant une vingtaine de groupes différents de bactéries), ce qui suggère que le microbiote intestinal a été « trié » à partir du milieu en fonction de facteurs biologiques (sexe, âge) et culturels (mode de vie, hygiène, alimentation)[31].
95 % du microbiote est représenté par quatre phyla bactériens[32] sachant qu'il y en a plus de 60 :
- les Firmicutes (on y trouve notamment les genres : Ruminococcus, Clostridium, Lactobacillus (dont plusieurs souches utilisées comme probiotiques), et des Eubacterium, Faecalibacterium et Roseburia (productrices de butyrate) ;
- les Bacteroidetes (dans ce groupe, les Bacteroides, Prevotella et Xylanibacter dégradent une grande variété de molécules complexes de glycanes) ;
- les Actinobacteria (ce groupe inclut les genres Collinsella et Bifidobacterium (dont certaines souches de probiotiques connus) ;
- les Proteobacteria (dont communément des Escherichia (de la famille des Enterobacteriaceae) et des bactéries du groupe Desulfovibrio (bactéries réductrices de soufre).
La plupart des genres bactériens cités ci-dessus (Bacteroides, Prevotella, Alistipes, Akkermansia, Oscillibacter, Clostridium, Faecalibacterium, Eubacterium, Ruminococcus, Roseburia, et Bifidobacterium) font partie du microbiote en dominance. Les genres tels que Escherichia et Lactobacillus se retrouvent en plus faible quantité. D'autres groupes bactériens rares ont aussi été détectés, tels que Fusobacterium, Lentisphaerae, Spirochaetes et TM7[33],[34].
Les genres de Fungi actuellement connus du microbiote intestinal comprennent Candida, Saccharomyces, Aspergillus et Penicillium.
Chez les archées, un seul genre, Methanobrevibacter, et plus particulièrement l'espèce Methanobrevibacter smithii, a d'abord été observé, impliqué dans la méthanogenèse intestinale[35]. Puis la biologie moléculaire (ex. : utilisation du cistron mcrA, comme marqueur moléculaire de la méthanogenèse et du gène codant l’ARNr 16S) a montré qu'on avait sous-estimé la diversité des Archaea : avant 2009, rien que dans l'intestin de 63 humains (nouveau-nés, adultes et âgés), de nouveaux phylotypes ont été découverts, ne figurant dans aucun des cinq ordres méthanogènes déjà décrits[36]. Il pourrait s'agir de méthanogènes et/ou de méthanotrophes, peut-être affiliés aux Thermoplasmatales ou cohabitant avec des membres encore inconnus de ceux-ci[36]. Ces phylotypes nouveaux étaient d'autant plus présents que l'hôte était âgé, ce qui interroge quant à leur origine et leur rôle dans le microbiote intestinal humain[36]. Les données microbiologiques et les mesures de méthane faites dans l’air expiré laissent penser que l’intestin humain n'est pas colonisé par les méthanogènes avant l’âge de 2-3 ans (selon Bond et al. en 1971[37], selon Rutili et al. en 1996[38] ou transitoirement seulement dès la première année de vie selon Palmer et al. en 2007[39]).
Des chercheurs envisagent le microbiote intestinal comme un organe à part entière, « comme un « organe » métabolique superbement adapté à notre physiologie, qui prend en charge des fonctions que nous n'avons pas eu besoin de développer nous-mêmes. Ces fonctions comprennent la capacité de traiter des éléments autrement indigestes de notre diète, comme des polysaccharides végétaux »[40].
L'estomac et l'œsophage sains sont relativement « stériles » à cause de leur pH acide. Le duodénum et le jéjunum comprennent essentiellement des bactéries aérobies-anaérobies facultatives (104 à 105/ml, surtout des streptocoques). L'iléon contient des anaérobies prédominants (105 à 108/ml). Le côlon voit une prédominance d'anaérobies stricts (109 à 1011/gramme de selles). La matière fécale contient 1010 à 1011 de bactéries vivantes et mortes/gramme de selles[41].
Structure et biodiversité
modifierLe microbiote intestinal humain se compose de microorganismes. L'abondance de ces espèces diffère d'un individu à l'autre, mais sa composition semble rester relativement stable chez l'adulte sain. Une étude de 2014 a ainsi identifié 160 espèces bactériennes par individu parmi le millier d’espèces microbiennes qui ont pu être identifiées dans différentes cohortes humaines[42]. L'Institut national de la recherche agronomique a reconstitué 238 génomes de bactéries intestinales[43].
Avant 2014, 75 % des génomes bactériens intestinaux étaient encore inconnus[44]. Ceci donne une meilleure idée de la richesse génétique de l'écosystème bactérien de l'intestin humain : un métagénome de plus de trois millions de gènes, soit 120 fois plus que le génome humain. Les analyses statistiques de ces communautés intestinales seront dorénavant plus précises. Début 2019, une analyse métagénomique a ainsi révélé 2 000 espèces de bactéries intestinales jusqu'alors inconnues[45].
La métagénomique a mis en évidence des marqueurs de composition et de diversité du microbiome[46]
Noyau phylogénétique et fonctionnel
modifierChaque personne possède son propre microbiote, mais des chercheurs ont mis en évidence l'existence d'une centaine d'espèces bactériennes partagées par tous qui constitueraient le noyau phylogénétique du microbiote intestinal humain. Celles-ci représentent en masse plus du tiers du microbiote intestinal[34].
Le microbiote regroupe plusieurs fonctions essentielles à son hôte humain, également partagées par tous les individus sains[33].
Entérotypes
modifierLes espèces microbiennes du microbiote semblent ne pas s'associer au hasard ; il existerait un ensemble limité de communautés possibles dites « entérotypes »[47]. À ce jour, trois types de communautés du microbiote ont été décrites, l'une étant dominée par le genre Bacteroides, l'autre par Prevotella et enfin le dernier, plus complexe et diversifié, dominé par les genres microbiens appartenant à l'ordre des Clostridiales tels que Ruminococcus. Ces trois grands entérotypes ne seraient pas influencés par le sexe, l'âge ou l’origine géographique[47].
Plusieurs autres études, réalisées sur des cohortes de patients, ont également pu détecter les entérotypes[48],[49], mais l’existence même des entérotypes reste encore discutée[50].
Par ailleurs, il a été rapporté que les entérotypes pourraient être associés à une alimentation particulière. En effet, les entérotypes dominés par les Bacteroides sont associés à une alimentation riche en graisses animales et/ou en protéines. Ceux dominés par les Prevotella correspondent aux régimes riches en glucides[48]. De plus, une étude récente a exploré les structures latentes du microbiome intestinal humain tout au long de la vie humaine, en appliquant des approches de partitionnement, de temporalité et d'ordination à plus de 35 000 échantillons. Les résultats ont révélé l'existence de différentes communautés au sein du microbiome intestinal, appelées "états écologiques", qui sont interconnectées dans des groupes plus vastes appelés "branches du microbiome". Ces branches représentent un continuum de configurations du microbiome, reliant dynamiquement les états écologiques locaux. Ce concept étend le concept des entérotypes[51].
Une autre étude a montré qu'il existait des entérotypes similaires à ceux de l'humain chez les chimpanzés, suggérant que les entérotypes seraient issus de la coévolution entre l'hôte et son microbiote[52].
Évolution au cours de la vie
modifierChez l'adulte en bonne santé, les composantes principales du microbiote restent stables. En revanche, chez les bébés, le microbiote change très rapidement au cours des trois premières années de vie avant de devenir mature, c’est-à-dire identique à celui de l’adulte. La composition de son microbiote varie donc selon le mode de naissance[réf. nécessaire], par voie basse ou césarienne, puis selon l'environnement post-natal : antibiothérapies, alimentation au sein ou au lait de vache, etc.
Au plan quantitatif, le nouveau-né se constitue rapidement un microbiote aussi complexe que celui des adultes, notamment au cours de la diversification alimentaire lors du sevrage. Ce microbiote atteint un équilibre fonctionnel au bout de deux ou trois années[53].
La composition de l'alimentation de l'enfant et de l'adolescent influe fortement sur celle du microbiote. Ainsi, le microbiote fécal d'enfants africains ruraux ayant une alimentation plus riche en fibres et produits végétaux présente moins de Firmicutes et un taux plus élevé de Bacteroidetes (Prevotella et Xylanibacter surtout) alors que les enfants italiens ayant une alimentation plus sucrée et carnée ont un microbiote plus riche en Enterobacteriaceae (Escherichia surtout[54]). Le microbiote semble dans les deux cas s'être adapté à l'alimentation de l'hôte.
Dès la diversification alimentaire, les espèces appartenant aux phyla Bacteroidetes et Firmicutes surpassent en nombre les populations bactériennes de départ.
Enfin chez les personnes âgées, l'écosystème intestinal permet plus d'aérobiose. De ce fait, on y trouve une proportion plus importante de protéobactéries, dont l'espèce Escherichia coli. En parallèle, la population de bifidobactéries décline et leur diversité s'affaiblit. Les changements de composition du microbiote peuvent être dus à une altération partielle du tractus intestinal et peuvent être à l’origine de la malnutrition des personnes âgées[55].
Plus généralement, ce sont les pratiques culturelles, les styles de vie, les modes alimentaires à l’échelle locale voire mondiale qui entreraient en jeu dans l’interaction entre le microbiote et la santé[56].
Effets de l'exercice
modifierIl a récemment été mis en évidence un lien entre microbiote intestinal et exercice physique. Les interactions entre le microbiote intestinal et les performances physiques dépendent notamment de l'intensité de l'exercice et du niveau d'entraînement[57].
Rôles du microbiote intestinal
modifierCertains auteurs suggèrent de considérer le microbiote en tant qu’entité ou qu’organe métabolique associé à l’organisme de leur porteur ; un organe composé d’un nombre d’organismes pouvant atteindre 1013 individus, dominés par des bactéries anaérobies, et pouvant comprendre 500 à environ 1 000 espèces dont le génome collectif est estimé contenir 100 fois plus de gènes que le génome humain. Dans la littérature scientifique, on distingue trois grandes « fonctions » du microbiote intestinal humain :
- fonction physiologique : Modifications histologiques, l'épaisseur et le renouvellement de la muqueuse de l'intestin, la taille des villosités et de la bordure en brosse, l'angiogenèse sont corégulés par le microbiote[58] ;
- fonction immunitaire
- fonction digestive : les matériaux alimentaires non digestibles (ex. : fibres de polysaccharides végétaux) sont dégradés par les microbiotes, via la fermentation colique (fonction de digestion) qui produit des acides gras volatils ; ces gaz fermentaires ne couvrent que 5 à 10 % (et non 80 % comme chez les ruminants) des besoins énergétiques totaux[59]. Le microbiote produit des acides aminés essentiels (tryptophane, tyrosine et histidine en particulier), des vitamines (K, B9, B12...), des bioconversions de substances en micronutriments assimilables bénéfiques pour la santé[60] ou influençant le stockage de graisses[61]. Sans microbiote intestinal, l’organisme humain ne peut utiliser les polysaccharides complexes tels que les fibres alimentaires car les cellules humaines ne possèdent pas les enzymes nécessaires à leur dégradation[62],[63].
L'exploration du métagénome, association du génome humain de l'hôte et de celui, bien plus riche, du génome du microbiote, permet régulièrement de découvrir, au sein de cette population intestinale de microorganismes essentiellement constituée de bactéries, des microbes qui semblent avoir un rôle important. Tel est le cas de la bactérie Akkermansia muciniphila : grâce à son action d'hydrolyse de la mucine au niveau de la muqueuse intestinale, elle empêche le mucus de s'accumuler, module la perméabilité intestinale et a des effets sur l'inflammation au niveau du tube digestif, mais aussi au niveau hépatique et sanguin[64].
Fonction immunitaire
modifierSans microbiote, le système immunitaire est moins actif. Le microbiote est impliqué dans certaines maladies inflammatoires et allergiques[65]. La diversité biologique des bactéries microbiotes évite ainsi la pullulation d'une seule espèce bactérienne ou la colonisation du tube digestif par d'autres microorganismes qui seraient pathogènes[66] ;
L’inflammation est un processus biologique important, étroitement corrélé à l’immunité : il existe à la fois un niveau d’inflammation physiologique, indispensable à l’activation immunitaire et qui permet notamment le contrôle du microbiote, et des réactions inflammatoires importantes, déclenchées en présence d’espèces pathogènes. Ce dernier mécanisme repose notamment sur la présence de composants bactériens inflammatoires, comme les lipopolysaccharides (LPS) présents à la surface de certaines bactéries (Gram négatif). Ces antigènes provoquent une réaction immunitaire qui conduit à la production de médiateurs pro-inflammatoires (cytokines) par les macrophages de l’intestin. Une inflammation locale est déclenchée et la perméabilité de la paroi intestinale augmente. Les LPS peuvent alors traverser cette dernière, passer dans la circulation sanguine, et provoquer un phénomène inflammatoire dans d’autres tissus cibles[67].
Stimulation du système immunitaire
modifierLe système immunitaire est responsable de la reconnaissance et de la réponse à apporter à la présence de molécules étrangères ou locales. Il apparaît que certaines de ses fonctions sont liées au rapport qu’a l’hôte humain avec son microbiote[68]. Quelques espèces bactériennes symbiotiques ont montré une capacité à prévenir le développement de maladies inflammatoires. Le microbiote contient également des microorganismes capables de susciter l’inflammation sous certaines conditions[69],[70]. Le microbiote a donc la possibilité de commander des réponses pro- et anti-inflammatoires. La composition du microbiote intestinal pourrait être liée à son bon fonctionnement[69],[71],[72].
Maladies inflammatoires chroniques de l’intestin
modifierLe rôle du microbiote intestinal humain dans les maladies inflammatoires chroniques de l'intestin reste encore à explorer. Cependant, certaines composantes bactériennes semblent être associées avec la maladie de Crohn. En effet, les groupes de bactéries faisant partie des Clostridiales comme Faecalibacterium étaient appauvris chez les malades atteints par cette maladie[73]. Par ailleurs, il a été montré que l'espèce Faecalibacterium prauznitzii pourrait être un marqueur de la récidive chronique chez les malades de Crohn[73] et qu'elle pourrait avoir un rôle protecteur par ses propriétés anti-inflammatoires[74].
Fonction métabolique
modifierLe microbiote intestinal est l'équivalent d'un organe supplémentaire qui a une activité métabolique globale égale à celle d’un organe comme le foie[75]. Mieux comprendre le fonctionnement des interactions entre le microbiote et son hôte devrait donc permettre d'améliorer le diagnostic, le pronostic et le traitement de maladies métaboliques (probiotique, prébiotique, greffe de microbiote, etc.).
Obésité
modifierL’augmentation des Firmicutes et la chute des Bacteroidetes s’accompagneraient d’une faculté du microbiote à stocker plus facilement l’énergie apportée par l’alimentation. Ceci constituerait un facteur de risque pour l’obésité[76],[77],[78]. Cependant, ces résultats restent encore controversés et n’ont pas été reproduits par d'autres études[63]. En effet, le microbiote serait lui-même en grande partie controlè par le système immunitaire[79]. Du point de vue pratique, on peut mettre en évidence des probiotiques qui incitent à la prise de poids et d'autre ayant l'effet inverse[réf. nécessaire]. Par ailleurs, une autre étude a permis de corréler les paramètres métaboliques avec la richesse en gènes dans le microbiote intestinal. Cette richesse en gènes étant modélisable en traçant une dizaine d’espèces microbiennes seulement[80]. D'autre part, cette richesse en gènes du microbiote est associée à la perte de poids sous un régime hypocalorique. En effet, ce sont les individus plus riches en gènes qui ont perdu du poids et cela même après une phase de stabilisation[81].
Diabète
modifierLe microbiote intestinal est un facteur clé dans l'insulino-résistance[82]. Par ailleurs, des chercheurs ont réussi à classer des patients atteints de diabète de type 2 en fonction de leur microbiote intestinal[82]. Chez ces patients, une baisse significative de bactéries produisant du butyrate et une hausse de bactéries opportunistes causant un état inflammatoire chronique ont été observées[82]. Environ 60 000 gènes du microbiote intestinal seraient associés avec le statut diabétique (type 2) du patient[82].
Une étude sur des patients obèses ayant d’une part un diabète de type 2 et ayant d’autre part subi une opération de chirurgie bariatrique a montré que leur microbiote s'adapte à leurs paramètres métabolique et inflammatoire[83].
Digestif
modifierLa digestion des sucres complexes s’effectue au niveau du côlon sous l'action d’une grande variété d’enzymes. Le microbiote est essentiel à digestion de nombreux aliments au niveau de l'intestin ou du colon. En effet jusqu'à 10 000 enzymes digestives (glycoside-hydrolases (GH) et les polysaccharide-lyases (PL) ne sont produites que par les bactéries (alors que le génome humain ne code que 17 gènes pour la digestion du lactose, du saccharose et de l’amidon). Cependant, l'humain de récupérerait qu'environ 10 % des calories provenant de la décomposition bactérienne[84]. Une modification du microbiote peut être observée dans le cas d'une colonisation bactérienne chronique de l'intestin grêle (SIBO), décelable par une analyse des gaz expirés, qui peut être un des facteurs de nombreux troubles gastrointestinaux fonctionnels[85].
Chez les patients atteints du syndrome de l'intestin irritable (SII), une étude a identifié une signature microbienne intestinale associée à la gravité des symptômes, négativement associée à la richesse microbienne et à la présence de méthane expiré. Les patients SII ayant une plus grande sévérité de symptômes sont plus prévalent dans l'entérotype enrichi en Bacteroides[86]. De plus, l'interaction entre le régime alimentaire et le microbiome intestinal joue un rôle crucial dans les symptômes du SII, où une alimentation de moindre qualité est associée à une sévérité accrue des symptômes, révélant des interactions complexes entre la diète, le métabolisme de l'hydrogène du microbiote et le métabolisme des glucides d'origine animale[87].
Chirurgie gastrique
modifierLe bypass gastrique est une des procédures les plus efficaces pour traiter l’obésité morbide. Elle permet, en plus d'une perte de poids, des modifications des paramètres inflammatoires. Il a été observé que le microbiote s’adapte à ces nouvelles conditions digestives. certains groupes bactériens, comme Feacalibacterium, étant associés aux paramètres inflammatoires tandis que d'autres comme Bacteroides étaient associés à la prise alimentaire[88]. Sur cette même cohorte, il a été observé avec une approche métagénomique ciblée sur les gènes de l'ARN 16S que la diversité bactérienne augmentait après le bypass gastrique et que la composition du microbiote était corrélée après bypass avec l'activité des tissus adipeux[89].
Axe cerveau/intestin
modifierDéveloppement cérébral
modifierNon seulement le fonctionnement du cerveau humain serait sous l'influence du microbiote intestinal, et ce de façon très précoce, mais aussi de son développement[90].
Autisme
modifierSelon Robel et al., il n'est pas démontré que la fréquence des troubles digestifs serait plus élevée chez les enfants autistes que chez les enfants neurotypiques, ce qui « suggère qu'il s’agit de l’association fortuite de deux troubles, plutôt qu’un phénomène impliqué dans la physiopathologie de l'autisme »[91].
En 2019, une étude publiée dans Scientific Reports a suggéré des effets positifs à long terme la thérapie de transfert du microbiote (MTT) chez les enfants autistes[92].
Des greffes fécales personnalisées de microflore intestinale ont été effectuées sur 18 enfants âgés de 7 à 17 ans souffrant de problèmes gastrointestinaux, dans le but de rétablir la diversité bactérienne dans le tube digestif[92].
Deux ans après le traitement, les chercheurs observent concernant les troubles du comportement lié au TSA que[92] :
- la sévérité des symptômes typiques est diminuée de 47 % (contre 20 % au bout de 2 mois) ;
- 17 % des participants sont diagnostiqués autistes graves contre 83 % avant le traitement ;
- 83 % sont considérés avoir un TSA léger ou modéré contre 17 % avant le traitement.
Les parents ont également signalé une réduction lente mais constante des symptômes du TSA pendant le traitement. Le traitement a augmenté considérablement la diversité microbienne intestinale des sujets et deux ans après la greffe fécale, celle-ci était encore plus élevée et les bactéries essentielles Bifidobacteria et Prevotella étaient toujours présentes[92].
En raison de la petite taille de l'échantillon utilisé, des recherches supplémentaires sont nécessaires pour vérifier l'utilité thérapeutique du traitement par transfert de microbiote. L’équipe de recherche envisage de continuer le suivi ces 18 enfants et de réaliser prochainement un essai sur des adultes et une autre population placebo.
La Revue médicale suisse nuance fortement les conclusions portées dans la presse grand public, notant que « les matières fécales sont actuellement portées au firmament par la communauté scientifique » et que « Chaque mois, d’autres indications thérapeutiques de la transplantation fécale viennent s’ajouter à la longue liste des vertus fantasmées »[93].
Quelques études ont tenté de comparer les microbiotes de personnes autistes et non autistes : des changements en composition bactérienne peuvent significativement apparaître mais cela n'a pas été confirmé dans toutes les études. De plus, il est difficile d'établir si ces changements sont une cause ou une conséquence de l'autisme[94].
Schizophrénie
modifierDes études mettent en avant la possibilité d'un rôle clé du microbiote intestinal dans la pathogénie de la schizophrénie[95].
État psychique, stress, anxiété et addiction
modifierLe microbiote sécrète des vitamines et produit ou dégrade de très nombreuses molécules dont certaines ont une importance pour le cerveau. Il varie cependant d'une population à une autre, ce qui rend difficile l'interprétation de certaines différences statistiques ou épidémiologiques. Un nombre croissant d'études sur le modèle animal, puis sur l'Homme (mais avec un petit nombre de patients), laissent penser qu'il existe une connexion bidirectionnelle microbiome-cerveau (peut-être via le nerf vague qui relie directement l'intestin et le cerveau). Ainsi, le microbiome pourrait agir sur l'humeur ou le stress et le comportement, et inversement peut-être[96].
Il a par exemple été montré que des souris axéniques (sans microbiote) présentaient une altération de la réponse au stress et avaient, par conséquent, une baisse de l'anxiété en comparaison avec des souris conventionnelles (avec microbiote)[97]. A contrario, des chercheurs ont montré que des rats dépourvus de microbiote sont plus susceptibles au stress et à l’anxiété (selon des travaux menés par l’Unité Micalis de Jouy-en-Josas).
En 2019, une étude publiée dans Nature Microbiology ayant porté sur deux grands groupes d’Européens a conclu que certaines espèces de bactéries intestinales sont absentes de l'intestin de personnes souffrant de dépression, sans pouvoir encore dire s'il s'agit d'une cause ou d'une conséquence de la dépression[98]. Les auteurs estiment que certaines bactéries intestinales pourraient produire des molécules affectant le système nerveux, voire l'humeur. Des essais de greffe fécale notamment prévues par l'Université de Bâle (Suisse) devraient montrer s'il est ainsi possible de restaurer ou de modifier le microbiome intestinal de personnes déprimées[99]. En Belgique, le microbiologiste Jeroen Raes, de l'Université catholique de Louvain et son équipe ont examiné un panel de 1 054 personnes recrutées pour l'étude de leur microbiome[100] ; dans ce groupe, 173 personnes étaient dépressives ou estimaient avoir une qualité de vie médiocre. Leur microbiome a été comparé à ceux des autres membres du groupe et il est apparu que deux types de microbes (Coprococcus et Dialister) manquaient dans les microbiomes des sujets déprimés, alors qu'ils étaient toujours présents dans l'intestin de ceux qui affirmaient jouir d'une bonne qualité de vie[99]. Cette différence persistait même après la prise en compte de l'âge, du genre, d'utilisation d'antidépresseurs (trois facteurs connus pour influencer tout microbiome). Cette étude a aussi montré que le microbiome des dépressifs contenait plus de bactéries impliquées dans la maladie de Crohn, évoquant un phénomène inflammatoire associé (cause ou conséquence possible)[99]. Les auteurs de cette étude ont aussi examiné les résultats d'un autre panel de 1064 Néerlandais dont le microbiome avait été échantillonné ; dans ce groupe, les deux mêmes espèces étaient absentes chez les dépressifs et notamment chez sept sujets diagnostiqués pour dépression clinique grave. Une relation de cause à effet n'est pas encore certaine et d'autres études sont nécessaires pour la prouver et la comprendre le cas échéant, mais les indices plaident pour une relation liant l'humeur aux microorganismes intestinaux[99].
Depuis les années 2010, des médecins et entreprises explorent certains probiotiques (en prise orale le plus souvent) pour traiter la dépression, mais n'incluaient pas les microbes intestinaux manquants identifiés dans cette étude. André Schmidt (un neuroscientifique de l'Université de Bâle, en Suisse) est responsable d'un essai clinique de greffe fécale chez 40 personnes déprimées, et à l'Institut Karolinska (Stockholm, en Suède) le biologiste Sven Pettersson suggère aux cliniciens de la santé mentale d'envisager le profilage du microbiome de leurs patients. Raes et al. ont déjà listé 56 molécules produites ou dégradées par les microbes de l'intestin humain, toutes nécessaires au bon fonctionnement du système nerveux[99]. Les bactéries du genre Coprococcus semblent par exemple influer sur le système dopaminergique (la dopamine est une molécule essentielle pour le fonctionnement cérébral et elle est impliquée dans la dépression). Mais les chercheurs ignorent encore s'il est possible - et comment - maitriser le microbiote pour protéger de la dépression. Le même Coprococcus sécrète aussi un anti-inflammatoire (le butyrate) et il est connu que des processus inflammatoires peuvent contribuer à la dépression[99].
Sur la base de ces découvertes, d’autres études ont été menées sur les possibles impacts du microbiote sur l’addiction à l’alcool. Les chercheurs ont identifié deux groupes parmi des patients qui venaient de suivre une cure de désintoxication : un premier échantillon dont les individus présentaient une grande perméabilité de l’intestin due à un déséquilibre du microbiote et un deuxième dont la perméabilité de l’intestin et la flore bactérienne des individus était normale. Ils ont ensuite comparé l’état psychique de ces individus après la cure et ont constaté que les individus du premier groupe exprimaient davantage le désir de consommer de l’alcool. Leur taux de rechute était également beaucoup plus important, laissant supposer qu’un microbiote sain pourrait aider à surmonter certaines addictions[101].
En 2017, les scientifiques de l'Université de Cork, Irlande[102], ont étudié la relation entre le microbiote intestinal et l'amygdale (une région dans notre système nerveux central qui joue un rôle dans le traitement des émotions et la modulation du comportement) en utilisant des rats axéniques (sans microbiote). Chez ces rats, il a été démontré que l'absence de microbiote augmente le comportement de type anxieux. Pour confirmer l'hypothèse, ils ont effectué une greffe de microbiote fécal des rats déprimés à des rats en bonne santé, et la greffe a pu augmenter les comportements anxieux et dépressifs chez les rongeurs récepteurs.
La recherche sur cette relation est relativement nouvelle. Néanmoins, elle semble prometteuse et pourrait être utile pour traiter des troubles liés à l'amygdale.
Des études plus approfondies sont nécessaires pour déterminer si tous ces résultats pourraient être appliqués à l'humain, et si les corrélations trouvées sont bien des relations de cause à effet, dans un domaine la multiplication des études aux méthodologies souvent faibles trouve toutefois une large médiatisation et acceptation par le grand public[103].
Grossesse
modifierUne étude publiée dans la revue Cell en , 91 femmes enceintes ont été suivies afin de caractériser plus précisément l'évolution du microbiote intestinal pendant la grossesse[104]. Il s’avère que la composition du microbiote change fortement. Des échantillons de matière fécale du 1er puis du 3e trimestre ont été comparés, permettant de décrire une évolution menant vers une plus grande inflammation et une perte d'énergie. Au cours de la même étude, ces observations ont été confirmées par transplantation de microbiote dans des souris axéniques, c’est-à-dire dépourvues de microbiote[104].
Impact des antibiotiques
modifierLes traitements par antibiotiques affectent l’écologie du microbiote intestinal et ses rapports avec l’hôte humain. Il a été montré que la ciprofloxacine avait un effet important et rapide sur le microbiote intestinal[105] avec une perte de la diversité bactérienne et un changement de la composition de la communauté en 3-4 jours après la prise de l'antibiotique.
Traitement des maladies et désordres liés au microbiote intestinal humain
modifierPrébiotique et probiotique
modifierUn prébiotique est un ingrédient non digestible qui a des effets bénéfiques sur la santé en stimulant sélectivement la croissance ou l'activité d'une bactérie spécifique (ou d'une population bactérienne restreinte) du côlon. Selon l'OMS/FAO, un probiotique « est un microorganisme vivant qui, ingéré en quantité suffisante, produit des effets bénéfiques sur la santé de celui qui le consomme »[106].
Bactériothérapie fécale
modifierLa bactériothérapie fécale, également appelée greffe microbienne fécale, consiste à utiliser le microbiote d’un individu sain, qui agit comme donneur de selles, comme le traitement d’un patient dont le microbiote intestinal est perturbé[107]. Cette technique est pour le moment principalement utilisée pour le traitement des infections récurrentes par Clostridium difficile, mais est également envisagée pour le traitement d’autres maladies[108].
Recherche
modifierCatalogage et caractérisation taxonomique et fonctionnelle du microbiote intestinal humain
modifierGrâce aux progrès de la mises en culture[109],[110],[111] (mais on ignore encore comment cultiver de nombreux microbes, intestinaux notamment), grâce à un travail collaboratif entre équipes de recherche (Human Microbiome Project Consortium[112], grâce aux observations microscopiques et aux progrès du séquençage génétique et de la métagénomique[113],[114] la science progresse dans la constitution du catalogue bactérien du microbiote intestinal humain[115]. Cependant cet inventaire est encore en 2019 très incomplet[116]. Il est également confirmé que le microbiote intestinal est chez la femme (et donc chez le nouveau-né) en partie lié avec celui de la vessie et du vagin[117].
Étude du microbiote à l'aide d'animaux axéniques
modifierUn des moyens d'en étudier les propriétés et fonction et interactions avec la physiologie et le métabolisme de l'hôte est de coloniser de manière contrôlée le tube digestif de rats ou souris axéniques (c'est-à-dire nés et élevés sans exposition à des microbes vivants). Ces animaux sont colonisés par une flore microbienne sélectionnées d'une ou plusieurs espèces, ou de communautés entières provenant de murins normaux ou malades ou d'humains. Les chercheurs peuvent alors examiner la transmissibilité de phénotypes supposés physiologiques et/ou pathologiques, et tester le rôle du microbiote pour un ou plusieurs phénotypes particuliers. On a ainsi récemment montré que le microbiote intestinal contrôle ou régule chez les souris ainsi testées la masse osseuse[118], le stockage des graisses corporelles[119], l'angiogenèse intestinale[120],[121] et le bon développement de la réponse immunitaire[122].
On a aussi montré chez les souris axéniques que la flore intestinale semble jouer un rôle majeur dans le métabolisme énergétique avec des liens possibles avec au moins une partie des formes d'obésité.
Le microbiote se montre même capable de réguler l'expression de certains gènes de l'hôte, ce qui pourrait évoquer des relations symbiotiques avancées[123].
Par la production de substances similaires aux neurotransmetteurs, les bactéries de l'intestin humain pourraient être en communication, via le système cardiovasculaire et nerveux, avec le cerveau[124]. Cette constatation ouvre une porte à de nouvelles recherches sur le microbiote intestinal comme organe ayant une influence sur le comportement.
Étude du microbiote par l'approche métagénomique
modifierLa métagénomique est le séquençage et l’analyse de l’ADN des microorganismes présents dans les échantillons de divers environnements (océan, sols, air, corps humain…) sans que la culture de ces microorganismes soit requise. Cette technique a représenté une avancée majeure dans la compréhension du microbiote intestinal humain, environnement dans lequel 75 % des bactéries ne sont pas aujourd'hui considérée comme cultivables en laboratoire. Le est lancé le projet européen MetaHIT[125]. Coordonné par l'INRA, il a pour but d'étudier le génome de l'ensemble des bactéries constituant la flore intestinale humaine afin de caractériser ses fonctions et ses implications sur la santé.
Les premiers résultats de MetaHIT :
- en 2010, une première salve de donnée montre qu'à l'âge adulte, chaque personne héberge dans son tube digestif 170 espèces bactériennes connues différentes (ce qui représente déjà un métagénome 150 fois plus important que le génome humain) dont une cinquantaine commune à plus de 90 % des individus[126]. Cette étude met en évidence 19 000 fonctions différentes de cette flore : désagrégation de substances que notre propre système est incapable de démanteler, par exemple les cartilages et les molécules de cellulose ; fonctions immunitaires ; synthèse de substances indispensables, par exemple la vitamine K, qui joue un rôle essentiel dans la coagulation sanguine ;
- en 2011, il est confirmé que les individus possèdent, comme pour les groupes sanguins, trois entérotypes, qui sont de véritables « signatures bactériennes intestinales ». Cet entérotype est spécifique de chaque individu et indépendant de l'origine géographique (pays, continent, etc.), de l'âge et de l'état de santé de l'individu. Il est défini par l'abondance de certains types bactériens et par leur « potentiel génétique (c'est-à-dire par les fonctions que leurs gènes codant) »[127] ;
- en 2019, à partir de près de 12 000 échantillons d'excréments humains, 1 952 espèces bactériennes candidates réputées non cultivables sont identifiées, élargissant très nettement le répertoire et la diversité des espèces constituant notre microbiote (+281 % de la diversité phylogénétique). Ces espèces récemment identifiées sont plus rares chez les populations déjà bien étudiées que les génomes d'isolats de référence, mais elles complètent l'inventaire pour les populations africaines et sud-américaines qui avaient été fortement sous-étudiés (de plus de 200 %). Des centaines de groupes de gènes biosynthétiques ont été identifiés chez ces bactéries-candidates et qui présentent souvent des capacités fonctionnelles spécifiques (pouvant expliquer qu'elles aient échappé aux premiers inventaires)[116].
Exemple de pathologies associées au microbiote intestinal
modifier« Toutes les maladies commencent dans l'intestin.. »
— Citation attribuée à Hippocrate[128].
Il y a depuis le début des années 2000 un consensus médical sur l'importance du microbiote pour la santé[129]. Les données acquises chez l'animal de laboratoire et chez l'humain laissent penser qu'un microbiote intestinal normal améliore le métabolisme de son hôte en accroissant le rendement énergétique et la qualité de la digestion[129]. Le microbiote intervient aussi en modifiant certains composés dérivés de l'hôte et certaines voies métaboliques, et en améliorant l'immunité[129].
Un déséquilibre du microbiote intestinal peut induire ou permettre le développement de pathologies telles que l'obésité, les maladies cardiovasculaires et certains syndromes métaboliques (diabète de type 2 notamment), notamment via la production d'inflammasomes[129].
Un déséquilibre du microbiote peut entraîner l'augmentation drastique de certaine espèce bactériennes comme C. difficile, normalement présente en quantité très faible dans le microbiote sain. Cette affection provoque des diarrhées extrêmement débilitantes. Le traitement le plus efficace à ce jour est la transplantation fécale qui supplante les antibiotiques dans ce cas précis[130].
Cependant, la grande complexité de cette communauté microbienne, virale et fongique fait que les liens de cause à effet sont encore mal compris. Des techniques récentes permettent de déduire la nature du microbiote individuel par analyse de l'haleine[131].
Les études actuelles montrent que :
- pour la maladie de Crohn, le microbiote intestinal des patients atteints montre une modification du rapport Firmicutes/Bacteroidetes, avec un rapport qui s’échelonne de 1/1 à 3/1 au lieu de 10/1 chez le sujet sain. On constate un déficit marqué du groupe Firmicutes, à la fois en nombre d’espèces et en proportion[132] ;
- pour le syndrome métabolique une altération de la richesse en espèce et en gène a été observée[133] ;
- pour le syndrome du côlon irritable une diminution des symptômes est constatée lors de l'administration de probiotiques ou d'un placebo[134]. Une altération de la microflore est retrouvée chez les patients. Leur biofilm est moins diversifié que celui des sujets sains avec une prédominance de clotridies et d'eubactéries[135] ;
- un individu obèse aurait un déséquilibre de son microbiote avec un ratio Firmicutes/Bacteroidetes de l’ordre de 100/1 (associé à un fort déficit en Bacteroidetes). La perte de poids semble liée à l’augmentation de la proportion de Bacteroidetes avec un changement du ratio qui évolue vers 10/1[132] ;
- la durée d'une diarrhée infectieuse aigüe[136] ou d'une diarrhée persistante chez l'enfant[137] est diminuée par absorption de probiotiques ;
- gastro-entérite, ulcère gastro-duodénal et autres pathologies intestinales d'origine infectieuse ou inflammatoire sont étroitement liés à un déséquilibre du microbiote[138],[139],[140] ;
- les personnes souffrant de constipation ont une augmentation de la composante méthanogène et bifidogène de leur microbiote intestinal[141]. La production de méthane semble être associée à un ralentissement du transit intestinal[142] ;
- dans le cas du cancer colorectal une étude israélienne[143] a explicité en , un processus qui expliquerait l'inhibition des cellules immunitaires par la bactérie Fusobacterium nucleatum. La bactérie Escherichia coli présente en quantité favoriserait le développement de tumeurs existantes par la production d'une toxine, la colobactine[144]. Une étude française a montré un microbiote spécifique des malades atteints de ce type de cancer, ce qui pourrait avoir des effets sur la prévention, voire le traitement[145]. Certaines bactéries secrètent en effet des substances qui ont un pouvoir cancérigène[146].
- dans le cas du cancer de l'estomac la bactérie Helicobacter pylori, inhibe entre autres la protéine protéine P53, ce qui permet aux cellules cancéreuses de proliférer[147] ;
- dans le cas des AVC, la flore bactérienne jouerait un rôle clef dans les mécanismes de formation[148].
- Dans les cancers on peut trouver des modifications des microbiotes qui pourraient avoir une influence sur l'efficacité des traitements anticancereux[149].
Mieux comprendre le fonctionnement des interactions entre le microbiote et son hôte devrait donc permettre d'améliorer les traitements de maladies métaboliques (probiotiques, prébiotiques, bactériothérapie fécale, etc.). L'exploration du métagénome (association du génome humain de l'hôte et de celui, bien plus riche du génome du microbiote) pourrait y contribuer[129].
Interactions avec les médicaments
modifierLes bactéries intestinales, en « digérant » certains médicaments, peuvent interférer avec certains traitements médicaux. Et comme le microbiote varie selon les individus, il affecte différemment l'efficacité de certains médicaments selon le patient. Ainsi, en , un article de la revue Science constate que deux bactéries de notre microbiote intestinal, Enterococcus faecalis et Eggerthella lenta, dégradent l’essentiel du principal médicament utilisé contre la maladie de Parkinson, la Lévodopa (L-dopa), qui doit arriver au cerveau pour y être converti en dopamine. E faecalis transforme le médicament en dopamine trop tôt, dans l’intestin au lieu du cerveau ; même avec le Carbidopa (composé censé inhiber la réaction de transformation dans l’intestin), jusqu'à 56 % de la L-dopa ne parvient pas au cerveau, avec des variations selon les patients[150]. Le gène et les enzymes bactériens responsables de cette biodégradaétion précoce du médicament ont été identifiés en 2019[150]. Une nouvelle molécule (AFMT), mille fois plus efficace in vitro que le carbidopa, a pu être mise au point. De plus, il semble que E. faecalis convertisse le médicament en dopamine, puis que bactérie (E. lenta) convertisse cette dopamine méta-tyramine (en) qui semble avoir des effets toxiques (troubles gastrointestinaux graves et arythmies cardiaques)[150].
Notes et références
modifier- Cet article est partiellement ou en totalité issu de l'article intitulé « Microbiote » (voir la liste des auteurs).
- La fermentation des fibres par les bactéries intestinales produit les acides gras volatils (principalement l'acétate, le butyrate et le propionate selon le type de fibres), substrats de la néoglucogenèse intestinale qui induit la satiété, la sensibilité à l'insuline et la moindre prise de poids lipidique (effet anti-diabète et anti-obésité). Cf Jean-Michel Lecerf, Nathalie Delzenne, Microbiote intestinal et santé humaine, Elsevier Masson, (lire en ligne), p. 86, F. De Vadder, D. Goncalves, J. Vinera, C. Zitoun, A. Duchampt, G. Mithieux, « Les acides gras à courte chaîne et les fibres alimentaires solubles améliorent l’homéostasie glucidique via une induction de la néoglucogenèse intestinale », Diabetes & Metabolism, vol. 39, , A26 (DOI 10.1016/S1262-3636(13)71719-1)
- « Microbiote », sur acadpharm.org (consulté le ).
- (en) Dethlefsen L, Eckburg PB, Bik EM, Relman DA. « Assembly of the human intestinal microbiota » Trends Ecol Evol. 21, 517–523 (2006)
- (en) Larsson, E. et al. « Analysis of gut microbial regulation of host gene expression along the length of the gut and regulation of gut microbial ecology through MyD88 » Gut 61, 1124–31 (2012) DOI 10.1136/gutjnl-2011-301104
- (en) Mazmanian SK, Liu CH, Tzianabos AO, Kasper DL. « An immunomodulatory molecule of symbiotic bacteria directs maturation of the host immune system » Cell 122, 107–118 (2005)
- C. Landman et E. Quévrain, « Le microbiote intestinal : description, rôle et implication physiopathologique », La Revue de Médecine Interne,
- (en) Bäckhed F, Ley RE, Sonnenburg JL, Peterson DA, Gordon JI. « Host-bacterial mutualism in the human intestine » Science 307, 1915 (2005)
- (en) Ley RE, Lozupone CA, Hamady M, Knight R, Gordon JI. « Worlds within worlds: evolution of the vertebrate gut microbiota » Nat Rev Microbiol. 6, 776–788 (2008)
- (en) Swidsinski A. et al. « Mucosal flora in inflammatory bowel disease » Gastroenterology 122, 44–54 (2002).
- (en) Manichanh C. et al. « Reduced diversity of faecal microbiota in Crohn’s disease revealed by a metagenomic approach » Gut 55, 205–11 (2006)
- (en) Vasquez N. et al. « Patchy distribution of mucosal lesions in ileal Crohn’s disease is not linked to differences in the dominant mucosa-associated bacteria: A study using fluorescence in situ hybridization and temporal temperature gradient gel electrophoresis » Inflammatory Bowel Diseases 13, 684–692 (2007)
- (en) MacDonald TT, Bell I, Monteleone G. « The opposing roles of IL-21 and TGFbeta1 in chronic inflammatory bowel disease » Biochem Soc Trans. 39, 1061–1066 (2011)
- (en) Sobhani I. et al. Microbial Dysbiosis in Colorectal Cancer (CRC) Patients« Microbial Dysbiosis in Colorectal Cancer (CRC) Patients » PLoS ONE 6, e16393 (2011)
- Christine Durif-Bruckert, « Le microbiote : cet inconnu qui réside en nous », Med Sci (Paris), vol. 32, no 11, , p. 1009-1015 (résumé).
- (en) H.F. Helander, L. Fändriks, « Surface area of the digestive tract - revisited », Scand J Gastroenterol., vol. 49, no 6, , p. 681-689 (DOI 10.3109/00365521.2014.898326).
- (en) Suau, A. et al. « Direct analysis of genes encoding 16S rRNA from complex communities reveals many novel molecular species within the human gut » Applied and environmental microbiology 65, 4799–807 (1999).
- (en) T. D. Luckey, « Introduction to intestinal microecology », American Journal of Clinical Nutrition, vol. 25, no 12, , p. 1292-1294.
- L’estimation de cet article reposait sur la supposition que 1011 bactéries sont présentes par gramme de contenu du tube digestif, lequel représente environ 1 litre, soit 1 kg.
- Jean-Claude Rambaud, Jean-Paul Buts et Gérard Corthier, Flore microbienne intestinale, John Libbey Euronext, , p. 131.
- (en) R. Sender et S. Shai Fuchs, « Revised estimates for the number of human and bacteria cells in the body. Biorxiv », Biorxiv, (DOI 10.1101/036103).
- (en) Holdeman, L. V, Good, I. J. & Moore, W. E. C. « Human fecal flora : variation in bacterial composition within individuals and a possible effect of emotional stress » Applied and Environmental Microbiology 31, 359–375 (1976)
- (en) Savage, D. C. C. « Microbial ecology of the gastrointestinal tract » Annual review of microbiology 31, 107–33 (1977)
- (en) OI Iweala, CR Nagler, « Immune privilege in the gut: the establishment and maintenance of non-responsiveness to dietary antigens and commensal flora », Immunol Rev., vol. 213, , p. 82-100 (DOI 10.1111/j.1600-065X.2006.00431.x)
- Price M (2017) Early human gut bacteria may have cycled with the season, 24 août 2017
- Xie H et al. (2016) Shotgun metagenomics of 250 adult twins reveals genetic and environmental impacts on the gut microbiome. Cell Syst. 3, 572–584
- Daphna Rothschild, Omer Weissbrod[…]Eran Segal (2018), Environment dominates over host genetics in shaping human gut microbiota |Nature |doi:10.1038/nature25973
- Song S.J et al. (2013) Cohabiting family members share microbiota with one another and with their dogs. eLife 2, e00458
- « Les forêts d'algues, une richesse insoupçonnée », sur www.larecherche.fr (consulté le )
- Zeevi D et al. (2015) Personalized nutrition by prediction of glycemic responses. Cell 163, 1079–1094
- (en) Luis F. Camarillo-Guerrero, Alexandre Almeida, Guillermo Rangel-Pineros, Robert D.Finn, Trevor D.Lawley, « Massive expansion of human gut bacteriophage diversity », Cell, vol. 184, no 4, , p. 1098-1109 (DOI 10.1016/j.cell.2021.01.029)
- (en) Lepage P. et al. « Dysbiosis in inflammatory bowel disease: a role for bacteriophages? » Gut 57, 424–5 (2008).
- (en) Valentina Tremaroli et Fredrik Bäckhed « Functional interactions between the gut microbiota and host metabolism » Nature vol. 489, p. 242-249, 2012.
- (en) Qin J. et al. « A human gut microbial gene catalogue established by metagenomic sequencing » Nature 464, 59–65 (2010).
- (en) Tap J. et al. « Towards the human intestinal microbiota phylogenetic core » Environmental microbiology 11, 2574–2584 (2009).
- (en) Steven R. Gill, Mihai Pop, Robert T. DeBoy et Paul B. Eckburg, « Metagenomic Analysis of the Human Distal Gut Microbiome », Science, vol. 312, no 5778, , p. 1355–1359 (ISSN 0036-8075, PMID 16741115, PMCID 3027896, DOI 10.1126/science.1124234, lire en ligne, consulté le )
- Agnès Mihajlovski, Réévaluation de la biodiversité du microbiote méthanogène intestinal humain et influence de l'âge sur sa constitution (thèse de doctorat en microbiologie et parasitologie), Université Blaise Pascal - Clermont- Ferrand II et Université d’Auvergne - Clermont-Ferrand I (no tel-00726349), , 271 p. (présentation en ligne, lire en ligne [PDF]).
- (en) J.H. Bond , R. Engel et M.D. Levitt, « Factors influencing pulmonary methane excretion in man. An indirect method of studying the in situ metabolism of the methane-producing colonic bacteria », The Journal of experimental medicine, 133, 1971, p. 572-588.
- (en) A. Rutili, E. Canzi, T. Brusa et A. Ferrari, « Intestinal methanogenic bacteria in children of different ages », New Microbiology, 19, 1996, p. 227-243.
- C. Palmer et al., « Development of the Human Infant Intestinal Microbiota », PLoS biology, 5, 2007, e177.
- Fredrik Bäckhed, Hao Ding, Ting Wang, Lora V. Hooper, Gou Young Koh, Andras Nagy, Clay F. Semenkovich et Jeffrey I. Gordon, « The gut microbiota as an environmental factor that regulates fat storage », Procedings of the National Academy of Sciences of the United States of America, vol. 101, p. 15718-15723, 2004. « The microbiota can be viewed as a metabolic « organ » exquisitely tuned to our physiology that performs functions that we have not had to evolve on our own. These functions include the ability to process otherwise indigestible components of our diet, such as plant polysaccharides. »
- Benoît Jaulhac, « Ecosystèmes bactériens. Flore du tube digestif » [PDF], sur lecomprime.com, Laboratoire de Bactériologie, Faculté de Médecine de Strasbourg (version du sur Internet Archive), p. 2.
- (en) Mirjana Rajilić-Stojanović, Willem M. de Vos, « The first 1000 cultured species of the human gastrointestinal microbiota », FEMS Microbiology Reviews, vol. 38, no 5, , p. 996–1047 (DOI 10.1111/1574-6976.12075).
- « Une approche révolutionnaire pour l’étude du microbiote intestinal », communiqué de presse, sur CEA, (consulté le ).
- (en) « Essential Bacillus subtilis genes », sur National Center for Biotechnology Information, (consulté le ).
- Marie-Céline Ray, « Microbiote : près de 2 000 nouvelles espèces de bactéries découvertes », sur Futura, (consulté le ).
- Zhernakova, A. et al. Population-based metagenomics analysis reveals markers for gut microbiome composition and diversity. Science 352, 565–569 (2016)
- (en) M. Arumugam et al. « Enterotypes of the human gut microbiome », Nature, 473, 2011, p. 1–7.
- (en) GD. Wu et al. « Linking Long-Term Dietary Patterns with Gut Microbial Enterotypes », Science, 2011.
- (en) MJ. Claesson et al. « Gut microbiota composition correlates with diet and health in the elderly », Nature, 2012, 1–8. DOI 10.1038/nature11319
- (en) Jeffery IB, Claesson MJ, O’Toole PW. & Shanahan F. « Categorization of the gut microbiota: enterotypes or gradients? », Nature Reviews Microbiology, 10, 2012, 591–592.
- (en) Julien Tap, Franck Lejzerowicz, Aurélie Cotillard et Matthieu Pichaud, « Global branches and local states of the human gut microbiome define associations with environmental and intrinsic factors », Nature Communications, vol. 14, no 1, , p. 3310 (ISSN 2041-1723, PMID 37339957, PMCID PMC10282066, DOI 10.1038/s41467-023-38558-7, lire en ligne, consulté le )
- (en) Ochman H. et al. « Evolutionary Relationships of Wild Hominids Recapitulated by Gut Microbial Communities », PLoS Biology, 8, 2010, e1000546.
- Jean-Philippe Braly, « Sans microbes, pas d'immunité efficace », La Recherche, no 468, , p. 48 (lire en ligne).
- (en) C. De Filippo et al. « Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa », Proceedings of the National Academy of Sciences of the United States of America, 107, 2010, 14691–6.
- (en) Guigoz Y, Doré J, Schiffrin EJ. & Dore J. « The inflammatory status of old age can be nurtured from the intestinal environment », Current opinion in clinical nutrition and metabolic care, 11, 2008, 13–20.
- (en) Yatsunenko T. et al. « Human gut microbiome viewed across age and geography », Nature, 9 mai 2012, 486(7402), p. 222-7. DOI 10.1038/nature11053
- (en) Matthieu Clauss, Philippe Gérard, Alexis Mosca et Marion Leclerc, « Interplay Between Exercise and Gut Microbiome in the Context of Human Health and Performance », Frontières en Nutrition, vol. 8, (DOI 10.3389/fnut.2021.637010)
- (en) Inna Sekirov et al., « Gut Microbiota in Health and Disease », Physiol Rev., vol. 90, no 3, , p. 859-904 (PMID 20664075, DOI 10.1152/physrev.00045.2009, lire en ligne).
- Marc-André Selosse, Jamais seul : Ces microbes qui construisent les plantes, les animaux et les civilisations, Actes Sud, , 368 p. (ISBN 978-2-330-08454-7, lire en ligne), p. 101.
- (en) Gibson GR, Probert HM, Loo JV, Rastall RA. & Roberfroid MB. « Dietary modulation of the human colonic microbiota: updating the concept of prebiotics » Nutr Res Rev. 17, 259–275 (2004).
- (en) Fredrik Bäckhed et al., « The gut microbiota as an environmental factor that regulates fat storage », Proc Natl Acad Sci U S A, vol. 101, no 44, , p. 15718–15723 (PMID 15505215)
- (en) Duncan SH. et al. « Effects of alternative dietary substrates on competition between human colonic bacteria in an anaerobic fermentor system » Applied and environmental microbiology 69, 1136 (2003).
- (en) Duncan SH, Holtrop G, Johnstone AM, Flint HJ. & Lobley GE. « Reduced dietary intake of carbohydrates by obese subjects results in decreased concentrations of butyrate and butyrate-producing bacteria in feces » Applied and Environmental Microbiology 73, 1073–1078 (2007).
- (en) Amandine Everard, Clara Belzer, Lucie Geurts, Janneke P. Ouwerkerk, Céline Druart, Laure B. Bindels, Yves Guiot, Muriel Derrien, Giulio G. Muccioli, Nathalie M. Delzenne, Willem M. de Vos & Patrice D. Cani, « Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity », PNAS, vol. 110, no 22, , p. 9066-9071 (DOI 10.1073/pnas.1219451110).
- (en) Mazmanian SK, Liu CH, Tzianabos AO. & Kasper DL. « An immunomodulatory molecule of symbiotic bacteria directs maturation of the host immune system », Cell, 122, 2005, 107–118.
- (en) Guarner F. « Enteric flora in health and disease », Digestion, 73 Suppl 1, 2006, 5–12.
- « Microbiote intestinal (flore intestinale) · Inserm, La science pour la santé », sur Inserm (consulté le )
- (en) AJ Macpherson et NL Harris, « Interactions between commensal intestinal bacteria and the immune system », Nat Rev Immunol., vol. 4, no 6, , p. 478-85 (PMID 15173836, résumé)
- (en) JL Round et SK Mazmanian, « The gut microbiota shapes intestinal immune responses during health and disease », Nat Rev Immunol., vol. 9, no 5, , p. 313-23 (PMID 19343057, DOI 10.1038/nri2515, résumé)
- (en) N Kamada, SU Seo, GY Chen et G Núñez, « Role of the gut microbiota in immunity and inflammatory disease », Nat Rev Immunol., vol. 13, no 5, , p. 321-35 (PMID 23618829, DOI 10.1038/nri3430, résumé)
- (en) The role of intestinal microbiota and the immune system http://www.europeanreview.org/wp/wp-content/uploads/323-333.pdf
- (en) Vasquez N. et al. « Patchy distribution of mucosal lesions in ileal Crohn’s disease is not linked to differences in the dominant mucosa-associated bacteria: A study using fluorescence in situ hybridization and temporal temperature gradient gel electrophoresis » Inflammatory Bowel Diseases 13, 684–692 (2007).
- (en) Sokol H. et al. « Faecalibacterium prausnitzii is an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients » Proc Natl Acad Sci U S A 105, 16731–16736 (2008).
- (en) Velio Bocci, « The neglected organ: bacterial flora has a crucial immunostimulatory role », Perspect Biol Med., vol. 35, no 2, , p. 251-260.
- Patrice Cani, Nathalie Delzenne, « Microbiote intestinal », in Arnaud Basdevant, Médecine et chirurgie de l'obésité, Lavoisier, 2011, p. 171 [Firmicutes%2FBacteroidetes lire en ligne].
- Backhed, F. et al. The gut microbiota as an environmental factor that regulates fat storage. Proceedings of the National Academy of Sciences of the United States of America 101, 15718 (2004).
- Ley, R. E., Turnbaugh, P. J., Klein, S. & Gordon, J. I. Microbial ecology: human gut microbes associated with obesity. Nature 444, 1022–1023 (2006).
- "Microbiome Species that Keep Mice Lean or Obese Are Balanced by Immune System".
- (en) Emmanuelle Le Chatelier, Trine Nielsen, Junjie Qin et Edi Prifti, « Richness of human gut microbiome correlates with metabolic markers », Nature, vol. 500, no 7464, , p. 541–546 (ISSN 1476-4687, PMID 23985870, DOI 10.1038/nature12506, lire en ligne, consulté le ).
- (en) Aurélie Cotillard, Sean P. Kennedy, Ling Chun Kong et Edi Prifti, « Dietary intervention impact on gut microbial gene richness », Nature, vol. 500, no 7464, , p. 585–588 (ISSN 1476-4687, PMID 23985875, DOI 10.1038/nature12480, lire en ligne, consulté le ).
- (en) Qin J. et al. « A metagenome-wide association study of gut microbiota in type 2 diabetes » Nature 490, 55–60 (2012)
- Kong LC, Tap J et al. Gut microbiota after gastric bypass in human obesity: increased richness and associations of bacterial genera with adipose tissue genes. Am J Clin Nutr. 2013 Jul;98(1):16-24. doi: 10.3945/ajcn.113.058743.
- « Le microbiote intestinal et la digestion des polysaccharides », Medecien et scineces, (lire en ligne)
- (en) Will Takakura et Mark Pimentel, « Small Intestinal Bacterial Overgrowth and Irritable Bowel Syndrome – An Update », Frontiers in Psychiatry, vol. 11, (ISSN 1664-0640, PMID 32754068, PMCID 7366247, DOI 10.3389/fpsyt.2020.00664, lire en ligne, consulté le )
- Julien Tap, Muriel Derrien, Hans Törnblom et Rémi Brazeilles, « Identification of an Intestinal Microbiota Signature Associated With Severity of Irritable Bowel Syndrome », Gastroenterology, vol. 152, no 1, , p. 111–123.e8 (ISSN 0016-5085, DOI 10.1053/j.gastro.2016.09.049, lire en ligne, consulté le )
- Julien Tap, Stine Störsrud, Boris Le Nevé et Aurélie Cotillard, « Diet and gut microbiome interactions of relevance for symptoms in irritable bowel syndrome », Microbiome, vol. 9, no 1, , p. 74 (ISSN 2049-2618, PMID 33771219, PMCID PMC8004395, DOI 10.1186/s40168-021-01018-9, lire en ligne, consulté le )
- Furet, Kong et al. Differential adaptation of human gut microbiota to bariatric surgery-induced weight loss: links with metabolic and low-grade inflammation markers. 2010. Diabetes. https://www.ncbi.nlm.nih.gov/pubmed/20876719
- Kong, Tap et al. Gut microbiota after gastric bypass in human obesity: increased richness and associations of bacterial genera with adipose tissue genes. Am J Clin Nutr. 2013. https://www.ncbi.nlm.nih.gov/pubmed/23719559
- (en) Rochellys Diaz Heijtz et al., « Normal gut microbiota modulates brain development and behavior », Proc. Natl. Acad. Sci. USA, vol. 108, no 7, , p. 3047-3052 (DOI 10.1073/pnas.1010529108)
- Laurence Robel, Bérengère Beauquier-Maccotta, Jean-Louis Bresson et Jacques Schmitz, « Autisme et gluten : mythes et réalités », La psychiatrie de l'enfant, vol. 48, no 2, , p. 580 (ISSN 0079-726X et 2102-5320, DOI 10.3917/psye.482.0577, lire en ligne, consulté le ).
- (en) Rosa Krajmalnik-Brown, J. Gregory Caporaso, Sharon McDonough-Means et Juan Maldonado, « Long-term benefit of Microbiota Transfer Therapy on autism symptoms and gut microbiota », Scientific Reports, vol. 9, no 1, , p. 5821 (ISSN 2045-2322, DOI 10.1038/s41598-019-42183-0, lire en ligne, consulté le ).
- Netgen, « Transplantation fécale : les faits et les espoirs démesurés ? », sur Revue Médicale Suisse (consulté le ).
- (en) Petra Louis, « Does the Human Gut Microbiota Contribute to the Etiology of Autism Spectrum Disorders? », Digestive Diseases and Sciences, vol. 57, no 8, , p. 1987–1989 (ISSN 0163-2116 et 1573-2568, DOI 10.1007/s10620-012-2286-1, lire en ligne, consulté le ).
- (en) Javier R. Caso, Vicent Balanzá-Martínez, Tomás Palomo and Borja García-Bueno, « The Microbiota and Gut-Brain Axis: Contributions to the Immunopathogenesis of Schizophrenia », Current Pharmaceutical Design, vol. 22, no 40, (lire en ligne, consulté le )
- Lyoproform, « Relation microbiote-cerveau : comment les probiotiques régulent notre stress ? », sur LYOPROFORM, (consulté le )
- Heijtz, R. D. et al. Normal gut microbiota modulates brain development and behavior. Proceedings of the National Academy of Sciences of the United States of America 108, 1–6 (2011).
- (en) M. Valles-Colomer et al. (2019) The neuroactive potential of the human gut microbiota in quality of life and depression, Nature Microbiology, 04 février 2019
- Elizabeth Pennisi (2019) Evidence mounts that gut bacteria can influence mood, prevent depression |4 février 2019 | Science / Biologie Santé ; doi: 10.1126 / science.aaw9039
- Gwen Falony et al. (2016) Population-level analysis of gut microbiome variation ; Science 29 Apr 2016: Vol. 352, Issue 6285, p. 560-564 ; DOI: 10.1126/science.aad3503 |résumé
- Leclercq, S., Amadieu, C., Stärkel, P., de Timary, P., & Delzenne, N., « Troubles liés à l’usage d’alcool : et si l’addiction trouvait son origine dans l’intestin », Rev Med Liège, no 74, , p. 281-286 (lire en ligne, consulté le ) :
.« Tous les patients ayant une barrière intestinale altérée présentaient également une dysbiose intestinale caractérisée par des changements microbiens et des modifications de métabolites bactériens. Par exemple, une diminution drastique de la famille des Ruminoccoccaceae, de l’espèce Faecalibacterium prausnitzii, une bactérie connue pour ses propriétés anti-inflammatoires, et des Bifidobactéries jouant un rôle clé dans le renforcement de la fonction barrière de l’intestin, a été observée chez les patients avec haute perméabilité intestinale. […] De manière remarquable, à la fin du sevrage d’alcool, les patients atteints d’une dysbiose intestinale présentaient des scores plus sévères de dépression, d’anxiété et d’envie d’alcool comparés au groupe de patients n’ayant pas d’altérations intestinales »
- (en) Caitlin S. M. Cowan, Alan E. Hoban, Ana Paula Ventura-Silva et Timothy G. Dinan, « Gutsy Moves: The Amygdala as a Critical Node in Microbiota to Brain Signaling », BioEssays, vol. 40, no 1, , p. 1700172 (DOI 10.1002/bies.201700172, lire en ligne, consulté le )
- (en) Katarzyna B. Hooks, Jan Pieter Konsman et Maureen A. O'Malley, « Microbiota-gut-brain research: A critical analysis », Behavioral and Brain Sciences, vol. 42, , e60 (ISSN 0140-525X et 1469-1825, DOI 10.1017/S0140525X18002133, lire en ligne, consulté le )
- (en) Koren, O. et al. Host remodeling of the gut microbiome and metabolic changes during pregnancy. Cell 150, 470–80 (2012).
- (en) Dethlefsen, L., Huse, S., Sogin, M. L. & Relman, D. A. The pervasive effects of an antibiotic on the human gut microbiota, as revealed by deep 16S rRNA sequencing. PLoS Biology 6, e280 (2008).
- (en) Health and Nutritional Properties of Probiotics in Food including Powder Milk with Live Lactic Acid Bacteria http://www.who.int/foodsafety/publications/fs_management/en/probiotics.pdf
- (en) Bakken JS, Borody T, Brandt LJ, Brill JV, Surawicz C et al. Fecal Microbiota Transplantation Workgroup, « Treating Clostridium difficile infection with fecal microbiota transplantation », Clin Gastroenterol Hepatol, vol. 9, no 12, , p. 1044-9. (PMID 21871249, PMCID PMC3223289, DOI 10.1016/j.cgh.2011.08.014, lire en ligne [html], consulté le )
- (en) Lawrence J Brandt, « Fecal transplantation for the treatment of Clostridium difficile infection », Gastroenterol Hepatol (N Y), vol. 8, no 3, , p. 191-4. (PMID 22675283, PMCID PMC3365524, lire en ligne [html], consulté le )
- (en) Forster, S. C. et al. (2019) A human gut bacterial genome and culture collection for precise and efficient metagenomic analysis. Nat. Biotechnol. 37, 186–192.
- (en) Browne, H. P. et al. (2016) Culturing of ‘unculturable’ human microbiota reveals novel taxa and extensive sporulation. Nature 533, 543–546)
- (en) Lagier, J.-C. et al. (2016) Culture of previously uncultured members of the human gut microbiota by culturomics. Nat. Microbiol. 1, 16203.
- (en) Human Microbiome Project Consortium (2012). Structure, function and diversity of the healthy human microbiome. Nature 486, 207–214.
- (en) Duvallet, C., Gibbons, S. M., Gurry, T., Irizarry, R. A. & Alm, E. J. (2017) Meta-analysis of gut microbiome studies identifies disease-specific and shared responses. Nat. Commun. 8, 1784 .
- (en) Quince, C., Walker, A. W., Simpson, J. T., Loman, N. J. & Segata, N (2017) Shotgun metagenomics, from sampling to analysis. Nat. Biotechnol. 35, 833–844.
- (en) Nelson K.E et al. (2010) A catalog of reference genomes from the human microbiome. Science 328, 994–999.
- (en) Alexandre Almeida, Alex L. Mitchell, Miguel Boland, Samuel C. Forster, Gregory B. Gloor, Aleksandra Tarkowska, Trevor D. Lawley & Robert D. Finn (2019), A new genomic blueprint of the human gut microbiota ; Springer Nature
- (en) Thomas-White, K. et al. (2018) Culturing of female bladder bacteria reveals an interconnected urogenital microbiota. Nat. Commun. 9, 1557.
- (en) Sjogren, K. et al. The gut microbiota regulates bone mass in mice. J. Bone Miner. Res. 27, 1357–1367 (2012)
- Bäckhed, F. et al. The gut microbiota as an environmental factor that regulates fat storage. Proc. Natl Acad. Sci. USA 101, 15718–15723 (2004).
- (en) Reinhardt, C. et al. Tissue factor and PAR1 promote microbiota-induced intestinal vascular remodelling. Nature 483, 627–631 (2012).
- (en) Stappenbeck, T. S., Hooper, L. V. & Gordon, J. I. Developmental regulation of intestinal angiogenesis by indigenous microbes via Paneth cells. Proc. Natl Acad. Sci. USA 99, 15451–15455 (2002).
- (en) Gaboriau-Routhiau, V. et al. The key role of segmented filamentous bacteria in the coordinated maturation of gut helper T cell responses. Immunity 31, 677–689 (2009)
- (en) Erik Larsson, Valentina Tremaroli, Ying Shiuan Lee et Omry Koren, « Analysis of gut microbial regulation of host gene expression along the length of the gut and regulation of gut microbial ecology through MyD88 », Gut, vol. 61, no 8, , p. 1124–1131 (ISSN 1468-3288, PMID 22115825, PMCID PMC3388726, DOI 10.1136/gutjnl-2011-301104, lire en ligne, consulté le ).
- « Ces microbes qui nous gouvernent », Le Monde (consulté le ).
- MetaHIT seventh framework programme
- (en) Junjie Qin1 et al., « A human gut microbial gene catalog established by metagenomic sequencing », Nature, no 464, , p. 59-65.
- (en) Manimozhiyan Arumugam et al., « Enterotypes of the human gut microbiome », Nature, (DOI 10.1038/nature09944).
- Dr Adrian Schulte, Une bonne digestion, c'est la solution, Presses du Châtelet, , p. 71.
- (en) Valentina Tremaroli et Fredrik Bäckhed « Functional interactions between the gut microbiota and host metabolism », Nature, vol. 489, p. 242-249, 2012.
- (en) Zain Kassam, Christine H Lee, Yuhong Yuan et Richard H Hunt, « Fecal Microbiota Transplantation for Clostridium difficile Infection: Systematic Review and Meta-Analysis », The American Journal of Gastroenterology, vol. 108, , p. 500–508 (DOI 10.1038/ajg.2013.59, lire en ligne)
- "Comprendre sa flore intestinale pour vivre en bonne santé"
- En quoi l'Équilibre de notre flore intestinale influe sur notre santé, p. 6/10 [PDF]
- (en) The Role of the Gut Microbiota in Energy Metabolism and Metabolic Syndrom [PDF]
- Drouault-Holowacz S, Bieuvelet S, Burckel A, Cazaubiel M, Dray X, Marteau P. « Étude randomisée en double insu contre placebo sur l’efficacité d’un mélange probiotique chez 100 patients présentant des troubles fonctionnels intestinaux (A double blind randomized controlled trial of a probiotic combination in 100 patients with irritable bowel syndrome) » Gastroenterol Clin Biol. 2008;32(2):147-52. DOI 10.1016/j.gcb.2007.06.001
- T. Piche « Anomalie pariétale et de la flore au cours du syndrome de l'intestin irritable (Alterations of intestinal epithelial barrier and flora in the irritable bowel syndrome) » Gastroenterol Clin Biol. 2009;33 Suppl 1:S40-7. DOI 10.1016/S0399-8320(09)71524-6 lire notamment en p. 6 du [PDF]
- (en) Allen SJ, Martinez EG, Gregorio GV, Dans LF. « Probiotics for treating acute infectious diarrhoea » Cochrane Database of Systematic Reviews 2010, Issue 11. Art. No CD003048. DOI 10.1002/14651858.CD003048.pub3
- (en) Bernaola Aponte G, Bada Mancilla CA, Carreazo Pariasca NY, Rojas Galarza RA. « Probiotics for treating persistent diarrhoea in children » Cochrane Database of Systematic Reviews 2010, Issue 11. Art. No CD007401. DOI 10.1002/14651858.CD007401.pub2
- Probiotiques et maladies inflammatoires cryptogénétiques de l’intestin
- Thèse 2010, p. 136-150
- Probiotics: future directions
- (en) MD Levitt et al. « Stability of human methanogenic flora over 35 years and a review of insights obtained from breath methane measurements » Clin Gastroenterol Hepatol. 2006;4(2):123-9.
- (en) AC Soares et al. « Breath methane associated with slow colonic transit time in children with chronic constipation » J Clin Gastroenterol. 2005;39(6):512-5.
- "Bacteria identified which protects intestinal tumours from immune cells"
- "Inserm, cibler le microbiote intestinal pour lutter contre le concert du colon"
- « Avancée sur le cancer colorectal » (communiqué de presse), Hôpitaux Universitaires Henri Mondor, 2 décembre 2014.
- (en) "The Gut Microbiota, Tumorigenesis, and Liver Diseases:2) Tumerogenesis"
- "Stomach bug alters tumor suppressor"
- « Le microbiote en cause dans des AVC », sur Le Monde, (consulté le ).
- "Nature 2019:Demystifying the manipulation of host immunity, metabolism, and extraintestinal tumors by the gut microbiome"
- Vayu Maini Rekdal et al. (2019) « Discovery and inhibition of an interspecies gut bacterial pathway for Levodopa metabolism », Science, 14 juin 2019, vol. 364, n° 6445, eaau6323 ; DOI: 10.1126/science.aau6323.
Voir aussi
modifierBibliographie
modifier- (en) Craig L. Maynard, Charles O. Elson, Robin D. Hatton et Casey T. Weaver, « Reciprocal interactions of the intestinal microbiota and immune system », Nature, vol. 489, p. 231-241, 2012.
- (en) Valentina Tremaroli et Fredrik Bäckhed, « Functional interactions between the gut microbiota and host metabolism », Nature, vol. 489, p. 242-249, 2012.
- Patrice Debré, L'Homme microbiotique, Paris, Éditions Odile Jacob, , 288 p. (ISBN 978-2-7381-3337-3, lire en ligne)
- Giulia Enders, Le Charme discret de l'intestin. Tout sur un organe mal-aimé, Éditions Actes Sud, , 288 p. (lire en ligne)
- Raphaël Kellman, Quand l'intestin s'en mêle, Larousse, , 288 p. (lire en ligne)
- Joël Doré, Karine Clément, Stanislav Ehrlich et Hervé Blottière, « Microbiote intestinal : les bienfaits de la diversité », Pour la Science, no 469, , p. 54-59.
- Jérôme MANETTA, Micronutrition et nutrithérapie de l'intestin : l’extraordinaire révolution scientifique et médicale du microbiote, Montpellier, Sparte éditions, , 309 p. (ISBN 978-2-9549976-2-9)
Articles connexes
modifierLiens externes
modifier
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :