Cyclooxygénase
Une cyclooxygénase (COX), ou prostaglandine-endoperoxyde synthase (PTGS), est une oxydoréductase qui catalyse la réaction :
| Prostaglandine-endoperoxyde synthase 1 | ||
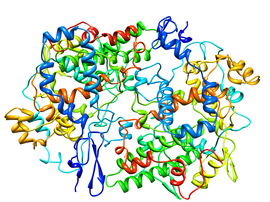 Structure cristallisée d'une COX-1 de mouton complexée avec le flurbiprofène (PDB 1CQE[1]) | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | PTGS1 | |
| N° EC | 1.14.99.1 | |
| Homo sapiens | ||
| Locus | 9q33.2 | |
| Masse moléculaire | 68 686 Da[2] | |
| Nombre de résidus | 599 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Prostaglandine-endoperoxyde synthase 2 | ||
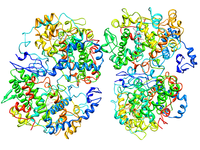 Structure d'une cyclooxygénase 2 de souris complexée avec un inhibiteur sélectif (PDB 6COX[3]) | ||
| Caractéristiques générales | ||
| Symbole | PTGS2 | |
| N° EC | 1.14.99.1 | |
| Homo sapiens | ||
| Locus | 1q31.1 | |
| Masse moléculaire | 68 996 Da[2] | |
| Nombre de résidus | 604 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
- arachidonate + AH2 + 2 O2 prostaglandine H2 + A + H2O.
Ces enzymes permettent la formation des prostanoïdes (prostaglandines, prostacyclines et thromboxanes) à partir de l'acide arachidonique[4]. Son action est inhibée par les anti-inflammatoires non stéroïdiens (AINS) comme l'aspirine.
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Historique
modifierLa cyclooxygénase a été isolée en 1976[5].
Physiologie
modifierCOX fait partie d'un complexe d'enzymes qui convertit l'acide arachidonique en prostaglandine H2 (PGH2), le précurseur de tous les prostanoïdes. Le complexe consiste en une isoenzyme COX et une peroxydase. On connaît trois cyclooxygénases : la COX-1, la COX-2 et la COX-3.
Pharmacologie
modifierLes COX-1 font partie d'une famille d'enzymes constitutives de l'organisme, qui se trouvent dans une immense majorité des cellules, et impliquées dans de nombreux mécanismes. Leur activité est indirectement liée à la production des thromboxanes.
Les COX-2 font partie d'une famille d'enzymes inductives par de multiples facteurs pro-inflammatoires (cytokines, interférons…)[6].
L'activité enzymatique de type COX-2 est exprimée dans les cellules endothéliales vasculaires, rénales et même au niveau du système nerveux central. On constate qu'elles contribuent au bon fonctionnement de l'organisme si elles sont bien régulées. Elles sont en majorité responsables de l'activité inflammatoire, par une surexpression des COX-2.
AINS classiques
modifierAspirine, ibuprofène, nifluril. Ils ne sont pas spécifiques et exercent des effets anti-COX1 et anti-COX2 (néanmoins, l'aspirine à faible dose a essentiellement un effet anti-COX1). L'inhibition de la COX2 permet la diminution de l'expression des médiateurs de l'inflammation, néanmoins, l'effet associé anti-COX1 est responsable de nombreux effets secondaires, notamment :
- Plaquettaire : la diminution de thromboxane-A2 plaquettaire, produite par la COX1 augmente le temps de saignement par diminution de l'effet pro-thrombotique ; ce phénomène peut néanmoins être l'effet recherché ;
- Digestif : le risque d'ulcères gastroduodénaux est nettement majoré ;
- Allergique : l'inhibition de la cyclooxygénase favorise la voie de la lipoxygénase, responsable de la production de leucotriènes, en cause dans le phénomène d'allergie ;
- Rénaux : l'inhibition de la COX1 peut provoquer hypertension artérielle et rétention hydro-sodée jusqu'à l'insuffisance rénale aiguë, par la diminution des prostaglandines ayant un rôle dans les fonctions rénales.
Nouveaux AINS
modifierIls tendent à être spécifiques de la COX-2, et n'agissent que sur l'excès de médiateur inflammatoire. Il existe cependant des effets secondaires, notamment au niveau de l'endothélium, qui produit la prostacycline (prostaglandine I2) par l'intermédiaire de la COX-2, cette PGI2 a des effets anti-agrégeant, et sa diminution lié à l'anti-COX2 a donc des effets pro-thrombotique.
Notes et références
modifier- (en) Daniel Picot, Patrick J. Loll et R. Michael Garavito, « The X-ray crystal structure of the membrane protein prostaglandin H2 synthase-1 », Nature, vol. 367, no 6460, , p. 243-249 (PMID 8121489, DOI 10.1038/367243a0, lire en ligne)
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) Ravi G. Kurumbail, Anna M. Stevens, James K. Gierse, Joseph J. McDonald, Roderick A. Stegeman, Jina Y. Pak, Daniel Gildehaus, Julie M. iyashiro, Thomas D. Penning, Karen Seibert, Peter C. Isakson et William C. Stallings, « Structural basis for selective inhibition of cyclooxygenase-2 by anti-inflammatory agents », Nature, vol. 384, no 6610, , p. 644-648 (PMID 8967954, DOI 10.1038/384644a0, Bibcode 1996Natur.384..644K, lire en ligne)
- « Molecular Mechanisms of Drug Actions: From Receptors to Effectors - Pediatric Critical Care (Fourth Edition) - Chapter 117 », sur www.sciencedirect.com (consulté le ) : « Arachidonic acid is a component of membrane phospholipids released either in a one-step process, after phospholipase A2 (PLA2) action, or a two-step process, after phospholipase C and DAG lipase actions. Arachidonic acid is then metabolized by cyclooxygenase (COX) and 5-lipoxygenase, resulting in the synthesis of prostaglandins and leukotrienes, respectively. These intracellular messengers play an important role in the regulation of signal transduction implicated in pain and inflammatory responses. »
- Hemler M, Lands WE, Smith WL, Purification of the cyclooxygenase that forms prostaglandins: demonstration of two forms of iron in the holoenzyme, J Biol Chem, 1976;251:5575–5579
- Nabil Foudi, Liliane Louedec, Thierry Cachina et Charles Brink, « Selective cyclooxygenase-2 inhibition directly increases human vascular reactivity to norepinephrine during acute inflammation », Cardiovascular Research, vol. 81, no 2, , p. 269–277 (ISSN 1755-3245, PMID 18952694, DOI 10.1093/cvr/cvn287, lire en ligne, consulté le )
Articles connexes
modifier
