Vitamine B12
La vitamine B12, également appelée cobalamine, est une vitamine hydrosoluble essentielle au fonctionnement normal du cerveau (elle participe à la synthèse des neurotransmetteurs), du système nerveux (elle est indispensable au maintien de l'intégrité du système nerveux et tout particulièrement de la gaine de myéline qui protège les nerfs et optimise leur fonctionnement) et à la formation du sang. C'est l'une des huit vitamines B. Elle est normalement impliquée comme cofacteur dans le métabolisme de chacune des cellules du corps humain, plus particulièrement dans la synthèse de l'ADN et sa régulation ainsi que dans la synthèse des acides gras et dans la production d'énergie.
| Vitamine B12 | ||
| ||
 | ||
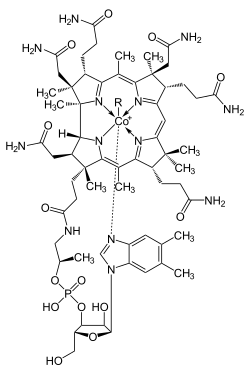
| R = –5'-désoxyadénosyl, –CH3, –OH ou –CN. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | α-(5,6-diméthylbenzimidazolyl)cobamidcyanure | |
| Synonymes |
cobalamine |
|
| No CAS | (Cyanocobalamine) (Hydroxocobalamine) |
|
| No CE | 237-627-6 200-680-0 (Cyanocobalamine) |
|
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C72H100CoN18O17P [Isomères] |
|
| Masse molaire[1] | 1 579,581 8 ± 0,073 3 g/mol C 54,75 %, H 6,38 %, Co 3,73 %, N 15,96 %, O 17,22 %, P 1,96 %, |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Elle existe sous plusieurs formes appartenant à la famille des cobalamines : cyanocobalamine, hydroxocobalamine, méthylcobalamine et adénosylcobalamine, les deux premières étant ses formes stables. Les cobalamines ont une structure chimique proche de l’hème mais l’atome central de fer y est remplacé par un atome de cobalt, d’où leur nom.
Un déficit en vitamine B12 entraîne une forme d'anémie dont l'une des caractéristiques est la présence de globules rouges fortement augmentés en taille (macrocytose). Relativement rare, cette carence peut notamment résulter d'apports insuffisants chez des personnes suivant un régime végétalien non complémenté, ou ayant des problèmes d'absorption. La complémentation est également recommandée par le Ministère de la Santé (France)[2] aux personnes suivant un régime végétarien ou flexitarien, ainsi qu'aux personnes à partir de 50 ans[3].
La synthèse totale de cette biomolécule complexe, réalisée en 1972 par Robert Burns Woodward, Albert Eschenmoser et leur équipe, demanda plusieurs années.
Histoire
modifierLes recherches sur cette vitamine sont issues de la description au début du XIXe siècle d'une anémie mortelle, l'anémie pernicieuse, par différents auteurs dont Thomas Addison ou Anton Biermer[4],[5],[6].
Vers 1920, Frieda Robscheit Robbins, George Whipple, George Minot et William Murphy (prix Nobel de médecine en 1934) démontrent que des extraits de foie sous forme de compléments alimentaires peuvent corriger certaines anémies[7]. William Castle montre qu'il existe un facteur intrinsèque indispensable et inexistant chez les malades souffrant d'anémie pernicieuse, et un facteur extrinsèque venant de l'alimentation (foie, viandes).
Grâce aux travaux de Mary Shorb (en), ce facteur extrinsèque (la vitamine B12) est isolé sous une forme cristalline[8] en 1948 par l'équipe de Karl Folkers du laboratoire Merck à partir de la bactérie Streptomyces griseus[9], puis par Lester Smith du laboratoire Glaxo la même année. Sa configuration tridimensionnelle fut identifiée par Dorothy Hodgkin (prix Nobel de chimie en 1964).
Cette vitamine B12 reste néanmoins mal comprise ; il faut attendre 2007 pour que des chercheurs du MIT et de la Harvard Medical School en expliquent le processus complet de synthèse par des micro-organismes[10].
Physiologie
modifierBiosynthèse
modifierNi les plantes ni les animaux, et plus généralement aucun eucaryote, ne peuvent produire de vitamine B12[11]. Seules quelques bactéries et archées ont les enzymes nécessaires à sa biosynthèse. Chez des eucaryotes du phytoplancton, quelques gènes intervenant dans cette biosynthèse ont été détectés, mais cela ne suffit pas pour prouver qu'ils la synthétisent[12].
Les espèces des genres suivants sont connues pour synthétiser de la vitamine B12 : Acetobacterium, Aerobacter, Agrobacterium, Alcaligenes, Azotobacter, Bacillus, Clostridium, Corynebacterium, Flavobacterium, Halomonas[13], lactobacilles, Micromonospora, Mycobacterium, Nocardia, Propionibacterium, Protaminobacter, Proteus, Pseudomonas, Rhizobium, Salmonella, Serratia, Streptomyces, streptocoques et Xanthomonas.
L'ensemble des animaux dépend donc d'autres organismes, tels que les bactéries. La chaîne alimentaire transmet ce nutriment des herbivores aux carnivores de sorte que l'ensemble des produits d'origine animale en contient, mais pas les végétaux[14]. L'absorption intestinale de la vitamine B12 a lieu uniquement au niveau de la portion terminale de l'iléon[15].
Obtention
modifierFermentation pré-gastrique
modifierChez les ruminants, tels que la vache, la lenteur de la digestion des fibres permet à des populations bactériennes de se développer pendant plusieurs heures, grâce à une fermentation prégastrique. La rumination consiste à faire remonter le contenu de la première poche (rumen) puis à l'ingérer de nouveau. Les aliments remontent et passent donc de poche en poche avant d'atteindre le troisième feuillet (processus pouvant durer de 20 à 48 heures).
Au cours de ce processus, la vitamine B12 est produite par les micro-organismes (bactéries, archées) qui se multiplient dans le rumen. Cette synthèse nécessite la présence d'une quantité suffisante de cobalt[16]. Lorsque les aliments atteignent la partie terminale du grêle, la vitamine B12 d'origine bactérienne peut enfin être absorbée.
Dans le cadre de l'agriculture intensive, les vaches laitières ont un risque de carence en vitamines B, dont la vitamine B12[17].
Coprophagie
modifierChez d'autres herbivores, comme le lapin, le lièvre et le chinchilla, ou encore le castor, la multiplication bactérienne a surtout lieu vers la fin des intestins, ce qui ne permet pas à ces animaux d'avoir le temps d'absorber assez de vitamine B12. Pour obtenir leur vitamine B12, ces mammifères consomment leurs cæcotrophes ou crottes molles, imprégnées de mucus et riches en bactéries, évacuées la nuit, pour être ré-ingérées[18] ; ils sont dits cæcotrophes.
Beaucoup d'herbivores sont coprophages quand ils sont très jeunes, tels les poulains, les jeunes éléphants, pandas, koalas, hippopotames... puis abandonnent la coprophagie à l'âge adulte, une fois leur microbiote intestinal établi[18].
Carnivores et primates non humains
modifierLes carnivores, eux, obtiennent leur B12 à partir de la chair des herbivores.
En dépit d'un régime frugivore ou végétal prédominant, les primates consomment naturellement des insectes et leurs larves[19]. Le ouistiti et le saïmiri sont particulièrement friands d'insectes. La valeur nutritionnelle des insectes ne diffère guère des autres sources de viande[20]. La vitamine B12 est bien représentée par exemple chez le grillon domestique Acheta domesticus (5,4 μg par 100 g forme adulte et 8,7 μg pour 100 g nymphes). Toutefois, de nombreuses espèces d'insectes ont aussi de très faibles taux de B12, et d'autres travaux sont nécessaires pour identifier les insectes comestibles riches en vitamines B[21].
Le babouin, le gibbon chassent et mangent de petits animaux. L'alimentation des chimpanzés est constituée d'une petite portion de produits d'origine animale (insectes, œufs d'oiseaux, miel, et à l'occasion des petits mammifères)[19].
Une minorité de primates, comme les colobes (singe foliophage, mangeur de feuilles) ont un estomac à plusieurs poches. Ce système proche de celui des ruminants leur permet de digérer la cellulose et de profiter de la production bactérienne de vitamine B12, mais les humains ne le possèdent pas[22],[23].
Chez les humains
modifierChez les humains, la vitamine B12 provient presque exclusivement des aliments d'origine animale[24],[14], de compléments alimentaires ou d'aliments enrichis en vitamine B12. Ces compléments et aliments enrichis sont la seule source significative de vitamine B12 pour les végétaliens[25] et les végétariens[26]. Il existe de petites quantités de vitamine B12 dans certaines algues, mais leur contribution à l'apport alimentaire de cette vitamine est considérée insuffisante par le corps médical (voir la sous-section Teneurs alimentaires en B12).
Il n'a jamais été démontré que la flore intestinale humaine produisait de la vitamine B12 absorbable par l’appareil digestif, même en pratiquant une alimentation crue et strictement végétale[27],[28],[29]. Au contraire, le système digestif a plutôt tendance à dégrader la vitamine B12 ingérée[30]. Une carence peut donc survenir à la suite d'une alimentation végétale non complémentée, ainsi que de certaines pathologies réduisant la capacité d'absorption telles que des maladies de l'estomac, du pancréas, des intestins, du foie ou autres[31].
Métabolisme
modifierAbsorption digestive
modifierLa vitamine B12 alimentaire est absorbée par un processus en plusieurs étapes. Dans le milieu acide de l'estomac, elle est séparée du substrat alimentaire d'origine animale par les pepsines gastriques. Elle se lie alors à des protéines R salivaires dont elle se libère dans le duodénum sous l'effet des protéases pancréatiques. Elle peut alors s'associer au facteur intrinsèque, une glycoprotéine de liaison sécrétée par les cellules pariétales de l'estomac. Le complexe de vitamine B12 et de facteur intrinsèque parcourt tout l'intestin grêle avant d'être absorbé sous cette forme dans l'iléon grâce au récepteur cubam. L'assimilation de la vitamine B12 est compromise lorsque l'un des mécanismes ci-dessus fait défaut, par exemple lorsque l'estomac n'est plus assez acide (une partie de la population à partir de 50 ans), ou qu'il ne produit pas de facteur intrinsèque (anémie pernicieuse), et probablement pour certaines personnes traitées par IPP (inhibiteur de la pompe à protons).
Absorbée sous forme de cobalamine, la B12 passe dans la circulation sanguine. Environ 20 % (de 5 à 25 %) de la forme circulante est fixée à une protéine, la transcobalamine II ou holotranscobalamine (TC-II ou holo-TC-II) ; c'est la forme biodisponible rapidement utilisable[14],[32]. Le reste est lié à l'haptocorrine (transcobalamine I) dont le rôle serait inconnu[33] ou une forme de stockage[34].
Réserves
modifierL'organisme humain stocke cette vitamine dans le foie, le pancréas, le cœur et le cerveau. Une partie de la vitamine B12 des réserves est plus ou moins bien recyclée selon la capacité de ré-absorption des individus[35].
Les réserves totales de vitamine B12 des adultes ont été estimées de 2 à 3 mg, par analyses microbiologiques de tissus humains post-mortem[36]. La durée théorique de ces réserves a été calculée sur la moyenne des pertes quotidiennes par excrétion biliaire, elles-mêmes estimées entre 0,1 et 0,2 % des réserves totales (en tenant compte d'une réabsorption entéro-hépatique elle-même estimée à 50 %), à partir de très rares données obtenues par expériences après cholécystectomie[37].
Les besoins en vitamine B12 étant modestes (de 0,1 à 1 μg/j), une vraie carence n'apparait qu'après plusieurs années de déficit (5 à 6 ans par exemple) chez les personnes ayant suivi précédemment un régime alimentaire occidental standard[38].
Fonctions biochimiques
modifierLa fraction biodisponible (transcobalamine II ou holo-TC-II) est transformée dans les cellules des tissus périphériques en deux formes coenzymatiques actives : la méthylcobalamine et l'adénosylcobalamine (synonyme de cobamamide), d'où l'existence de plusieurs rôles métaboliques majeurs[34].
Méthylcobalamine
modifierLa méthylcobalamine est le coenzyme de la méthionine synthase pour la méthylation de l'homocystéine en méthionine. Le groupement méthyl est apporté par le 5-méthyl-tétrahydrofolate (5-CH3-THF) ce qui permet la régénération du tétrahydrofolate (THF), indispensable à la synthèse du thymidilate[14]. Donc, de façon indirecte, la méthylcobalamine joue aussi un rôle dans la synthèse de la thymidine (substance importante pour le métabolisme des nucléotides).
Une carence en méthylcobalamine a pour conséquences une accumulation de l'homocystéine, et un piégeage du 5-CH3-THF devenu indisponible pour se régénérer en THF. Il se forme ainsi une « trappe métabolique » qui se manifeste par un blocage des mitoses cellulaires des lignées à renouvellement rapide (cellules sanguines et des muqueuses digestives)[14].
Il existe donc une interaction métabolique essentielle entre le métabolisme des cobalamines et celui des folates[14].
Adénosylcobalamine
modifierL'adénosylcobalamine est le coenzyme de la méthylmalonyl-CoA mutase[33] qui catalyse la conversion de la méthylmalonyl-CoA en succinyl-CoA[39]. Il s'agit d'une des réactions permettant la dégradation de la propionyl-CoA (non métabolisée dans le corps humain), qui provient directement de l'hélice de Lynen lors de la bêta-oxydation des acides gras à nombre impair de carbones.
Un déficit en adénosylcobalamine induit de ce fait une accumulation d'acide méthylmalonique (précurseur du méthymalonyl-CoA)[14],[33].
Fonctions physiologiques
modifierAu total, la vitamine B12 facilite la synthèse de l'ADN et l'hématopoïèse. Elle maintient l'intégrité des épithéliums digestifs ; elle est nécessaire au développement et à la myélinisation du système nerveux central ainsi que de sa maintenance fonctionnelle[33],[40].
Elle a une nette action sur la croissance. Cette action doit être rapprochée de l'activité de la vitamine vis-à-vis des acides aminés dont le taux sanguin chute après administration de la vitamine.
Besoins et sources alimentaires
modifierApports quotidiens et recommandés
modifierL'apport journalier recommandé par l'Union européenne pour un adulte est de 2,5 µg (règlement 1169/2011[41]), tandis que les recommandations américaines de la FDA sont de 2,4 μg (Daily Value)[42]. Le taux d'absorption est d'environ 50% pour des doses inférieures à 2 μg, et diminue significativement pour des doses largement plus importante : par exemple, le taux d'absorption pour une dose de 500 μg est d'environ 2%[43].
Les méthodes qui permettent de déterminer ces apports quotidiens recommandés tiennent donc compte des phénomènes de limitation de l'absorption, et formulent des règlements qui permettent de sécuriser 97 % des populations[44]. À moins de disposer de produits suffisamment enrichis en vitamine B12, et de les consommer régulièrement tout au long de la journée, comme le font les consommateurs de produits d'origine animale, les personnes qui font le choix d'une alimentation végétale sortent de cette catégorie de recommandations. Le fait de reposer sur un complément hebdomadaire oblige à tenir compte de l'absorption d'autant plus limitée que le dosage est élevé : on peut passer de 50 % à 0,5 % de B12 absorbée[45]. Rappelons l'innocuité internationalement reconnue de la vitamine B12, pour laquelle il n'existe pas de dose toxique[46]. De plus, la vitamine est hydrosoluble (élimination avec les urines).
L'apport quotidien d'un régime de type européen est de l'ordre de 5 à 30 µg, soit nettement plus que les besoins quotidiens. Seule une fraction de la vitamine ingérée est absorbée (de l'ordre de 1 à 5 µg)[47].
Dans le cas d'un régime occidental typique, les produits laitiers constituent généralement la principale source végétarienne de vitamine B12, compléments et produits enrichis mis à part[48].
- viande :
- animaux marins :
- produits laitiers
- fromage frais : 1,28
- œufs : 1,3 (seulement bio-disponible à moins de 10 %)[51]
- les aliments enrichis en vitamine B12 ne sont pas disponibles dans tous les pays. Il existe :
- des boissons ou laits végétaux enrichis,
- divers types de céréales de petit déjeuner,
- des jus multi-vitaminés, cocktails de jus de fruits, jus de fruits,
- des simili-carnés,
- des substituts d'œufs,
- des compléments alimentaires,
- micro-algues : malgré une certaine richesse en vitamine B12 par certaines variétés d'algues, de nombreux facteurs peuvent influer sur leur teneur réelle en vitamine B12. Leur utilisation comme source fiable de vitamine B12 chez les humains n'est pas validée. Il est généralement admis par le corps médical qu'il n'existe aucun aliment végétal non enrichi, algues comprises, qui puisse assurer en pratique un apport suffisant en vitamine B12 à l'organisme humain[52].
- La Chlorella vulgaris contiendrait parfois de la vitamine B12, parfois aucune[53][source secondaire nécessaire].
- Selon une étude de Dagnelie (1991), le nori n'est pas une source fiable de vitamine B12 biodisponible[54][source secondaire nécessaire]. Selon une étude de Rauma, Törrönen, Hänninen et Mykkänen (1995), sa consommation fait certes augmenter le taux mesuré de vitamine B12 dans le sang, mais son taux reste inférieur à celui du groupe témoin ; les auteurs de l'étude concluent que la consommation habituelle de nori par les adeptes de l'« alimentation vivante » ne suffit pas à maintenir un niveau suffisant de vitamine B12 dans l'organisme[55][source secondaire nécessaire]. Selon une étude de Watanabe et al. (2014), l'algue nori séchée est la meilleure source disponible en vitamine B12[56][source secondaire nécessaire]. Selon une autre étude, lorsque du nori séché est ingéré, le taux d'acide méthylmalonique augmente, indiquant une carence en vitamine B12 ; en revanche, ce problème n'a pas été observé par les auteurs Yamada et al. (2018), avec le nori non séché, qui semble contenir une quantité significative de vitamine B12 biodisponible[57][source secondaire nécessaire].
- La spiruline n'est pas non plus considérée comme une bonne source de vitamine B12 pour les humains[54],[58],[51], malgré une teneur en méthylcobalamine de 38,5 µg pour 100 g de biomasse sèche[59], indiquant un problème de biodisponibilité chez l'espèce humaine.
Synthèse chimique
modifierSynthèse totale
modifierLa synthèse chimique de la vitamine B12 (en) a été réussie par Robert Burns Woodward[60] et Albert Eschenmoser en 1972[61],[62], et reste une réussite majeure de la synthèse organique totale.
Différentes formes
modifierIl existe neuf formes de cobalamine[63],[64] :
- la cyanocobalamine ;
- l'hydroxocobalamine (également appelée hydroxycobalamine) ;
- la méthylcobalamine ;
- l'adénosylcobalamine (ou cobamamide) ;
- l'aquocobalamine ;
- la nitritocobalamine ;
- la nitrosocobalamine ;
- la sulfitocobalamine ;
- la glutathionylcobalamine.
Production industrielle
modifierLa synthèse totale de la vitamine B12 est d'une telle complexité (100 étapes), que la B12 des compléments alimentaires et des produits enrichis provient toujours de cultures bactériennes.
La production industrielle de vitamine B12 se fait par la fermentation de microorganismes qui la produisent[65] parfois à l'aide d'organismes génétiquement modifiés[66].
Streptomyces griseus, une bactérie qu'on a longtemps prise pour une levure, a été pendant longtemps la source de vitamine B12 destinée à un usage commercial[67],[68]. Les espèces Pseudomonas denitrificans (en) et Propionibacterium freudenreichii subsp. shermanii sont plus couramment utilisées aujourd'hui[69].
La production mondiale de vitamine B12 est estimée en 2020 à 80 tonnes[70]. Bien que deux tonnes pourraient suffire pour couvrir les besoins annuels en matière de supplémentation humaine, la vente à destination des secteurs alimentaire et pharmaceutique représente 70 % du chiffre d'affaires, contre 30 % pour le secteur de l'élevage[70]. Selon d'autres sources plus anciennes (2010 et 2013), 90 % de la production était destinée à l'élevage, le reste servant à l'alimentation humaine et aux soins[71],[72].
Délivrance médicale (médicament)
modifierL'administration parentérale a été étudiée en 1968[73] pour évaluer et comparer, dans le corps entier, la durée de la rétention de la cyanocobalamine, de l'hydroxocobalamine et du coenzyme B12 (3 et 28 jours après l'administration). Les auteurs en ont conclu qu'un traitement d'entretien adéquat des états de carence en vitamine B12 non compliquée peut être obtenu par administration parentérale de 1 000 μg d'hydroxocobalamine tous les 4 mois ou de la même dose de cyanocobalamine tous les 2 mois. En présence d'une maladie rénale ou hépatique, la même dose de cyanocobalamine doit être administrée tous les 11/2[Quoi ?] mois et d'hydroxocobalamine tous les 2 mois[réf. souhaitée].
Un débat a concerné la meilleure voie d'administration (orale,- ou sous-cutanée ?)[74] ou intramusculaire[75],[76],[77],[78]. Selon une analyse des données disponibles autour de 2015 dans la base de données Cochrane Database of Systematic Reviews, en cas de carence, la vitamine B12 peut être délivrée par voie orale (elle est alors absorbée dans la partie terminale de l'iléon) ou par injection intramusculaire[78],[79]. Les effets semblent dans les deux cas similaires en termes de normalisation des taux sériques, mais avec un moindre coût pour la prise orale[78]. Une supplémentation régulière est recommandée aux végétariens[80],[81].
Carences et déficiences
modifierLa carence nutritionnelle pure (avitaminose) en vitamine B12 est considérée comme rare chez l'adulte (moins de 0,1 %)[82] (presque exclusivement chez des végétaliens stricts[83]), mais une déficience plus modérée est présente chez les personnes âgées (plus de 12 % des personnes âgées dans une étude de Framingham[84],[85]).
Selon la définition retenue du « déficit » en vitamine B12, dans la population générale, ce déficit varie de 5 à 60 %, en augmentant avec l'âge[86] et dans les pays en développement.
La carence en vitamine B12 et/ou sa mauvaise absorption digestive peuvent entraîner :
- une anémie de Biermer
- une hyperhomocystéinémie, la vitamine B12 insuffisante ne pouvant plus catalyser l'homocystéine en méthionine, ce qui augmente le risque cardiovasculaire (thrombose[87]), de maladies neuropsychiatriques et de fractures. L'hyperhomocystéinémie est particulièrement préoccupante dans les projets de grossesse[88] car augmentant le risque de fausse couche, de naissance prématurée, de prééclampsie, de faible poids à la naissance, de malformations du tube neural, de pied bot, etc.
- un risque accru d'infarctus du myocarde et d'accident vasculaire cérébral[89],[90] ;
- une maldigestion[91].
Causes
modifierÀ moins d'adopter une alimentation strictement végétale sans complémentation, ou d'être atteint de maladies auto-immunes provoquant une malabsorption, comme l'anémie pernicieuse ou la maladie cœliaque, ou d'avoir subi une gastrectomie, les réserves font que la carence est rare[92].
Problèmes d'absorption
modifierL'anémie pernicieuse (ou de Biermer) est secondaire à une malabsorption d'origine auto-immune de la vitamine par le tube digestif. Elle peut aussi être conséquence d'une chirurgie digestive (gastrectomie) ou d'une maladie inflammatoire chronique de l'intestin (maladie de Crohn).
Interactions médicamenteuses
modifierLa metformine (un anti-diabétique oral) pourrait réduire l'acide folique et les taux de vitamine B12.
Le protoxyde d'azote, utilisé comme anesthésique et comme substance récréative, peut oxyder la cob(1)alamine en cob(3)alamine, causant ainsi un déficit fonctionnel en vitamine B12[93].
Les traitements diminuant l'acidité de l'estomac, comme les inhibiteurs de la pompe à protons et les antihistaminiques H2, peuvent conduire sur le long terme à une carence[94],[95].
Dosage
modifierLe dosage peut s'effectuer par une technique dite de « competitive-binding luminescence » mais cette dernière est incapable de détecter certains cas de vrai déficit, probablement en raison de problèmes d'interférences avec le facteur intrinsèque fixé sur la cobalamine[96]. Les méthodes microbiologiques confondent les analogues et la vitamine B12. Cela fausse les résultats des dosages chez les végétaliens qui consomment des aliments contenant des analogues, comme les algues par exemple.
Le dosage de la protéine porteuse, la transcobalamine, ou plus précisément, la fraction de cette protéine fixée à la vitamine (holotranscobalamine), peut également s'effectuer[97], mais cette technique n'est pas disponible partout.
Les taux d'acide méthylmalonique (dosage remboursé sur prescription, en France) et d'homocystéine sont presque constamment élevés en cas de déficit en cobalamine et sont donc de bons indicateurs[98]. L'élévation de la concentration sanguine en homocystéine est cependant moins spécifique puisqu'elle peut se voir dans d'autres maladies. Cependant, des taux élevés d'acide méthylmalonique peuvent également être causés par une acidémie méthylmalonique. Si des taux élevés d'acide méthylmalonique s'accompagnent en outre de taux élevés d'acide malonique, cela peut indiquer une maladie métabolique habituellement négligée[99], l'acidurie combinée malonique et méthylmalonique (CMAMMA)[100].
Autres rôles en médecine
modifierEn 2000, une étude conclut qu'un taux sanguin élevé de B12 chez des patients âgés atteints de cancer avancé est un facteur prédictif de mortalité[101]. Inversement, en 2012, E. Andres et al. estiment que le pronostic vital est engagé chez 10 % des sujets carencés de plus de 75 ans[102].
La vitamine B12, seule ou associée à l'acide folique et à la vitamine B6, pourrait ralentir ou prévenir l'atrophie cérébrale chez les personnes âgées[103],[90]. Des études complémentaires sont nécessaires pour déterminer un effet préventif sur le déclin cognitif et la maladie d'Alzheimer[104],[105].
Végétalisme et B12
modifierLes aliments exclusivement végétaux ne contenant pas naturellement de vitamine B12, les personnes suivant un régime végétalien sont très susceptibles d'être carencées en B12, à moins de se supplémenter. Les végétariens sont également concernés, dans une moindre mesure[106]. En raison des troubles graves susceptibles d'être engendrés par une carence en vitamine B12, la complémentation systématique est donc recommandée par des organisations véganes majeures[107],[108]. Elle peut se faire à l'aide de comprimés (disponibles en magasins bio, en ligne et en pharmacie), de fioles de vitamine B12 (disponibles en pharmacie), ou d'aliments enrichis comme certaines céréales de petit déjeuner, jus de fruits, laits végétaux, etc.
Il peut être difficile de détecter une déficience en vitamine B12 chez les végétariens et végétaliens[108], car leur régime procure un apport élevé en acide folique qui peut masquer ou retarder les premiers symptômes[19]. De même, la spiruline alimentaire et le tempe, souvent utilisés à tort comme sources de vitamine B12, n'en contiennent pratiquement pas. Il s'agit en fait d'analogues structuraux de la B12, non utilisables par l'organisme[109].
Une méta-analyse de 2013 conclut à une carence en vitamine B12 chez une proportion importante des végétariens et végétaliens[110]. Une raison invoquée est la prise insuffisante de compléments qui, consommés en suffisance, apporteraient pourtant une quantité adéquate de vitamine métabolisable.
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « DOIT-ON PRENDRE DES COMPLÉMENTS DE VITAMINE B12 LORSQU’ON EST FLEXITARIEN ? », sur Santé.fr, site du Service public d'information en santé, (consulté le )
- « Position de l’ONAV relative à la complémentation en vitamine B12 chez les personnes ayant une alimentation flexitarienne, végétarienne et végane », sur Observatoire Nationale des Alimentations Végétales, (consulté le )
- (en) J. S. Combe, « History of a case of anaemia », Transactions of the Medico-Chirurgical Society of Edinburgh, 1824 (soumis le ), p. 194-204 (lire en ligne).
- (en) JMS Pearce, « Thomas Addison (1793-1860) », J R Soc Med, vol. 97, no 6, , p. 297-300. (PMID 15173338, PMCID PMC1079500, lire en ligne [html])
- (en) « Addison-Biermer disease », sur Who Named It?
- (en) George R Minot et William P Murphy, « Treatment of pernicious anemia by a special diet », JAMA, vol. 87, no 7, , p. 470-6. (DOI 10.1001/jama.1926.02680070016005, résumé)
- J.-L. Schlienger et L. Monnier, « L’épopée de la découverte des vitamines: The history of the discovery of vitamins », Médecine des maladies métaboliques, vol. 5, no 6, , p. 593-597 (DOI 10.1016/S1957-2557(11)70324-8, lire en ligne).
- (en) Edward L. Rickes, Norman G. Brink, Frank R. Koniuszy, Thomas R. Wood et Karl Folkers, « Comparative data on vitamin B12 from liver and from a new source, Streptomyces griseus », Science, vol. 108, no 2814, (DOI 10.1126/science.108.2814.634.b, lire en ligne).
- Cécile Dumas, « La synthèse de la vitamine B12 enfin complète », Sciences et Avenir.com, (lire en ligne).
- Loeffler, G., Basiswissen Biochemie, Heidelberg, Springer, (ISBN 3-540-23885-9), p. 606.
- (en) E. M. Bertrand, M. A. Saito, J. J. Young et B. A. Neilan, « Vitamin B12 biosynthesis gene diversity in the Ross Sea: the identification of a new group of putative polar B12 biosynthes », Environmental Microbiology, vol. 13, no 5, , p. 1285–98 (PMID 21410623, DOI 10.1111/j.1462-2920.2011.02428.x, lire en ligne)
- [1]
- Guilland 2013, p. 1088-1089.
- Lauralee Sherwood, Hillar Klandorf et Paul H. Yancey (trad. de l'anglais), Physiologie animale, Louvain-la-Neuve (Belgique)/Paris, De Boeck, , 61 p. (ISBN 978-2-8073-0286-0, lire en ligne), p. 694.
- Lauralee Sherwood, Hillar Klandorf et Paul H. Yancey (trad. de l'anglais), Physiologie animale, Louvain-la-Neuve (Belgique)/Paris, De Boeck, , 61 p. (ISBN 978-2-8073-0286-0, lire en ligne), p. 710.
- « Additifs nutritionnels De la vitamine B pour booster la production laitière », sur Web-agri (consulté le )
- Sherwood 2016, op. cit., p. 704.
- (en) H. Leon Abrams, Vegetarianism : Another View, Cambridge University Press, (ISBN 0-521-40215-8), p. 1570.dans The Cambridge World History of Food, vol. 2, K.F. Kiple (dir.).
- « Les insectes pour l’alimentation humaine et animale », sur www.fao.org (consulté le )
- (en) « edible insects (page 73) », sur Organisation des Nations unies pour l'alimentation et l'agriculture, (consulté le ).
- (en) Peter J. Van Soest, Nutritional Ecology of the Ruminant, Cornell University Press, , 488 p. (ISBN 978-1-5017-3235-5, lire en ligne), p. 71-72..
- (en) Glyn Ed Davies, Colobine Monkeys : Their Ecology, Behaviour and Evolution, Cambridge University Press, , 415 p. (ISBN 978-0-521-33153-1, lire en ligne), p. 232-233..
- (en) Daphne A. Roe, Vitamin B Complex, Cambridge University Press, (ISBN 0-521-40214-X), p. 754.dans The Cambridge World History of Food, vol. 1, K.F. Kiple (dir.).
- « Ce que tout végane doit savoir sur la vitamine B12 », sur Fédération végane (consulté le ).
- « DOIT-ON PRENDRE DES COMPLÉMENTS DE VITAMINE B12 LORSQU’ON EST FLEXITARIEN ? », sur Santé.fr : le site du Service Public d’information en santé, (consulté le )
- A. L. Rauma, R. Törrönen, O. Hänninen et H. Mykkänen, « Vitamin B-12 status of long-term adherents of a strict uncooked vegan diet ("living food diet") is compromised », The Journal of Nutrition, vol. 125, no 10, , p. 2511–2515 (ISSN 0022-3166, PMID 7562085, lire en ligne, consulté le ).
- Corinna Koebnick, Ada L. Garcia, Pieter C. Dagnelie et Carola Strassner, « Long-term consumption of a raw food diet is associated with favorable serum LDL cholesterol and triglycerides but also with elevated plasma homocysteine and low serum HDL cholesterol in humans », The Journal of Nutrition, vol. 135, no 10, , p. 2372–2378 (ISSN 0022-3166, PMID 16177198, lire en ligne, consulté le ).
- M. S. Donaldson, « Metabolic vitamin B12 status on a mostly raw vegan diet with follow-up using tablets, nutritional yeast, or probiotic supplements », Annals of Nutrition & Metabolism, vol. 44, nos 5-6, , p. 229–234 (ISSN 0250-6807, PMID 11146329, DOI 10.1159/000046689, lire en ligne, consulté le ).
- Robert H. Allen et Sally P. Stabler, « Identification and quantitation of cobalamin and cobalamin analogues in human feces », The American Journal of Clinical Nutrition, vol. 87, no 5, , p. 1324–1335 (ISSN 1938-3207, PMID 18469256, PMCID PMC2900183, lire en ligne, consulté le ).
- (en) Alan M. Immerman, « Health Unlimited », (version du sur Internet Archive), p. 62.
- (en) Nexo E, Hoffmann-Lucke E., « Holotranscobalamin, a marker of vitamin B-12 status: analytical aspects and clinical utility », Am J Clin Nutr, no 94, , p. 359S-365S (PMID 21593496, lire en ligne).
- (en) Stabler SP., « Vitamin B12 deficiency », N Engl J Med, no 368, , p. 149-160 (PMID 23697526, lire en ligne).
- « Métabolisme de la vitamine B12 », sur www.hematocell.fr (consulté le ).
- (en) Victor Herbert, « Vitamin B12: plant sources, requirements and assay », Am Journ Clin Nutr, no 48, , p. 852-8 (lire en ligne).
- (en) V. Herbert, « Recommended dietary intakes (RDI) of vitamin B-12 in humans. », The American Journal of Clinical Nutrition, vol. 45, no 4, , p. 671–678 (ISSN 0002-9165 et 1938-3207, PMID 3565293, lire en ligne, consulté le ).
- S. el Kholty, J. L. Gueant, L. Bressler et M. Djalali, « Portal and biliary phases of enterohepatic circulation of corrinoids in humans », Gastroenterology, vol. 101, no 5, , p. 1399–1408 (ISSN 0016-5085, PMID 1936810, lire en ligne, consulté le ).
- « Anémies macrocytaires de l’adulte », sur medical-actu.com, .
- (en) Tóshiko Takahashi-Iñiguez, Enrique García-Hernandez, Roberto Arreguín-Espinosa et María Elena Flores, « Role of vitamin B12 on methylmalonyl-CoA mutase activity », Journal of Zhejiang University SCIENCE B, vol. 13, , p. 423-437 (ISSN 1673-1581 et 1862-1783, PMID 22661206, PMCID 3370288, DOI 10.1631/jzus.B1100329, lire en ligne, consulté le )
- Green (2013) Physiology, dietary sources, and requirements. Encyclopedia of Human Nutrition ;4:351‐6.
- Parlement Européen, Règlement (UE) no 1169/2011 du Parlement européen et du Conseil du 25 octobre 2011, Europe, JO de l'UE, (lire en ligne), p. 62.
- (en) Center for Food Safety and Applied Nutrition, « Daily Value on the Nutrition and Supplement Facts Labels », FDA, (lire en ligne, consulté le )
- (en) « Office of Dietary Supplements - Vitamin B12 », sur ods.od.nih.gov (consulté le )
- (en) « Guidance for Industry: A Food Labeling Guide », sur U.S. Food and Drug Administration, (consulté le )
- (en) Carmel, « How I treat cobalamin (vitamin B12) deficiency », Blood, no 112 (6), , p. 2214-2221 (lire en ligne)
- (en) EFSA (autorité européenne de sécurité sanitaire), Tolerable Upper Intake Levels for Vitamins and Minerals, EU, EFSA, , 480 p. (lire en ligne), « No adverse effects have been associated with excess vitamin B12 intake from food or supplements in healthy individuals. » (p. 46).
- (en) Hunt A, Harrington D, Robinson S, « Vitamin B12 deficiency » BMJ 2014;349:g5226
- « Vitamine B12 dans les aliments du groupe Produits laitiers, œufs », (consulté le )
- « Teneurs par constituant - Vitamine B12 (µg/100 g) », sur pro.anses.fr ANSES, (consulté le ).
- (en) « Nutrient Lists for Vitamin B12 », sur ndb.nal.usda.gov USDA National Nutrient Database for Standard Reference (consulté le ).
- (en) Fumio Watanabe, « Vitamin B12 Sources and Bioavailability », Exp Biol Med (Maywood), vol. 232, no 10, , p. 1266-74 (PMID 17959839, lire en ligne)
- Aśok C.Antony, Hematology, 7e édition, (DOI 10.1016/B978-0-323-35762-3.00039-1, lire en ligne), « Chapitre 39 - Megaloblastic Anemias ».
- (en) Watanabe, « Vitamin B12-Containing Plant Food Sources for Vegetarians », Nutrients, vol. 6, no 5, , p. 1861–1873 (lire en ligne)
- (en) Dagnelie et al., « Vitamin B-12 from algae appears not to be bioavailable », Am J Clin Nutr, vol. 53, no 3, , p. 695-7 (PMID 2000824, lire en ligne).
- (en) Anna-Liisa Rauma, Riitta Törrönen, Osmo Hänninen et Hannu Mykkänen, « Vitamin B-12 Status of Long-Term Adherents of a Strict Uncooked Vegan Diet (“Living Food Diet”) Is Compromised », The Journal of Nutrition, vol. 125, no 10, (ISSN 0022-3166, DOI 10.1093/jn/125.10.2511, lire en ligne, consulté le ).
- Fumio Watanabe,* Yukinori Yabuta, Tomohiro Bito, et Fei Teng, « Vitamin B12-Containing Plant Food Sources for Vegetarians », Nutrients, vol. 6, no 5, , p. 1861-1873 (DOI 10.3390/nu6051861).
- K. Yamada, Y. Yamada, M. Fukuda et S. Yamada, « Bioavailability of dried asakusanori (porphyra tenera) as a source of Cobalamin (Vitamin B12) », International Journal for Vitamin and Nutrition Research. Internationale Zeitschrift für Vitamin- und Ernährungsforschung. Journal international de vitaminologie et de nutrition, vol. 69, no 6, , p. 412–418 (ISSN 0300-9831, PMID 10642899, DOI 10.1024/0300-9831.69.6.412, lire en ligne, consulté le ).
- Fumio Watanabe, Shigeo Takenaka, Hiromi Kittaka-Katsura, Shuhei Ebara et Emi Miyamoto, « Characterization and bioavailability of vitamin B12-compounds from edible algae », J Nutr Sci Vitaminol, Tokyo, vol. 48, no 5, , p. 325-31
- (en) Anantharajappa Kumudha, Sagaya Selva Kumar, Munna Singh Thakur et Gokare Aswathanarayana Ravishankar, « Purification, identification, and characterization of methylcobalamin from Spirulina platensis », Journal of Agricultural and Food Chemistry, vol. 58, no 18, , p. 9925–9930 (ISSN 1520-5118, PMID 20799700, DOI 10.1021/jf102159j, lire en ligne, consulté le )
- Adil Ghani Khan et S. V. Eswaran, « Woodward's synthesis of vitamin B12 », Resonance, vol. 8, no 6, , p. 8–16 (DOI 10.1007/BF02837864)
- A. Eschenmoser et C. E. Wintner, « Natural product synthesis and vitamin B12 », Science, vol. 196, no 4297, , p. 1410–20 (PMID 867037, DOI 10.1126/science.867037)
- Doris Riether et Johann Mulzer, « Total Synthesis of Cobyric Acid: Historical Development and Recent Synthetic Innovations », European Journal of Organic Chemistry, vol. 2003, , p. 30–45 (DOI 10.1002/1099-0690(200301)2003:1<30::AID-EJOC30>3.0.CO;2-I)
- « Formes de vitamine B12 », sur www.vitamine-b12.net (consulté le )
- « La vitamine B12, fiche nutrition », sur Vegan Pratique (consulté le ).
- J. H. Martens, H. Barg, M. J. Warren et D. Jahn, « Microbial production of vitamin B12 », Applied Microbiology and Biotechnology, vol. 58, no 3, , p. 275–85 (PMID 11935176, DOI 10.1007/s00253-001-0902-7).
- Selon le site GMO Compass.
- (en) Linnell J. C., Matthews D. M., « Cobalamin metabolism and its clinical aspects », Clinical Science, vol. 66, no 2, , p. 113–21 (PMID 6420106).
- Vitamin B12. Code of Federal Regulations. U.S. Government Printing Office. Title 21, Volume 3. Revised. April 1, 2001. CITE: 21CFR184.1945 p. 552.
- (en) De Baets S., Vandedrinck S., Vandamme E. J., Encyclopedia of Microbiology, vol. 4, New York, Academic Press, , 2e éd. (ISBN 0-12-226800-8), « Vitamins and Related Biofactors, Microbial Production », p. 837–853.
- (en) Hans-Peter Hohmann, Gilberto Litta, Michael Hans et Angelika Friedel, « Vitamins, 13. Vitamin B12 (Cobalamins) », dans Ullmann's Encyclopedia of Industrial Chemistry, American Cancer Society, (ISBN 978-3-527-30673-2, DOI 10.1002/14356007.t27_t03, lire en ligne), p. 1–10.
- (en) Hugo Minney, « Where does B12 come from? », sur B12 deficiency Support Group (Reg Charity 1146432), (version du sur Internet Archive).
- (en-US) Jennifer Rooke, « Do carnivores need Vitamin B12 supplements? », Baltimore Post-Examiner, (lire en ligne, consulté le ).
- Boddy K, King P, Mervyn L, Macleod A, Adams JF. Retention of cyanocobalamin, hydroxocobalamin, and coenzyme B12 after parenteral administration. Lancet 1968;292(7570):710‐2 (résumé)
- Aguilar Franco C. Subcutaneous administration of vitamin B12. Atencion Primaria 2004;34:509 (author reply 509).
- Bolaman Z, Kadikoylu G, Yukselen V, Yavasoglu I, Barutca S, Senturk T (2003) Oral versus intramuscular cobalamin treatment in megaloblastic anemia: a single‐center, prospective, randomized, open‐label study. Clinical Therapeutics ;25(12):3124‐34.
- Kuzminski AM, Giacco EJ, Allen RH, Stabler SP, Lindenbaum J. Effective treatment of cobalamin deficiency with oral cobalamin. Blood 1998;92(4):1191‐8.
- Kripke C (2006) Is oral vitamin B12 as effective as intramuscular injection?. American Family Physician ;73:65
- Wang, H., Li, L., Qin, L. L., Song, Y., Vidal‐Alaball, J., & Liu, T. H. (2018) Oral vitamin B12 versus intramuscular vitamin B12 for vitamin B12 deficiency. Cochrane Database of Systematic Reviews, (3).
- Saraswathy AR, Dutta A, Simon EG, Chacko A. (2012) Randomized open label trial comparing efficacy of oral versus intramuscular vitamin B12 supplementation for treatment of vitamin B12 deficiency. Gastroenterology ;142(5 Suppl 1):S216.
- Pawlak R (2015) Is vitamin B12 deficiency a risk factor for cardiovascular disease in vegetarians?. American Journal of Preventive Medicine ;48(6):e11‐26.
- Pawlak R, Parrott SJ, Raj S, Cullum‐Dugan D, Lucus D (2013). How prevalent is vitamin B12 deficiency among vegetarians?. Nutrition Reviews ;71(2):110‐7.
- Dans le contexte de la source Guilland 2013, il parait s'agir des adultes atteints de manifestations cliniques (maladie de Biermer) par rapport à la population générale dans les pays développés.
- (en) Fumio Watanabe, Yukinori Yabuta, Yuri Tanioka et Tomohiro Bito, « Biologically active vitamin B12 compounds in foods for preventing deficiency among vegetarians and elderly », Journal of Agricultural and Food Chemistry, vol. 61, no 28, , p. 6769‐75 (DOI 10.1021/jf401545z, lire en ligne).
- Guilland 2013, p. 1085.
- J. Lindenbaum, I. H. Rosenberg, P. W. Wilson et S. P. Stabler, « Prevalence of cobalamin deficiency in the Framingham elderly population », The American Journal of Clinical Nutrition, vol. 60, no 1, , p. 2–11 (ISSN 0002-9165, PMID 8017332, DOI 10.1093/ajcn/60.1.2, lire en ligne, consulté le ).
- Netgen, « Hypovitaminose B12 : quoi de neuf ? », sur Revue Médicale Suisse (consulté le )
- (en) Remacha A. F., Souto J. C., Pinana J. L. et al., « Vitamin B12 deficiency, hyperhomocysteinemia and thrombosis: a case and control study », Int J Hematol, no 93, , p. 458-464 (lire en ligne)
- (en) Stephen Walsh, Plant Based Nutrition, Royaume-Uni, Vegan Society, (lire en ligne).
- Schroll JB, Bero L. Regulatory agencies hold the key to improving Cochrane Reviews of drugs [editorial]. Cochrane Database of Systematic Reviews2015; Vol. 4. [DOI: 10.1002/14651858.ED000098]
- (en) J. David Spence, « Metabolic vitamin B12 deficiency: a missed opportunity to prevent dementia and stroke », Nutrition Research, vol. 36, no 2, , p. 109–116 (ISSN 0271-5317, DOI 10.1016/j.nutres.2015.10.003, lire en ligne, consulté le ).
- Federici L, Loukili N.H, Zimmer J, Affenberger S, Maloisel F & Andrès E (2007) Manifestations hématologiques de la carence en vitamine B12 : données personnelles et revue de la littérature. La Revue de médecine interne, 28(4), 225-231 (résumé).
- Description de la vitamine B12 (passeport santé)
- (es) Alarcia R, Ara JR, Serrano M, García M, Latorre AM, Capablo JL. « [Severe polyneuropathy after using nitrous oxide as an anesthetic. A preventable disease?] » Rev. Neurol. (Paris) 1999;29(1):36-8.
- Gilles Macaigne, « Effets secondaires des IPP au long cours », sur FMC-HGE, (consulté le ).
- « Un déficit en vitamine B12 est-il associé à la prise d’inhibiteurs de la pompe à protons ou d’antihistaminiques H2 ? », sur Minerva, (consulté le ).
- (en) Carmel R, Agrawal YP, « Failures of cobalamin assays in pernicious anemia » N Engl J Med. 2012;367:385-6.
- (en) S. G. Heil, R. de Jonge, M. C. de Rotte et al., « Screening for metabolic vitamin B12 deficiency by holotranscobalamin in patients suspected of vitamin B12 deficiency: a multicentre study », Ann Clin Biochem, no 49, , p. 184-189 (PMID 22302152, lire en ligne)
- Savage DG, Lindenbaum J, Stabler SP, Allen RH., « Sensitivity of serum methylmalonic acid and total homocysteine determinations for diagnosing cobalamin and folate deficiencies », Am J Med, no 96, , p. 239-246 (PMID 8154512, lire en ligne)
- (en) Jennifer L Sloan, Jennifer J Johnston, Irini Manoli et al., « Exome sequencing identifies ACSF3 as a cause of combined malonic and methylmalonic aciduria », Nature Genetics, vol. 43, no 9, , p. 883–886 (ISSN 1061-4036 et 1546-1718, PMID 21841779, PMCID 3163731, DOI 10.1038/ng.908, lire en ligne).
- Monique G. M. de Sain-van der Velden, Maria van der Ham, Judith J. Jans, Gepke Visser et al., « A New Approach for Fast Metabolic Diagnostics in CMAMMA », dans JIMD Reports, Volume 30, vol. 30, Springer Berlin Heidelberg, (ISBN 978-3-662-53680-3, PMID 26915364, PMCID 5110436, DOI 10.1007/8904_2016_531, lire en ligne), p. 15–22.
- (en) P. Geissbühler, B. Mermillod et C.-H. Rapin (2000) « Elevated serum vitamine B12 levels associeted with CRP as a predictive factor of mortality in palliative care cancer patients. A prospective study over five years » Journal of pain and symptom management ;20(2):93-103.
- E. Andres, T. Vogel, M. Mecili et G. Kaltenbach « Analyse des manifestations hématologiques des carences en vitamine B12 chez 103 patients âgés d'au moins 75 ans » La Revue de médecine interne vol. 32 supplément 1, juin 2012, p. S81 lire en ligne
- Uwe Gröber, Klaus Kisters et Joachim Schmidt, « Neuroenhancement with Vitamin B12—Underestimated Neurological Significance », Nutrients, vol. 5, no 12, , p. 5031–5045 (ISSN 2072-6643, PMID 24352086, PMCID PMC3875920, DOI 10.3390/nu5125031, lire en ligne, consulté le ).
- Gwenaëlle Douaud, Helga Refsum, Celeste A. de Jager et Robin Jacoby, « Preventing Alzheimer’s disease-related gray matter atrophy by B-vitamin treatment », Proceedings of the National Academy of Sciences of the United States of America, vol. 110, no 23, , p. 9523–9528 (ISSN 0027-8424, PMID 23690582, PMCID PMC3677457, DOI 10.1073/pnas.1301816110, lire en ligne, consulté le ).
- A. David Smith, Helga Refsum, Teodoro Bottiglieri et Michael Fenech, « Homocysteine and Dementia: An International Consensus Statement », Journal of Alzheimer's disease: JAD, vol. 62, no 2, , p. 561–570 (ISSN 1875-8908, PMID 29480200, PMCID PMC5836397, DOI 10.3233/JAD-171042, lire en ligne, consulté le ).
- (en) Gilsing et al., « Serum concentrations of vitamin B12 and folate in British male omnivores, vegetarians and vegans: results from a cross-sectional analysis of the EPIC-Oxford cohort study », Eur J Clin Nutr, vol. 64, no 9, , p. 933-9 (PMID 20648045)
- « Ce que tout végane doit savoir sur la vitamine B12 », sur federationvegane.fr (consulté le ).
- (en) « What Every Vegan Should Know About Vitamin B12 », The Vegan Society, (lire en ligne, consulté le )
- H. Leon Abrams 2000, op. cit., p. 1565-1566.
- (en) Roman Pawlak, Scott James Parrott, Sudha Raj et Diana Cullum-Dugan, « How prevalent is vitamin B12 deficiency among vegetarians? », Nutrition Reviews, vol. 71, no 2, , p. 110–117 (ISSN 0029-6643, DOI 10.1111/nure.12001, lire en ligne, consulté le ).
Voir aussi
modifierBibliographie
modifier- Jacqueline Zittoun, « Découverte de la vitamine B12 » La Revue du Praticien, 2000;50:473-475.
- Jean-Claude Guilland, « Vitamine B12 (cobalamines) », La Revue du Praticien, vol. 63, no 8, , p. 1085-1090.
- Vidal‐Alaball J, Butler C, Cannings‐John R, Goringe A, Hood K, McCaddon A ... & Papaioannou A (2005) Oral vitamin B12 versus intramuscular vitamin B12 for vitamin B12 deficiency. Cochrane Database of Systematic Reviews, (3).
Liens externes
modifier- Compendium suisse des médicaments : spécialités contenant Vitamine B12
- Page spécifique sur le Vidal.fr
- Site Internet destiné à la protection des populations véganes.