Castor d'Europe
Castor d'Europe, Castor commun, Castor d'Eurasie
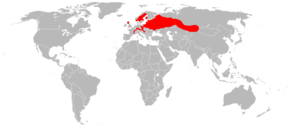
Répartition géographique
Le castor d'Europe, castor commun ou castor d'Eurasie (Castor fiber), autrefois appelé bièvre, est une espèce de mammifère aquatique de la famille des Castoridae. C'est le plus grand rongeur autochtone d'Eurasie et de l'hémisphère Nord. Son apparence est très semblable à celle du castor du Canada.
Après avoir failli disparaître, le Castor d'Europe a été classé espèce protégée dans plusieurs pays (dont la France, la Belgique, la Suisse et le Luxembourg), lui permettant de commencer à reconquérir une partie de ses habitats : les cours d'eau, les zones humides, les tourbières, les lacs, les étangs d'Europe et d'Asie. Il a fait l'objet d'opérations de réintroduction dans certains pays. Il reste néanmoins vulnérable en raison d'un récent effondrement de sa diversité génétique.
Cette « espèce-ingénieur » des écosystèmes est aussi une «espèce-clé» et facilitatrice en raison de sa capacité à retenir l'eau par ses barrages et à accroître la biodiversité en complexifiant et en ouvrant certaines parties des ripisylves, permettant l'expression d'une flore et d'une faune plus héliophiles. Capable de régénérer ou d'augmenter la diversité des espèces, il est considéré comme un « auxiliaire » de la renaturation et revitalisation des cours d'eau, nécessaire à la restauration écologique et à la vie sauvage des cours d'eau.
Description / Généralités
modifierDe loin ou dans l'eau, il peut être confondu avec le rat musqué ou le ragondin (dont le corps est toutefois moins immergé quand il nage ; le castor ne laisse visible hors d'eau que sa nuque et la moitié supérieure de la tête, alors que toute la tête et le haut du dos du ragondin émergent). Le rapport longueur de tête/longueur du corps (sans queue) est d'environ un cinquième pour le castor et d'un tiers pour le ragondin[1]. Le risque de confusion peut poser problème car le retour du castor se fait dans un environnement où rats musqués et ragondins sont souvent présents et ces derniers, en tant qu'espèce exotique envahissante, peuvent être chassés ou piégés.
Poids
modifierEn France, un adulte pèse de 16 à 28 kg selon l'INPN et 21 kg en moyenne selon l'ONCFS ou 15 à 35 kg selon A. Nolet[2],[1],[3] ; pour 300 à 500 grammes à la naissance[2]. En Finlande où cohabitent le Castor d'Europe et le Castor du Canada (introduit), le poids moyen d'une femelle européenne pleine est de 23,2 kg (de 17,0 à 31,0 kg), celui d'une femelle non-enceinte de 13,0 kg (de 2,9 à 21,5 kg) et d'un mâle (14,9 kg, de 5,7 à 26 kg)[4]. Ces chiffres sont proches de ceux de Hinze[5] (1950) pour le Castor du Canada (qui en zone froide pèse en moyenne 15,1 kg, 15,3 kg (pour une femelle adulte) et 8,1 kg pour un jeune mâle, et 7,4 kg pour une femelle d'un an). Ce poids varie saisonnièrement, augmentant en automne où des graisses sont stockées dans la queue[6].
Sa croissance semble terminée à l'âge de 3 ou 4 ans, comme celle de son cousin américain[7].
Taille
modifierIl mesure en France jusqu'à 1,35 mètre[1] (queue d'environ 30 cm[3] (29 à 31 cm[2]) comprise) ce qui en fait le plus gros rongeur autochtone européen. Le record actuel serait de 38 kg pour un castor du Rhône[8].
Il est depuis longtemps constaté une augmentation de la taille moyenne selon un gradient Est-Ouest (de l'Asie à l'Europe de l'Ouest) et aussi (« contrairement à la règle de Bergmann »[3]) selon un gradient nord-sud, sans que l'on sache à ce jour si ces variations sont d'origine génétique ou liée aux contextes bioclimatiques[9]. Ces différences sont utilisées par les gestionnaires pour le maintien d'une diversité génétique au sein de la métapopulation[10].
Organes des sens
modifierCet animal est doté d'une bonne vision nocturne mais aussi d'une vision diurne lui permettant de discriminer les couleurs[11], ce qui incite à le classer comme semi-nocturne plutôt que nocturne (quand il n'est pas dérangé, il est plus actif le jour et l'est nécessairement près du cercle polaire où le soleil de minuit fait qu'il n'existe plus de vraie nuit en été).
La recherche de nourriture, ses déplacements de nuit ou dans le noir de sa hutte ou de son terrier sont facilités par un excellent odorat, une bonne ouïe et des moustaches et des poils tactiles (vibrisses) situés au niveau des sourcils.
Pelage
modifierLe pelage du castor est très dense (12 000 à 23 000 poils/cm2) et composé de deux sortes de poils, l'un étant plus long, lisse et dur, et l'autre un fin duvet)[12]. Sa couleur varie du blond à reflets roux à une couleur foncée (plus au nord et à l'est de l'Europe)[2]. La mue se produit d'avril à juillet. Selon l'Encyclopédie cynégétique d'Henri Agasse (1794), dans les contrées du nord les plus reculées les castors étaient « tout noirs », mais « Il s'en trouve aussi quelques-uns tout blancs ; les fourrures des noirs sont les plus belles et les plus estimées »[13].
Forme
modifierLe castor a une forme relativement trapue au sol et fuselée dans l'eau.
Ses mains (pattes antérieures) longues de 5 cm, sont munies de cinq doigts griffus non palmés, aptes au fouissage, avec un pouce opposé facilitant la préhension. Le premier doigt est rudimentaire, évoquant un ongle long et recourbé ne touchant pas le sol quand l'animal marche, les autres ongles sont plus forts et, sauf le second, émoussés par l'usage. La paume porte sous le premier doigt un coussinet rigide et épais qui renforce la préhension. Au repos le pouce est enfermé dans la paume, comme chez les primates[14]
Le pied (de 15 cm) possède 5 doigts complètement palmés, avec un ongle double au second doigt, lui servant de « peigne » quand il entretient sa fourrure[2].
Sa queue plate est remarquable pour un mammifère.
Queue
modifierSa queue est noire, plate, ovale, épaisse et musculeuse, large de 13 à 16 cm et longue d'environ 30 cm ; elle cache 24 vertèbres. Elle lui sert d'outil (contrepoids lors des déplacements de matériaux, traîneau pour les jeunes), de propulseur et de gouvernail, mais aussi de réserve hivernale de graisse[6] et d'échangeur thermique (il la plonge dans l'eau fraîche quand il fait chaud[15],[16]). Cette queue est protégée par des écailles ou de pseudo-écailles sur les 2/3 de sa longueur et couverte de poils à sa jonction avec le corps[2].
Dentition
modifierSa formule dentaire est décrite comme suit : 1 incisive, 1 prémolaire et 3 molaires par demi-mâchoire.
Dimorphisme sexuel
modifierComme chez le castor américain, il n'existe pratiquement pas de dimorphisme sexuel apparent. La femelle porte deux paires de mamelles et chez les deux sexes, un seul orifice (uro-anal et génital constitue le débouché d'un pseudo cloaque).
La seule méthode de sexage sûre, non invasive et ne nécessitant pas de capture est l'analyse génétique (à partir de poils en général)[17]. Sinon, l'observation des mamelles ou du comportement est utilisée :
Selon une étude finlandaise, les mâles passent un peu plus de temps à voyager[18], ils patrouillent plus loin que les femelles. Ils passent probablement plus de temps à marquer la périphérie éloignée de leur territoire.
Les comportements et le marquage odorant diffèrent selon le sexe des individus ; quel que soit le type d'habitat, les mâles et femelles utilisent leurs glandes odorantes qui, ensemble, ont un poids semblable quel que soit le sexe. Les glandes anales du mâle sont cependant nettement plus développées que celles des femelles, alors que ceux-là ont des sacs odorants plus petits que celles-ci. Le fait de passer plus de temps à marquer son territoire diminue la taille des sacs odorants, ce dimorphisme sexuel pourrait donc provenir d'un dimorphisme comportemental[19].
Chez un castor mort ou capturé puis endormi, la présence/absence de l'os pénien[20],[21] identifiable par l'exploration du cloaque ou par échographie interne renseigne sur le sexe de l'individu.
Cloaque et glandes anales
modifierLes glandes anales produisent du castoreum stocké dans deux poches et jouant au moins un rôle majeur sur le plan de la communication olfactive[3]. Les orifices uro-anaux et génitaux débouchant dans la même cavité (pseudo cloaque).
Fèces
modifierLes excréments, encore riches en résidus de matière ligneuse, allongés, mesurent 2 × 3 cm environ ; ils sont émis dans l'eau où ils nourrissent les poissons et divers invertébrés.
Durée de vie
modifierPeu de données sont disponibles au sujet de la durée de vie des castors sauvages ; le castor vivrait de 15 à 20 ans[22]. En captivité, il a dans un cas au moins vécu 24 ans[22]
-
Crâne de castor européen contemporain
-
Vue en coupe longitudinale
-
Testicules, castoréum et glandes anales du Castor d'Europe mâle[24]
Évolution du Castor d'Europe
modifierAspects paléontologiques
modifierOrigines
modifierDes travaux issus du séquençage des génomes mitochondriaux complets des deux espèces actuelles de castors existantes laissent penser que dans l'arbre phylogénétique des rongeurs il s'est séparé d'un groupe d'écureuils à queue écaillée (Anomalurus) il y a environ 54 millions d'années, et les castors canadiens et eurasiatiques auraient divergé d'un ancêtre commun il y a plus de sept millions d'années (ce résultat est cohérent avec l'hypothèse qu'une migration de Castor d'Eurasie vers l'Amérique du Nord dès 7,5 millions d'années, phénomène qui aurait pu conduire à leur spéciation)[25]. L'ancêtre commun des populations-reliques de castors eurasiatiques actuelles aurait vécu il y a environ 210 000 ans (plus tôt qu'on ne le pensait). Le taux de substitution de l'ADN mitochondrial du Castor est considérablement inférieur à celui des autres rongeurs, très probablement en raison de sa durée de vie plus longue [25]. Des preuves fossiles[26] montrent que le Castor est présent en Europe de l'ouest au moins depuis le Miocène supérieur[27] (soit environ 20 millions d'années. Il a donc fait partie à la fin de l'ère tertiaire des premiers mammifères dits évolués (avec les ruminants, mastodontes, dinothériums, et les premiers singes pratiquant une bipédie partielle, mais bien avant l'apparition du genre Homo…).
Il semble être apparu en Eurasie, et n'aurait colonisé l'Amérique du Nord qu'à la fin du Miocène[28], avec déjà des dents poussant continuellement et lui conférant une capacité à écorcer et couper des branches, mais de manière probablement moins performante chez l'ancêtre Dipoides que chez les taxons de castors qui l'ont suivi[29].
Durant toute l'ère tertiaire ce genre était beaucoup plus diversifié[30]. Les ancêtres directs du Castor d'Europe étaient largement présents lors de la période de réchauffement du Miocène (réchauffement le plus intense des 30 derniers millions d'années ; le climat de l'Europe du Sud était tropical), mais l'espèce s'est également adaptée au froid, car présente sur les cours d'eau de la toundra et des steppes nordiques d'Eurasie[31],[32].
Les fossiles trouvés nombreux dans le lignite de Pietrafitta (en Ombrie au centre de l'Italie) confirment qu'au Villafranchien (période du début des oscillations climatiques causant les actuelles périodes glaciaires et interglaciaires), les fossiles de castor sont abondants, avec semble-t-il une ou plusieurs sous-espèces depuis disparues[33].
Histoire post-glaciaire
modifierL'espèce a survécu à de nombreux cycles de glaciation/déglaciation.
Les données paléoécologiques récentes et acquises depuis plus d'un siècle suggéraient que les deux sous-espèces européennes ayant survécu ont résisté à la dernière glaciation dans deux principaux « refuges » : 1) la péninsule Ibérique et le Sud de la France pour les castors occidentaux, et 2) la région de la mer Noire pour la sous-espèce orientale[34]. Des études récentes de l'acide désoxyribonucléique mitochondrial[35] appuient fortement cette hypothèse ; selon ces données génétiques, toutes les populations « post-Âge de glace » de l'ouest de l'Europe (dont celles qui ont peuplé ou repeuplé l'actuelle Grande-Bretagne) provenaient effectivement du « refuge occidental », ce qui explique la division actuelle des populations relictuelles de castors en deux grandes unités évolutives significatives respectivement réparties à l'Est et à l'Ouest de l'Europe[34].
Importance paléopaysagère et paléoécologique du Castor d'Europe : constructeur et aménageur du paysage
modifierLe castor présente des caractères uniques dans le monde animal (si l'on en excepte l'homme) : il est à la fois « ingénieur hydraulicien », « constructeur » (de digues, huttes et terriers) et « ingénieur forestier » ; il est la seule espèce capable d'édifier des barrages, créer d'importantes réserves d'eau et de couper des arbres plus gros que lui (l'éléphant abat des arbres mais ne les coupe pas), tout en permettant à la souche de produire des rejets (taillis). De nombreux indices récemment collectés dans le monde (dont en France par Alexandra Liarsou[36],[37]) semblent faire de lui un « facteur de forçage des hydrosystèmes du Tardiglaciaire et de l'Holocène », de même que pour la constitution de vastes tourbières. Sans lui, la fluctuation des débits de cours d'eau et de certaines zones humides et lacs[38] aurait sans doute été exacerbée, avec plus de sécheresses et d'incendies de forêt et moins d'espèces différentes dans le paysage[39] ; ceci vaut a priori pour les interglaciaires antérieurs.
Les études archéopaléontologiques doivent se poursuivre[40], mais des preuves, nombreuses, d'une capacité à rapidement, fortement et durablement transformer et enrichir son milieu de vie sont fournies par:
- des observations contemporaines faites in situ là où il n'a pas disparu, là où il recolonise spontanément des milieux ou là où il a été réintroduit ; elles montrent un effet marqué sur la biodiversité animale et végétale qui augmente dans les zones humides qu'il crée et qu'il entretient (là où il fait des barrages ou ouvre la ripisylve au soleil[41],[42]).
- des études archéozoologiques ; elles commencent aussi à préciser la cohabitation homme-castor de la Préhistoire à la période médiévale[43]. Des analyses d'occurrences archéozoologiques ont également précisé sa biogéographie ancienne et son utilisation dans les « établissements humains » (synthétisée par Alexandra Liarsou, 2005 ; Liarsou, 2012 : 591-642). ;
- diverses études d'écologie rétrospective et d'histoire environnementale ; notamment en Grande-Bretagne et en Scandinavie, elles ont par exemple montré qu'on peut retrouver des vestiges fossiles d'endiguement réalisés par le rongeur (Ukkonen 2001 : 19 ; Aalto et al., 1989 : 3-34 ; Aaris-Sorensen, 2009 : 12) ;
- l'étude des « processus de turbification induits » par le castor et son « travail » (Kraus et Wells, 1999 : 251-268 ; Wells et al., 2000 : 503-508) ;
- des indices et hypothèses proposés par divers auteurs (Rowley-Conwy, 1982 ; Coles et Orme, 1983 : 95-102 ; Zvelebil et Rowley-Conwy, 1985 : 104-128 ; Coles, 1992 : 93-99 ; Coles, 2006) sur son impact environnemental à la Préhistoire ou plus tôt encore ;
- des méthodes permettant de mieux repérer les effets anciens du castor sur les dépôts alluvionnaires, via des « marqueurs permettant de discriminer le rôle du castor des autres phénomènes, anthropiques et climatiques, qui ont influé sur les faciès d'écoulement et la morphologie des rivières quaternaires (notamment les cycles d'asséchement et de mise en eau des terrains ; la qualité et la quantité des dépôts sédimentaires caractérisant les occupations de castors »[44]. Pour limiter les risques d'interprétation archéologique erronée son travail de bioturbation et ses écofacts devraient être mieux pris en compte pour l'étude des sites archéologiques correspondant à d'anciennes zones humides. Son « influence post-sédimentaire » a par exemple été bien documentée sur des sites du Paléolithique supérieur en plaine inondable d'Allemagne du Nord, marqués par un vaste système de terriers et des activités qui ont modifié la sédimentologie locale à grande échelle[45].
De l'Antiquité à nos jours
modifierPlus que sa chasse ou sa chair, les auteurs anciens évoquent surtout la fourrure et le castoréum du Castor d'Europe, dont Pedacion Dioscoride Anazarbeen, Sextius, Pline l'Ancien, Guillaume Rondelet de Montpellier, Bauhin, Gesner & Jonston puis Johannes Marius(1746), Johannes Francus(1746) et Marc Antoine Eidous (1746) qui lui consacrent un traité entier de « castorologie » (castoroligia)[46], lequel évoque un traité précédent Castoreum physice & medice consideratum (castoroligia), écrit par Marius.
-
Représentation très imagée d'un Castor d'Europe se coupant les testicules (bestiaire d'Aberdeen, XIIe siècle)
-
La même légende, dans le bestiaire de Pierre de Beauvais[47]
-
Autre représentation d'un Castor d'Europe pratiquant l'autocastration (bestiaire de Salisbury (XIIIe siècle)
Le statut du Castor d'Europe a longtemps été particulier, considéré comme mi-poisson, mi-mammifère, constructeur et producteur d'un castoréum dont les fonctions étaient mal comprises, et sans testicules apparents, il a intrigué les chroniqueurs et naturalistes depuis l'Antiquité (Histoire naturelle de Pline l'Ancien[48]). Une légende tenace, datant au moins de l'Antiquité romaine et fréquemment reprise et illustrée au Moyen Âge (ex : dans le bestiaire de Pierre de Beauvais[49]) a contribué à entretenir la confusion entre testicules (internes et invisibles chez le castor) et glandes à castoréum recherchées depuis l'Antiquité pour les propriétés médicinales qu'on leur accordait. « Bibergeil » désigne encore en allemand le castoreum et signifie improprement « testicule de castor »[50]. Selon une traduction en français moderne[51], Pierre de Beauvais (qui a aussi décrit la chasse à la licorne) révise le mythe antique en lui donnant une valeur symbolique empreinte de catholicisme, décrivant le « bièvre » comme suit :
- « (…une bête très paisible. Ses testicules renferment un médicament qui se montre très efficace dans un grand nombre de maladies. Physiologue dit que la nature du castor est telle que lorsqu'un chasseur le poursuit, il regarde sans cesse derrière lui, quand il voit le chasseur s'approcher de lui, il se tranche les testicules de ses dents, et les jette au visage du chasseur. Le chasseur les recueille, arrête la poursuite et s'en retourne. […] De la même manière, l'homme qui veut observer les commandements de Dieu et vivre dans la pureté doit se trancher les testicules c'est-à-dire tous les vices, et jeter toutes les mauvaises actions au visage du chasseur, c'est-à-dire du Diable, qui perpétuellement le pourchasse ». D'autres ajoutent que s'il est à nouveau poursuivi, il s'allonge sur le dos pour montrer aux chasseurs qu'il n'a plus de testicules[43].
Bien que Pline l'Ancien ait précisé comme Dioscoride[52], chap 26 et que Sextius « écrivain très exact en matière médicale », ait clairement nié ce fait, ajoutant que « ces deux corps glanduleux sont très petits chez les bièvres, étroitement troussés, & même adhérents à l'épine ; & qu'il n'est pas possible de les ôter à cet animal, sans lui ôter la vie. Il observe qu'on sophistique le castoreum avec les rognons du bièvre ; que ces rognons sont d'un gros, & les testicules d'un fort petit ; qu'il ne faut point confondre le castroreum avec les vessies du castor ; car il en a deux ; phénomène unique dans tout le règne animal(…) ». Ce point de vue semble avoir été oublié au Moyen Âge et il faudra attendre les textes de naturalistes tels que Marius Francus (1746)[53] et Buffon pour clarifier ce point. (en 1717, le pharmacien du roi avoue s'être lui-même laissé tromper un certain temps sur la question[54]).
Période médiévale
modifierJusqu'au XIIIe siècle, malgré la chasse qu'on lui donnait, le bièvre était encore abondant presque partout en Europe du Nord et de l'Ouest et dans une grande partie du Nord et centre de l'Asie[27]. Il semble en Europe avoir d'abord disparu en Grèce (peut-être dès le Néolithique, probablement à la fin de l'âge du bronze[55]).
Il a ensuite fortement régressé en Italie (Buffon notait que les auteurs antiques n'en parlaient pas comme d'une espèce présente en Italie), hormis dans le bassin du fleuve Pô où sa présence est attestée jusqu'au XVIe siècle[56], les archéologues et paléontologues n'en ont retrouvé que des restes assez anciens (Pléistocène inférieur) selon RM Libois (1982)[57], les anciens Danois l'avaient probablement déjà éradiqué de leur péninsule à la fin du Néolithique. Au XVe siècle, il avait disparu des îles Britanniques (selon Dawkin, 1978).
En France, au XVIIIe siècle, il était encore dans certaines régions « ordinairement chassé » en hiver durant le gel (où sa fourrure est la plus épaisse) : certains chasseurs en détruisaient la hutte, le forçant à fuir pour que d'autres le tuent (à coup de hache, fourche ou bâton… et pour les plus riches au fusil[58]) quand il venait respirer dans des trous pratiqués dans la glace par eux, mais notent que « lorsqu'on les persécute long-temps, qu'on détruit les monumens de leur industrie, & qu'on détruit les forces à quitter le sol de la patrie qu'ils se sont formés ; leur société ne se rétablit point ; ils perdent leur instinct inventif & leur génie flétri par la crainte, n'ose plus s'épanouir ». En France où il est pourchassé, le Castor d'Europe a pris l'habitude de ne plus faire de barrage et de hutte et de se réfugier dans des terriers. Certains l'appellent même « castor-terrier » et l'Encyclopédie le décrit alors comme « solitaire et accoutumé à vivre dans des terriers ; aussi leur poil est rongé sur le dos par le frottement de la terre, & leur fourrure est moins estimée que celle des castors qui vivent en société »[13]. Dans les régions densément habitées et cultivées de France, ils ne sont plus signalés après les XIIe – XVe siècle, et leurs barrages, n'étant plus entretenus, rompent parfois : ainsi, l'on suppose que la rupture d'anciens dépôts sédimentaires meubles antérieurement retenus par les barrages des Castors d'Europe est à l'origine de la vidange des larges marais de Guyancourt[59] ayant provoqué, dans la nuit du 8 au 9 avril 1579, une brutale crue de la Bièvre, ultérieurement qualifiée de « déluge du faubourg Saint-Marcel », qui noie des dizaines d'habitants surpris dans leur sommeil, où l'eau monta de 4 à 5 mètres[60]. Au siècle suivant, ces marais ont été remplacés par les étangs de La Minière, créés par Colbert pour alimenter le parc de Versailles et réguler les crues de la rivière[61].
Différenciation entre le Castor d'Europe et le Castor du Canada
modifierCes deux taxons sont si semblables qu'ils ont longtemps été confondus en une seule espèce[62].
Si l'origine des castors remonte à 54 millions d'années, les espèces actuelles Castor fiber et Castor canadensis auraient divergé il y a environ 7,5 millions d'années, lors de la colonisation de l'Amérique du Nord par une population probablement restreinte originaire d'Eurasie[25].
Les analyses génétiques ont montré que leurs caryotypes diffèrent[63] : à la suite d'une fusion robertsonienne de huit paires de chromosomes chez le castor du Canada, le nombre de chromosomes serait passé de 48 (chez le Castor d'Europe)[64] à 40 (chez l'espèce moderne de Castor du Canada). Lahti et Helminen ont estimé en 1974[4] que cette différence pourrait expliquer l'apparente absence d'hybrides entre les deux espèces là où elles cohabitent, bien qu'elles soient très semblables physiquement et comportementalement.
Depuis les années 1990, une analyse génétique ou une simple électrophorèse capillaire peuvent mettre en évidence des allozymes propres à chaque espèce (Multilocus allozyme electrophoresis[65]) à partir d'échantillons prélevés sur des individus vivants ou morts.
La couleur et la viscosité des sécrétions varient un peu selon les individus, mais bien plus selon l'espèce ; assez pour avoir permis à vingt volontaires inexpérimentés de différencier sans erreur l'espèce à partir de quatre-vingts échantillons de sécrétions provenant de mâles et femelles des deux espèces[21].
Cette détermination est nécessaire à la conservation du Castor d'Europe là où il est en concurrence avec son cousin américain[65].
Génétique, phylogénie
modifierUne grande partie de la diversité du patrimoine génétique du castor eurasien est probablement définitivement perdue.
L'histoire génétique de cette espèce depuis la dernière glaciation est néanmoins de mieux en mieux comprise, grâce notamment à un groupe international de travail mis en place par Walter Durka pour une étude approfondie du Génome mitochondrial du Castor d'Europe collecté dans les zones où les derniers individus ont pu échapper aux chasseurs au XIXe et début du XXe siècle[66].
Selon les données phylogénétiques disponibles :
- le Castor d'Europe a une origine monophylogénétique très ancienne, partagée avec deux autres familles de rongeurs (Pedetidae et Dipodidae), et dans l'arbre du vivant, qui fait encore l'objet d'intenses recherches[67] ; il est sur le rameau des Dipodidae une branche-sœur du Siciste des bouleaux (Sicista betulina, un petit rongeur des marais et forêts de Sibérie), et selon les données disponibles il semble avoir colonisé l'Amérique du Nord durant le pliocène (Lavrov, 1983)[62] ; une population d'ancêtres de Castors d'Europe seraient donc les ancêtres du Castor du Canada.
Des analyses génétiques mitochondriales, le barcoding moléculaire et de nouveaux marqueurs microsatellites[68], métabarcoding, etc.)., éclairent peu à peu la phylogénie et la phylogéographie récente (depuis 10 000 ans) de l'espèce[35] et montre que plusieurs sous-espèces eurasiatiques[69] ne reposent plus en Europe sur une réalité génétique. Ceci est dû à la recomposition récente des populations à partir d'un faible nombre d'individus, et au mélange de gènes induit par les nombreuses réintroductions qui ont permis de sauver l'espèce, mais probablement pas les sous-espèces qui s'étaient constituées durant les millions d'années d'évolution de l'espèce[34] ;
- Malgré et/ou à cause de l'effondrement de la diversité génétique de l'espèce européenne dans les cinq à dix derniers siècles, plusieurs sous-populations présentent encore des différences physiques et génétiques[70]. Ces différences pourraient selon les cas résulter de pressions environnementales (climat, agents pathogènes différents selon les régions[71]) ou d'anomalies dues à la consanguinité[34].
- La génétique contemporaine des populations d'Europe centrale[72], asiatiques (Mongolie) et euro-orientales (Sibérie) est mieux comprise ; les analyses génétiques montrent que la diversité génétique de ces populations est également très faible. Ceci laisse penser (en 2005) que toutes ces populations, malgré leur éloignement et certains caractères propres (qui les avaient fait classer en sous-espèces) se sont également reconstituées à partir d'une source de population commune et assez récente[73].
- Il ne semble pas y avoir de croisements fertiles avec des castors américains là où ils coexistent avec des castors européens.
- Tous les castors eurasiens sont actuellement génétiquement très proches car descendant de quelques dizaines d'individus issus de trois petits noyaux de recolonisation ayant survécu au XIXe et début du XXe siècle[34] et chacun de ces noyaux était déjà génétiquement appauvri, probablement en raison d'une dérive génétique induite par un niveau de population trop bas[34].
« Il existe des preuves de dépression de consanguinité, et d'anomalies phénotypiques, au sein des populations de castor issues de reproducteurs non mélangés »[34].
Depuis les années 1970 environ, l'écologie moléculaire a permis de commencer à mieux cerner la diversité génétique la métapopulation eurasienne[63] et de différentes populations[74] et commencer à comprendre les relations entre sous-populations et entre ces populations et leur environnement. Ceci se fait avec difficulté pour le Castor d'Europe car ses populations récentes sont souvent relativement consanguines ou issues de quelques individus[74]. Pour cette raison des gènes tels que ceux du complexe majeur d'histocompatibilité (CMH), habituellement utilisés par les généticiens car parmi les plus polymorphes connus chez les vertébrés (et par ailleurs impliqués dans la réponse immunitaire) ne présentent plus qu'un très faible polymorphisme chez cette espèce[71]. Cette information peut néanmoins aider à entretenir ou restaurer une diversité génétique à l'occasion des translocations de réintroduction ou de confortement de sous-populations européennes.
Selon une étude ayant porté d'une part sur l'estimation des effets génétiques des nombreuses translocations à grande échelle effectuées durant environ 70 ans, et d'autre part sur les résultats de la conservation « passive » et à long terme des populations locales de cet animal, les translocations/réintroductions ont eu en Europe du Nord et en Russie des effets positifs pour l'espèce : Les comparaisons de populations autochtones et anciennes et de noyaux de populations réintroduites et de populations issues de croisements entre ces deux types de souches européennes, faites en Lituanie, ont conclu que l'état des sous-populations de castor tendait à s'améliorer, probablement en raison d'une plus grande diversité génétique due à ces croisements (meilleure résistance ou résilience face aux maladies et à la pression de prédation)[75]. La faible valeur sélective de certaines populations autochtones, notamment face au castor canadien là où il a été introduit, pourrait donc être due au goulot d'étranglement génétique qu'elles ont subi plutôt qu'être constitutionnelle. Les meilleurs taux de reproduction semblent ceux des familles composées de castors croisant des souches différentes[75].
Plus récemment (2017), des analyses microsatellites ont permis de comparer la diversité génétique des Castors européens de République Tchèque et de Lettonie (même zone géographique, touchée par un goulot d'étranglement mais où le castor est légalement chassable d'un côté de la frontière (Lettonie) et non de l'autre (bien qu'un projet de chasse légalisé soit étudié en République tchèque)[76]. Ce travail a confirmé que le Castor du Canada est resté isolé (pas d'hybridation). Il semble exister des sous-populations de castor européen génétiquement différentes en République tchèque, ce qui fait évoquer un impact négatif de la chasse contrôlée sur la diversité génétique de la population lettone de castors[76].
Alimentation
modifierElle a fait depuis les années 1930 au moins[77] l'objet de nombreuses études, dans le cadre notamment de la préparation ou de l'évaluation des opérations de réintroduction ou de protection[78]. Même s'il optimise ses choix en fonction des défenses biochimiques naturelles des arbres[79],[80], et des ressources locales notamment en été quand la biomasse fraîche est la plus abondante[81], le castor européen se montre très sélectif dans ses choix alimentaires, y compris quand il vient d'être introduit dans un milieu où il a un large choix au sein de ses espèces alimentaires préférées. Par exemple dans un lac de 15 ha bordé de 5 ha de sylvicultures[82] où ont été réintroduits en 2005 6 castors originaires d'Allemagne, on a étudié les choix d'espèces et de classes d'âge et de diamètres d'arbres les plus souvent choisis par les castors afin de déterminer si ces choix reflétaient la disponibilité locale des ressources. Les résultats ont confirmé que les castors réintroduits étaient très sélectifs quant à l'essence et au diamètre des arbres choisis, et ces choix ne reflétaient pas la biodisponibilité des bois : ils ont choisi des classes de taille similaires parmi quelques espèces préférées, et n'ont pas dans ce cas utilisé de « bois » de sylviculture[83].
Bien connaître ces préférences peut aider à protéger les arbres que des propriétaires riverains souhaitent conserver (par un grillage par exemple).
Le castor est réputé exclusivement végétarien mais comme les grands herbivores, il ingère probablement quelques œufs et larves de vertébrés et quelques invertébrés (larves présentes sous les écorces ou dans la végétation aquatique…). Un castor adulte ingère environ 2 kg de matière végétale (ou en hiver 700 g d'écorce) par jour[1]. Il se nourrit essentiellement des tiges et branches de 3 à 8 cm de diamètre[1] et principalement dans la strate basse de la ripisylve où, après quelques années, il entretient souvent une zone plus buissonnante qui offre moins de prise au vent que les grands arbres et permet un ensoleillement plus important du milieu aquatique.
Outre les écorces et plants ligneux qui constituent l'essentiel de son alimentation hivernale, il adapte[84] sa consommation aux ressources locales et saisonnières en feuilles et tiges de ligneuses et de plantes aquatiques (hydrophytes ou hélophytes…), y ajoutant des fruits, des tubercules ou des végétaux qu'il collecte jusqu'à une trentaine de mètres de l'eau (exceptionnellement jusqu'à 50 m). Les « coupes sauvages » réalisées par l'animal, loin de dégrader le milieu naturel, favorisent les éclaircies et la multiplication végétative par rejets ou drageons[85].
Les provisions faites sous l'eau et les écorces de branches, tiges et troncs de ligneux constituent l'essentiel de son alimentation hivernale ; il peut consommer toutes les essences européennes mais il montre une nette préférence pour les salicacées (Saules, Salix spp. et Peupliers, Populus spp.) sans dédaigner le Cornouiller sanguin (Cornus sanguinea), le Noisetier (Corylus avellana), l'Orme champêtre (Ulmus campestris) quand ils sont présents sur son territoire, ou - mais plus rarement - l´Aulne glutineux (Alnus glutinosa) ou encore certains fruitiers qui auraient été plantés non loin de l'eau (pommiers, poiriers).
Du printemps à l'automne, il consomme de nombreuses herbacées et apprécie notamment l'Armoise (Artemisia vulgaris) et la reine-des-prés.
Les saules et peupliers[1] ont coévolué avec lui depuis plusieurs millions d'années et ont acquis une capacité de recépage telle que là où elles poussent naturellement, elles sont difficilement surexploitables par les castors[86], comme toutes les espèces des ripisylves de l'hémisphère nord (ce qui n'est pas le cas dans l'hémisphère sud où aucun animal ne se nourrit à la manière du castor en étant capable de couper des tiges et troncs). En coupant les tiges et arbres de la berge et du proche lit majeur pour en faire des barrages ou se nourrir, le castor modifie le cycle de l'eau du bassin versant en favorisant près de l'eau les saules et peupliers[87]. Sinon, il se rabat sur des buissons tels que cornouiller sanguin, noisetier, l'orme champêtre et dans une moindre mesure l'aulne glutineux.
Digestion
modifierIl digère partiellement (à 30 % environ) la cellulose dans son intestin postérieur, dans le « cæcum élargi » où vit une population microbienne symbiotique adaptée[88]). La quantité d'énergie qu'il tire des écorces qu'il mange varie selon leur digestibilité et le temps de digestion/rétention dans l'intestin[89] (qui varie chez les herbivores de quelques heures à plusieurs jours[89]).
Comme de nombreux rongeurs dont le castor nord-américain il est cæcotrophe, c'est-à-dire qu'il réingère ses matières fécales molles (émises dans la hutte ou le terrier[90], les fèces secondaires étant émises dans l'eau). Quand il est placé dans une cage dont le fond est grillagé, il récupère ses « fèces molles » dans sa queue afin de pouvoir les réingérer, mais laisse tomber les fèces secondaires (sèches)[89].
Habitat
modifierCette espèce a un rapport particulier à son environnement, puisque capable de le créer et améliorer son habitat. Pour s'établir durablement, cet animal semi-aquatique, a besoin d'eau permanente (60 cm de haut au minimum). Si le niveau de l'eau descend en été, il construit une digue pour l'élever de manière que l'entrée de son gîte soit toujours immergée et invisible. Il a besoin de branches qu'il se procure sur les arbres et buissons rivulaires (saules, aulnes, ormes, peupliers…) des cours d'eau, lacs étangs ou zones humides boisées.
Dans les cours d'eau et certains étangs (de la basse montagne aux approches des zones saumâtres près des littoraux) il peut soit construire une hutte, ainsi qu'un barrage si le niveau de l'eau est très bas, soit (en zone non rocheuse) creuser un terrier. Il doit disposer d'assez de bois sur les berges et à leurs abords (de 2 à 15 m environ). Il peut coloniser de petits cours d'eau voire des fossés de drainage où il peut éventuellement faire monter le niveau de l'eau grâce à un barrage[92]. Plus rarement il s'installe dans une cavité karstique (voire dans une ruine de moulin)[1] et l'ONCFS signale des populations vivant à 600 m d'altitude dans le Gard, à au moins 1 000 m en Haute-Ardèche[93] et un couple qui vivait à 2 000 m d'altitude dans les alpes vaudoises[94].
Indices de présence et monitoring de l'espèce
modifierQuand il n'a pas besoin de construire de barrage, le castor peut être très discret. Il est souvent d'abord repéré par des indices de présence[95] pouvant si nécessaire être confirmée par imagerie nocturne (appareil photo ou caméra infra-rouge ou à amplification lumineuse, associée à un détecteur de présence) :
- bois coupé sur pied, rognures éparpillées au sol avec marques caractéristiques de dents ;
- bois coupé flottant ;
- écorçage sur pied ou sur bois coupé et/ou sur racine ;
- réfectoires ;
- coulées, accès de berges avec traces de pattes ;
- gîte principal ou secondaire ;
- barrage et huttes (plus rares en Europe qu'en Amérique du Nord) ;
- traces monticules de marquage de territoire (plus discret) ;
- signalement d'un cadavre (exemple : 72 cas de mortalité signalés à l'ONCFS en France en 2012, 65 en 2011, 49 en 2010, 34 en 2009, principalement dans les Alpes et le nord-est du pays, avec pour 2012 : 47 % de mort par collision routière, 32 % de cause indéterminée et « 7 cas de noyade, 1 collision avec un bateau, 2 cas de braconnage, 2 cas d'erreur de tir, 2 cas d'empoisonnement et 1 cas de mortalité par des chiens »)[95] ou de dégâts (exemple : 13 signalements en 2012 en France, concentrés dans 4 départements[96].
Divers moyens de suivi télémétriques ont été utilisés pour suivre des individus ou petits groupes de castors, mais c'est un animal qui se débarrasse facilement des émetteurs externes qui doivent en outre résister à son mode de vie semi-aquatique et fouisseur[97]. Des transpondeurs internes (chirurgicalement implantés) ont été utilisés[98],[99].
Comportement
modifierSon comportement social et de constructeur fascine l'homme au moins depuis l'Antiquité. Le castor a souvent été présenté comme un modèle du travailleur consciencieux, infatigable et prévoyant, voire d'intelligence sociale et d'ingéniosité. La part de l'autonomie, du social et de l'instinct (déterminisme) a été longtemps discutée et a donné lieu à de nombreux textes et interprétations[100], aboutissant peu à peu à une vision plus rationnelle (activité de construction motivée par l'horloge interne et divers stimuli, avec selon Richard PB (1964) quelques schèmes-moteurs très simples[101], puis plus écosystémique avec la considération de son rôle d'espèce-« clé », « ingénieur » et « facilitatrice » dans l'écosystème et sur le long terme.
Animal semi-aquatique
modifierInféodé aux zones humides, il passe les deux tiers de son temps dans l'eau, avec des apnées de 4 à 6 minutes, et exceptionnellement (jusqu'à 15 minutes[réf. nécessaire]). Comme de nombreux animaux nocturnes, il est surtout actif en début et en fin de nuit. Quand il est sur terre, il passe la majeure partie de son temps à moins de 6 m de l'eau où il se réfugie s'il se sent menacé[86].
Plongées
modifierGraf et ses collègues ont utilisé des accéléromètres et des capteurs de profondeur pour étudier son comportement en plongée (pour 12 castors eurasiens de Norvège, de 2009 à 2011) ; Les plongées étaient généralement courtes (<30 s) et peu profondes (<1 m) et donc probablement le plus souvent « aérobies ». Lors de la descente, l'accélération moyenne vectorielle dynamique du corps (indice de puissance du mouvement) était plus élevée près de la surface, et de manière inattendue cet indice était plus élevé à la remontée (phénomène encore à expliquer). Comme d'autres homéothermes, la durée de plongée tend à augmenter avec la profondeur. La température de l'eau n'a pas affecté le comportement de plongée. Ses capacités (profondeur, durée) sont donc semblables à celles d'autres animaux plongeurs d'eau douce semi-aquatiques, mais s'ils ne sont pas dérangés ils plongent peu (seulement 2,8 % de leur temps d'activité, probablement parce que l'essentiel de leur nourriture est trouvée sur terre)[102].
Comportement territorial
modifierMonogame, grégaire et sociable, le castor marque et défend son territoire[103] ; 75 % des castors vivent en groupes familiaux composés de 2 adultes, des jeunes de plus d'un an et des jeunes de l'année. Une famille rassemble de 2 à 6 castors (3,8 en moyenne en Europe). 25 à 30 % environ des castors vivent solitairement, avec des comportements plus explorateurs. Chaque communauté familiale (2 parents, les jeunes de l'année et les jeunes de l'année précédente, soit 4 à 6 castors par territoire) défendent 1 à 3 kilomètres de cours d'eau[1] (moins dans les milieux très bioproductifs et plus dans les milieux pauvres).
Territorialité
modifierDans un environnement sauvage, libre et leur convenant, des castors relâchés recolonisent le milieu selon un modèle dit de « répartition despotique idéale » (c'est-à-dire que les premiers arrivants s'installent dans les habitats leur convenant le mieux en qualité et en taille[104] ; les suivants colonisent des habitats plus pauvres. Quand ces milieux sont utilisés - les nouveaux individus sont des vagabonds qui doivent attendre qu'une place se libère, chercher un nouveau territoire (autre bassin versant, lac, etc.) et qui souvent ont plus de chance de mourir tôt. Ce type de colonisation est lié à un comportement territorial marqué, qui auto-limite la densité en castors d'un territoire[86]. Les premiers occupants forment des territoires dont la surface varie en « fonction de la saison (petits territoires en hiver, grands territoires au printemps et en été), ce qui correspond bien à la « théorie de la taille optimale des territoires », mais ce pattern ne s'est pas répété chez les colonisateurs plus tardifs »[86] ; ils défendent aussi un territoire plus grand. En été, ils peuvent patrouiller sur de très grandes distances (effectuent jusqu'à 20,0 km par nuit, aller-retour) alors que les territoires d'hiver mesuraient « (7,9 ± 0,9 (erreur standard) km, dont 3,0 ± 0,4 km de berges boisées) » (au-delà les « patrouilleurs » dépenseraient trop d'énergie pour rester en bonne santé). Nolet (1994) observe que toutes les berges ou section de cours d'eau ne sont pas transformées en territoire ; chaque territoire reste séparé d'éventuels territoires amont et aval par une zone tampon (plus petite que les territoires eux-mêmes). Au total, environ la moitié du territoire potentiel est réellement occupé. Selon plusieurs auteurs[104] dont Nolet, « des facteurs sociaux et thermorégulateurs semblent jouer un rôle important dans la détermination des coûts associés à la défense territoriale, et donc à la taille des territoires ».
Olfaction
modifierL'odorat du castor est développé. Il est mobilisé pour le choix de la nourriture[105] et la détection de certains prédateurs[106] et surtout pour le marquage du territoire par des sécrétions du castoréum et des glandes anales qui sont principalement placées sur des « monticules » de terre[107] ou de boue éventuellement mélangée de feuilles réalisés sur la berge (à moins de 50 cm de l'eau) ; plus le linéaire de berge d'un territoire est long, et plus il y a d'autres colonies ou individus à proximité, plus ces monticules sont nombreux[108], indépendamment de l'âge et du nombre des castors ou de la saison[108] ; sur 286 monticules de marquage odorant suivis dans le Biesbosch, 97,2 % étaient construits par les castors et seulement 2,8 % étaient un marquage déposé sur une roche, une touffe d'herbe ou directement sur le sol[108]. Remarque : Selon Jean-Pierre Quéré et Henri Le Louarn, le Castor du Canada marque aussi son territoire avec de la boue prélevée dans les cours d'eau, ce que ne ferait pas le Castor d'Europe[109].
Chaque castor discrimine olfactivement les odeurs de sa famille ou laissés par des mâles et femelles[110],[111], dominant ou dominé susceptibles d'entrer sur son territoire[112].La signature olfactive produite par les glandes anales d'un castor révèle à ses congénères des informations faisant ou non de lui un concurrent dangereux ou menaçant pour une famille établie.
L'effet desperado est le nom d'une hypothèse voulant qu'un individu chassé de son territoire devienne un adversaire agressif car il a peu à perdre dans les rencontres agonistes[112]). Cet effet a été recherché chez le Castor, via analyse chimique (par chromatographie en phase gazeuse) d'odeurs individuelles de castors d'âges et de statuts sociaux différents, ainsi que par l'étude des réponses interindividuelles à ces odeurs. Les résultats ont confirmé un lien entre cette odeur et la réaction comportementale, et ils montrent que l'âge, l'appartenance à une famille et le statut social sont bien codés dans l'odeur de chaque castor[112].
Une autre étude (finlandaise) a montré que le castor semble moins gêné en été par l'odeur de l'homme ou du chien, mais qu'il craint celles du renard roux, de la loutre, du Lynx, du loup et de l'ours brun, qui induisent une moindre recherche de nourriture. Les odeurs de loutre, de renard roux, de lynx, de loup et d'ours brun ont des effets plus marqués en été, alors qu'en automne le castor réagit plus nettement (toujours en diminuant la recherche de nourriture) à celle de la loutre ainsi qu'à celle du lynx, de l'homme et du renard roux. Les odeurs de prédateurs sympatriques et n'ayant pas disparu du territoire du castor semblent les plus efficaces (loutre par exemple). Les auteurs signalent que les castors ont prélevé plus de branches expérimentalement imprégnées d'odeur de prédateur en automne qu'en été. Il a été suggéré que des odeurs pourraient être utilisées pour la gestion ou le contrôle de certaines activités et de la localisation des castors dans les zones où des conflits homme-castor risquent de se produire[113].
Le gîte
modifierLe gîte peut être un terrier dans la berge, une « hutte de berge » (quand la berge est trop rocheuse pour être creusée), une « hutte en île » ou encore une « hutte-terrier » (quand le plafond d'un terrier s'est effondré, mettant le gîte à jour ; ce dernier est alors réparé par des branchages formant une hutte) pour s'abriter le jour et mettre bas[85]. L'entrée en est toujours située sous l'eau, ce qui est considéré comme une stratégie défensive[114]. Rarement, le gîte est une cavité naturelle (dans les régions karstiques comme dans les gorges du Gardon) ou artificielle (ruine de moulin)[1].
Un gîte déserté par le castor peut être réutilisé par d'autres espèces : la Martre des pins (Martes martes)[115], le rat musqué, le campagnol, le vison, la loutre (Lutra spp. et Lontra canadensis)[116], ou encore le blaireau européen (Meles meles) et le renard roux qui hibernent parfois dans les terriers abandonnés[117].
Au Canada, des lynx (Lynx rufus) ont aussi été observés utilisant un gîte abandonné de castor pour mettre bas et y élever leurs petits[118], ce qui laisse supposer qu'un tel comportement est également possible en Europe.
Construction
modifierSon comportement le plus connu et spectaculaire est — dans certaines circonstances — la construction de barrages et retenues d'eau, rendu possible par une capacité à rapidement ronger des branches et des troncs d'arbres, grâce à des incisives très aiguisées et consolidées par un émail de couleur orangée. Le castor abat en général plusieurs arbres dans un même secteur, produisant une zone de coupe dite « atelier ». Si cette zone de coupe est éloignée de la hutte ou du barrage en construction, il creuse de petits canaux (jusqu'à 1,5 mètre de large et 1 m de profondeur) reliant les différentes zones et permettant la traction sur l'eau de bois pesants.
Si le niveau d'eau baisse il peut en quelques jours construire un barrage faisant en quelque sorte « barrage à la sécheresse »[119].
Reproduction
modifierLe castor est monogame. La femelle met bas dans son terrier ou sa hutte, et allaite ses petits grâce à 4 mamelles (qui ne sont visibles que durant la fin de grossesse et la période de lactation). L'olfaction semble jouer un rôle important dans le comportement de reproduction et dans la structuration du groupe familial.
C'est une espèce considérée comme à stratégie K, c'est-à-dire qui fait peu de petits mais s'en occupe et qui peut littéralement créer et entretenir un environnement favorable pour sa famille ; il est moins prolifique que les autres rongeurs aquatiques de l'hémisphère nord (qui sont plutôt à stratégie r)[120].
En moyenne, le Castor d'Europe fait moins de jeunes par portée que le Castor du Canada. Le succès de reproduction (et donc de colonisation) est aussi dans une certaine mesure « densité-dépendante » ; dans une population trop petite, le taux de mortalité, de grossesse et la taille des portées diminuent, et la maturité sexuelle est retardée[121],[122].
Dynamiques de populations
modifierCette dynamique semble répondre à la fois aux caractéristiques générales des dynamiques démographiques d'« espèces-ingénieur » marquées selon les cas par une stabilité démographique ou par des cycles endogènes de diminution/extension de populations[123], et à certaines caractéristiques écopaysagères.
Cette dynamique varie beaucoup selon les sous-populations et selon les contextes ; au moins en partie à cause de l'appauvrissement génétique subi par le castor européen (par rapport au castor américain)[75].
Quand des castors sont réintroduits dans un petit bassin versant, la recolonisation se fait plus vite que quand ils sont relâchés dans un grand fleuve ; dans ce dernier cas, on observe souvent un plateau démographique assez stable de 20 à 30 ans avant une progression démographique qui correspond à la colonisation des habitats rivulaires leur convenant. Certains auteurs estiment que cela pourrait être dû à une difficulté plus grande de se rencontrer pour des mâles et femelles qui se seraient répartis dans des espaces plus vastes[124],[125],[121]. L'aire colonisée par une population introduite augmente plus vite que l'accroissement démographique, car les jeunes castors peuvent parcourir une grande distance pour s'installer dans les milieux qui leur conviennent le mieux, et ce sont les générations suivantes qui coloniseront les espaces intermédiaires. Son instinct le pousse à ne pas s'éloigner de plus de quelques dizaines de mètres d'un cours d'eau ; ceci ferait que plus une ligne de crête entre deux bassins est marquée, plus il mettra de temps à la franchir[126].
Dans tous les cas, après une phase de croissance démographique, la population se stabilise. À ce stade, quelques individus cherchent à occuper les milieux moins favorables.
Dans un milieu naturel non contraint par des problèmes de chasse, occupation du sol par l'Homme, pollution, roadkill, etc, cette dynamique est régulée selon un modèle source-puits[127] dépendant de la disponibilité en ressources (territoire, qualité de l'alimentation…) et de la pression de prédation naturelle.
L'évaluation du nombre de colonies et du nombre d'individus par colonie est une opération qui reste difficile car pour évaluer la dynamique d'une population sauvage vivant dans les grands pays où existent encore de vastes zones de nature préservée (zones subpolaires de toundra) et dans des régions peu peuplées (Finlande par exemple), il est assez facile de compter les barrages et les huttes (mais les castors n'en font pas toujours), et le castor étant parfois discret durant la journée, il est parfois difficile d'évaluer le taux de huttes réellement occupées ou le total de castors présents dans ces huttes.
- Ainsi en Finlande, pour disposer de statistiques permettant de réorienter ou moduler les stratégies de conservation du castor, il a été proposé dans les années 1990 de demander à des groupes volontaires de chasseurs d'élan d'un même canton[128] d'évaluer le nombre de castors vivant dans les huttes présentes sur leur zone de chasse à l'élan. Ces résultats ont été comparés avec ceux d'un suivi scientifique fait sur l'ensemble du même canton ; il s'est avéré que de nombreuses huttes ont été construites par des castors hors des zones de chasse à l'élan, voire en pleine zone agricole[129]. Dans ce cas sur 40 % des huttes seulement étaient occupées. 69 % ont été trouvés sur les unités chasse à l'élan mais 31 % de ces huttes étaient hors des zones de chasse (dont 21 % de ce sous-ensemble en forêt et 68 % dans les paysages cultivés et 11 % en zones urbaines)[129]. Bien qu'une grande partie de ces chasseurs habitent dans le canton où ils chassent (sur des zones de 9 à 24 km2 environ), ils ont dans ce cas fortement sous-estimé le nombre de huttes occupées (ils en ont trouvé moitié moins que l'équipe de biologistes), ils ont jugé 8 huttes occupées alors qu'elles ne l'étaient pas d'après le recensement fait par les méthodes scientifiques habituelles, et seuls 2 groupes de chasseurs sur 12 ont rapporté avoir cette saison là couvert la totalité de leur territoire de chasse. L'erreur d'appréciation était importante des échelles locales à celle du canton[129].
La densité des colonies était similaire dans et hors des parcelles de chasse à l'élan. 49 % des 62 colonies actives de ce district étaient situés sur des cours d'eau de moins de 5 m de large, 10 % sur les rivières de plus de 5 m de large et 38 % sur des lacs ou de petits lacs[129]. 3 % étaient établies sur des fossés ou ruisseaux[129]. Une des conclusions de cette étude est que des moyens propres sont nécessaires à l'évaluation des dynamiques de population de castors, et plus encore concernant leur diversité génétique ou le sex-ratio.
- Le nombre d'individus d'une colonie peut changer au moment du départ des jeunes puis peu après avec les naissances. Les chiffres donnés par les évaluations varient légèrement selon que le comptage est fait au crépuscule ou à l'aube (variations non significatives), et un peu plus entre les mois d'août et de septembre. Tous les membres d'une colonie sont rarement vus ensemble au cours d'une même observation au crépuscule ou à l'aube. Ces ajustements font par exemple passer le nombre moyen d'individus par colonie de 2,4 à 3,8, avec dans ce cas 54 % d'adultes, 26 % et 19 % de jeunes et jeunes de l'année (ces derniers étant les plus sous-estimés par les comptages visuels classiques). Les chiffres de taille des colonies (et de leur composition) doivent donc être considérés avec prudence quand ils ne sont pas obtenus via des méthodes scientifiquement éprouvées pour leur précision et exactitude[130].
- Des techniques modernes de radiopistage ou de photographie automatique nocturne permettent de mieux suivre les espèces animales.
Dispersion de jeunes explorateurs et fondateurs
modifierSelon une étude radio-télémétrique de neuf jeunes castors quittant leur famille dans une zone de population en restauration, dans de bonnes conditions, l'âge de dispersion et de parturition montre une plasticité permettant une colonisation plus rapide que ne le prévoyaient les premiers modèles autour des noyaux de recolonisation par des castors[131] ; l'âge de dispersion était réputé être d'environ 2 ans, mais, chez cette population, « l'âge de la dispersion était réparti uniformément entre 11 et 23 mois » et dans ce cas, une des femelles a mis bas à 2 ans[131] et « des déplacements exploratoires hors du territoire natal avant l'époque de la dispersion ont été observés chez trois individus »[131].
Dans les zones d'expansion de populations, il est utile de comprendre les « patrons de sélection d'habitat des castors ». Les colonisateurs sélectionnent le territoire qu'ils vont occuper (et qu'ils vont - si cela est nécessaire - aménager et remodeler par des barrages et des mini-canaux).
L'emplacement et la taille de ce territoire semblent déterminés par les ressources qu'ils offrent. Selon les études disponibles[103], le castor adapte dans une certaine mesure ses besoins au contexte bioclimatique et aux ressources disponibles. La présence de buissons et/ou de bois dur (de forêt de feuillus plutôt que de résineux) sur la berge, ainsi que la vitesse/débit du cours d'eau sont deux critères apparemment majeurs pour cet animal, qui préfère aussi des rivières peu larges avec une certaine profondeur d'eau en pied de berges, des substrats vaseux et la présence de sol (et non de roche) sur la rive. Les modèles disponibles, plutôt produits en Europe du Nord, se montrent robustes (« prédictifs » à 85 %) et selon leurs auteurs applicables à d'autres régions aux caractéristiques fluviales et végétales semblables[103].
Compétition avec d'autres espèces
modifierSelon les observations faites en Nouvelle-Écosse vers 1930, face au rat musqué, les castors, plus lourds et forts que lui semblent en limiter les populations tout en cohabitant, les deux espèces étant conjointement présentes depuis des millions d'années en Amérique du Nord[132],[133].
Compétition avec le Castor du Canada
modifierEn zone nordique froide, le Castor d'Europe, bien qu'un peu plus gros que son cousin américain, serait selon Danilov (1995) moins compétitif, moins actif et moins capable d'adaptation que lui en zone froide : ses barrages y seraient moins hauts, moins larges et son succès de reproduction serait moins bon[134], ce qui expliquerait des difficultés à défendre son territoire face au Castor du Canada, en Finlande surtout[4] où les deux espèces coexistent à la suite de réintroductions (19 castors d'Europe réintroduits en 1935 à partir de la Norvège[135]) et au moins sept introductions de Castors du Canada importés des États-Unis en 1937[4] ; le Castor d'Europe y a effectivement régressé ou disparu de certaines régions où l'espèce américaine a été introduite un peu après lui[136] ,[137].
Cependant selon des études russes[réf. nécessaire], cette différence pourrait être expliquée par le fait que le Castor d'Europe a, lors de sa quasi-extinction, perdu une grande partie de son patrimoine génétique (bien plus que son cousin américain). D'ailleurs, par endroits en Finlande, le Castor d'Europe n'a pas été éliminé par le Castor du Canada, mais il lui a cédé son territoire pour en occuper d'autres[4],[138].
En Finlande, ces introductions volontaires ou involontaires de castors américains ont été faites par des éleveurs de fourrure, chasseurs ou propriétaires. On en a fait aussi en Pologne[4],[138] où en 1937 une réserve naturelle (Réserve de Rybaki) était déjà entièrement consacrée au Castor, et où certains naturalistes comme R. Kuntze ont reproché aux autorités de n'avoir pas choisi la sous-espèce originelle qui était Castor fiber vistulanus et non Castor fiber fiber importé d'Allemagne et de Norvège[139]. Le castor a aussi été réintroduit en Carélie russe où une population s'est sédentarisée dans les années 1950[140],[134],[141] et en Russie[142], et plus modestement en France le long de la Seine[143], de même qu'en Hongrie[144] et Autriche[145]. Cependant la plupart de ces castors nord-américains introduits semblent aujourd'hui avoir disparu en Autriche[146], Hongrie, Pologne et France (Bozsér, 2001b; Halley & Rosell, 2002)[62].
Relations intra-spécifique
modifierLe Castor d'Europe forme des groupes sociaux familiaux défendant chacun leur territoire contre d'autres individus de la même espèce[103]. Le territoire est marqué par des « monticules » imprégnés d'urine et de sécrétions issues du castoréum et des glandes anales (provenant de poches internes), déposés sur des « monticules à odeur » disposés le long des berges de leur territoire[113]. Des réactions différentes aux odeurs chez le mâle et la femelle font partie du dimorphisme sexuel qui n'est pas visible chez le castor[19].
Un monticule n'est considéré par un castor intrus que s'il est marqué par du castoréum (une expérience ayant porté sur 20 familles de castor a montré que 85 % de ces familles ont changé de comportement quand elles ont été mises en présence sur leur territoire de nouveaux monticules marqués de castoréum de mâles adultes étrangers, alors qu'aucune réaction n'est observé face au même monticule quand il n'est pas marqué par du castoréum, lequel aurait donc une fonction de marquage spatial et du statut de dominance tout en permettant à des « intrus » d'évaluer le propriétaire du territoire, en diminuant pour les deux partis le risques de conflits agonistiques[113]. La simple vue d'un monticule non marqué n'ayant pas d'effet, le monticule pourrait n'avoir qu'une fonction de diffuseur d'odeur et non de marquage visuel du territoire[113].
Réintroductions et confortement de populations
modifierPlusieurs guides et chartes ont été écrits pour cadrer la réintroduction de ce Castor[147],[93]. Selon les « lignes directrices pour les réintroductions » émises par l'Union internationale pour la conservation de la nature (UICN), « la population d'origine devrait idéalement être étroitement liée génétiquement au stock natif original »[148], mais l'espèce ayant disparu il y a quelques décennies de presque toute son aire naturelle de répartition, et les premières vagues de restauration ayant homogénéisé certaines populations[149], cela est devenu impossible ou incertain à échelle locale.
La génétique distingue toutefois encore deux populations (occidentale et orientale) où il est possible de « prélever » des individus susceptibles de former ou conforter des noyaux de recolonisation, jugés plus « biologiquement pertinents » possibles, dans les zones respectivement occidentales et orientales de l'Europe, là où les castors ont disparu, ou là où ils sont trop peu nombreux pour assurer une diversité génétique suffisante.
Pour cette raison, et pour des raisons d'éthique environnementale notamment liées au bien-être animal, il a été proposé en Grande-Bretagne, parmi 3 stratégies possibles de choix de souches à réintroduire de « faire une exception éclairée aux directives de l'UICN et de réintroduire un mélange de castors de l'Est et de l'Ouest » (les 2 autres possibilités étant dans ce cas de réintroduire à partir d'un même noyau occidental ou d'un mélange d'individus provenant de plusieurs noyaux occidentaux[34]).
Les conditions de succès des réintroductions ou des confortements des populations, ainsi que la reproduction ont été bien étudiées par divers chercheurs.
Elles varient selon la vigueur de la souche réintroduite (les sujets jeunes et en bonne santé sont recommandés), mais aussi selon le contexte écopaysager. Les critères suivants sont les plus souvent cités :
- la disponibilité du milieu en saules et un courant pas trop élevé : ex. : à partir du suivi annuel d'une population reconstituée à partir de la réintroduction en 1999, de 18 castors d'Europe dans le Jutland du Nord, Sørensen a estimé que dans ce contexte ces 2 facteurs étaient ceux qui affectaient (positivement) le plus le succès de reproduction[150]
- taille minimale du groupe à réintroduire (l'ONCFS recommande au moins 3 familles (soit jusqu'à 18 individus) ;
- un lâcher fait de manière que ces familles puissent fonder un territoire distant de quelques km l'un de l'autre (1 colonie par 20 ha de plan d'eau, tous les 2 km au maximum est préconisée pour C canadensis[151]) ;
- diversité génétique (éviter notamment la consanguinité ; le choix des provenances et de la génétique des castors à libérer est encore discuté ;
- une taille et une connectivité écologique suffisante des habitats choisis ;
- une gestion différenciée des populations de castor (autochtone) d'une part et de rat musqué et ragondin (exotiques envahissants) mais qui vivent en partie dans les mêmes milieux[152] ;
- une sensibilisation des populations et acteurs locaux ;
- capacité de prévention/réparation d'éventuels dégâts (dans les régions agricoles et habitées) car les castors apprécient les fruitiers (pommiers notamment qui représentent 1/4 des dégâts déclarés en 1991 à l'ONCFS devant les pêchers (17,9 %)[153],[154]. Selon l'ONCFS les dégâts signalés concernent plus souvent des petits canaux de drainage ou bordés d'un chemin[153]. En présence d'arbres à protéger « la protection mécanique des arbres et cultures est la plus efficace. Il s'agit de poser des manchons de protection individuelle, des palissades adaptées au Castor voire des clôtures électriques, selon les caractéristiques des cultures à protéger. Dans certains cas, la pose de systèmes empêchant l'accès du Castor à certains ruisseaux, voire le déplacement d'individus, peuvent s'avérer nécessaires »[155].
Capacités de colonisation
modifierLe Castor d'Europe montre des capacités très variables de résilience démographique et de colonisation (selon les souches, régions et pays, avec des taux annuels d'accroissement de population variant de presque 0 % (Pays-Bas) pour atteindre 34 % par an sur plus de 6 ans dans la vallée de la Peene en Allemagne.
Quelques individus ont en Biélorussie colonisé les fossés de drainage abandonnés à la suite des retombées de l'accident de Tchernobyl, en dépit du retour conjoint du loup, du lynx et de quelques ours bruns[156]. L'AIEA a cependant montré en Suède dès 1986, juste après la catastrophe de Tchernobyl que par rapport à d'autres herbivores ou rongeurs, il pouvait être significativement plus contaminé par le Césium de Tchernobyl (de 143 à 916 bq/kg humide pour le 137Cs)[157]. Quand environ 50 % de l'habitat total potentiel du linéaire de berges théoriquement colonisables d'un bassin versant est occupé, la population se stabilise (car les castors maintiennent toujours une petite zone tampon entre chaque territoire « familial »). Le niveau de 15 ± 20 % caractérisant le castor européen selon la littérature, le rendrait moins « compétitif » que l'américain. Une partie de ces variations pourrait être expliquée par l'appauvrissement génétique de la métapopulation de Castors d'Europe.
Quelques expériences faites sur d'autres espèces ont un temps laissé penser qu'un protocole de réintroduction basé sur une libération des animaux après un temps d'adaptation en enclos pourrait améliorer les chances de survie à long terme (notamment dans un environnement riche en prédateurs), mais une étude récente (2006) ne confirme pas cette hypothèse[158]. La bonne recolonisation de bassins versants par des animaux échappés de parcs ou réintroduits sans séquence d'adaptation au nouvel environnement montre que le castor a de bonnes capacités de colonisation quand le milieu lui convient.
Les retours d'expérience de centaines de cas de réintroduction montrent qu'il recolonise assez facilement un sous-bassin versant puis un bassin versant (hormis en présence de grands barrages hydroélectriques ou de lacs-réservoirs créés par l'homme). Mais il lui est souvent plus difficile de passer d'un bassin versant à l'autre (dans certaines régions il a cependant pu utiliser des canaux pour réussir ce passage. Son instinct le pousse à ne pas s'éloigner de plus de quelques dizaines de mètres d'un cours d'eau ; ceci ferait que plus une ligne de crête entre deux bassins est marquée, plus il mettra du temps à la franchir[126].
Prédation sur le castor
modifierEn Europe, depuis des centaines de milliers d'années, et jusqu'au haut Moyen Âge, le castor a eu de nombreux prédateurs sauvages. Les plus dangereux ont disparu de la Préhistoire à l'Antiquité (tigre à dents de sabre, hyène européenne, lion des cavernes, ours des cavernes…), ou ils ont ensuite beaucoup régressé de l'Antiquité à nos jours, car pourchassés par l'homme.
Dans le même temps, le castor a aussi fait l'objet d'une chasse intensive de la part de l'homme (pour sa viande, sa fourrure, ses dents) et il a continué à régresser alors que ses prédateurs naturels n'étaient plus, pas ou peu présents, ou au bord de l'extinction dans l'essentiel de leur aire naturelle de répartition, tel le loup, l'ours brun, et le lynx et le glouton en Europe et en Eurasie. Il est possible que les jeunes castors puissent être parfois victimes d'autres mustélidés ou de chats sauvages, mais sa morsure étant redoutable, ce risque semble limité.
Selon les observations (1999) faites en Lituanie (où environ 23 600 castors avaient recolonisé environ 5 900 sites lacustres ou de rivière[159]), le castor est redevenu l'une des proies importantes du loup en été (et une proie alternative quand les ongulés se raréfient)[160],[161],[162].
Quelques indices paléontologiques laissent penser que l'homme a précocement chassé le castor ; au moins depuis la préhistoire ;
- sur des chantiers de fouille préhistorique, on en retrouve des ossements par exemple associés à ceux de cervidés, sangliers, ovins et bovidés, qui étaient mangés par l'homme[163].
- Le musée de Saint-Germain-en-Laye conserve un fragment de tête de castor retrouvé sous le dolmen d'Argenteuil (Seine-et-Oise)[164].
Ce musée détient aussi un fragment d'incisive de castor percé d'un « trou de suspension » ; cette dent a été trouvée à Chassemy dans l'Aisne lors de la fouille d'un site préhistorique (sépultures de l'époque de la pierre polie et/ou gauloise)[164] Elle a pu être utilisée en pendentif, en amulette, ou cousue comme élément décoratif sur un vêtement ou une coiffure (illustration ci-contre) ;
- On a aussi trouvé avec ces ossements un « cubitus droit, façonné en poinçon » (daté du « Rubané ancien »[163] ; on trouve des restes de bois anciens visiblement rongés et taillés par des castors, conservés dans certains sédiments lacustres (par exemple dans le Lac de Saint-Andéol en Lozère[164],[165]) ;
- le castor, comme d'autres espèces sauvages (renard, loup, auroch, blaireau, moules d'eau douce, escargots), fait partie des aliments consommés par les soldats romains en garnison ou en déplacement[166].
- « Les Romains, au moins ceux qui habitaient les Gaules, accordaient -Selon Gabriel de Mortillet (1872)- une grande importance aux canines de castor employées comme amulettes. On rencontre fréquemment dans les collections d'antiques de petites griffes en bronze avec anneau de suspension, dont on ignorait jusqu'à présent l'usage. Je me suis assuré, en examinant le vide intérieur de ces griffes, qu'il est triangulaire, forme des canines du castor. Ses dimensions sont aussi celles de ces canines, de sorte qu'il serait très-facile d'en encastrer une dans l'intérieur de la griffe. Bien plus, dans plusieurs d'entre elles, j'ai encore retrouvé une petite portion de la dent, ce qui ne laisse plus aucun doute. Ces griffes surmontées d'un anneau étaient la monture de canines de castor que les Gallo-Romains portaient comme amulettes ; Je donne, figures 3 et 4 (illustration ci-contre) le dessin, grandeur naturelle, de deux de ces montures de bronze, qui existent au musée des antiquités nationales de Saint-Germain (…)Le musée de Saint-Germain possède une autre griffe analogue provenant de Champlieu, également en forêt de Compiègne. On en voit aussi au musée de Rouen, au musée d'Épinal et dans diverses autres collections. L'emploi des canines de castor comme amulette était donc d'un usage très général à l'époque romaine »[167] ;
- Certains constructeurs préhistoriques de cités lacustres semblent avoir utilisé pour tailler le bois, des mâchoires inférieures de castor, Les dents du castor sont très coupantes et ont été utilisées en complément aux haches dont on trouve aussi les traces sur le bois de certains pieux[164]. Les préhistoriens ont trouvé de telles dents par exemple lors de fouilles faites à Saint-Aubin et à Concise, dans les déchets de construction laissés par les hommes des villages lacustres[164] ;
- Selon Olaus Magnus (1555), le castor construisait encore des barrages et huttes dans le nord de l'Europe[168] alors que - probablement pour échapper à la prédation humaine - il avait déjà dans le sud pris l'habitude de creuser des terriers et de se cacher.
- En 1640, Jean Marius Mayer, médecin allemand, publie un ouvrage sur les propriétés médicales des diverses parties du castor. Ce livre fut réédité et augmenté en 1685, par Jean Franck, puis traduit en français, en 1746[164], ce qui laisse penser qu'une chasse destinée à fournir la pharmacopée de l'époque était aussi pratiquée. Le castor européen était déjà largement « « surexploité » »[62] en tant que ressource pour la viande, la fourrure ou le castoréum, bien avant que ne le soit son cousin américain. En 1717, le castoreum fait encore partie de la pharmacopée royale de France[54]
- En 1822, les derniers castors se cachent de plus en plus ; les constructions émergées de castors (barrages et huttes) sont devenues si rares dans le centre et le sud de l'Europe, que les naturalistes les signalent à l'attention de leurs lecteurs, ainsi Brehm, dans son ouvrage La Vie des animaux illustrée[169], rapporte que pendant l'été 1822 on a trouvé des constructions de castor émergées près de la Nathe, non loin de la ville de Barby[Laquelle ?], dans un endroit désert, couvert de roseaux, qui n'était parcouru que par un cours d'eau de six à huit pas de large et qui était connu de tout temps sous le nom de l'étang aux castors {ibid., p. 155)[164] et Lenz en 1837 note que la colonie des castors captifs de Nymphenburg (Bavière) a construit des huttes à sec (ibid. p. 159), et selon Ghudzinski, peu de temps avant les années 1870, les castors du Bug bâtissaient et ne fouissaient pas[164] ;
- Jusqu'aux XIXe et XXe siècles les trappeurs européens en ont fait un piégeage intense en Russie et Sibérie. L'espèce a presque disparu, comme dans certaines parties de l'Amérique du Nord. Diverses autorités décident alors de le protéger, voire de le réintroduire.
Systématique
modifierL'espèce Castor fiber a été décrite par le naturaliste Suédois Carl von Linné en 1758. Le mot castor viendrait du grec kástōr.
Synonymie
modifierDans le passé, cette espèce a aussi pu porter d'autres noms, parfois aussi attribués comme noms de sous-espèce ou de groupe géographique
- Castor albicus[170]
- Castor albus
- Castor balticus
- Castor fiber fiber
- Castor fulvus
- Castor galliae Desmarest, 1822
- Castor gallicus
- Castor niger
- Castor proprius
- Castor solitarius
- Castor variegatus
- Castor vistulanus
Noms vernaculaires
modifier- Le nom vernaculaire actuel est « castor » (comme pour son cousin américain et d'autres Castoridae), mais plusieurs noms vulgaires désignent l'espèce : Castor d'Europe[171],[172], Castor commun[171],[172], Castor d'Eurasie[171],[172], Castor eurasien[173] ou encore Castor européen[174].
Noms anciens, régionaux ou locaux
modifierSelon le Traité du castor de Marius & al. (article III, 1746)[46], les anciens géographes le nommaient aussi canis ponticus (« chien du Pont ») car fréquent dans les rivières du Pont (province d'Asie mineure d'où l'on importait un castoréum réputé[46]).
Le bièvre est le nom donné au castor en français et dans les dialectes régionaux, mais le mot est considéré comme vieilli ou régional dès le XIXe siècle[175], on lui préfère dès lors le mot gréco-latin castor. Bièvre est un mot d'origine gauloise de *bebros (*bebrus) qui a supplanté en latin, l'indigène fiber de même souche indo-européenne (i.-e bh- > latin f-) d'où l'existence du latin tardif beber, bebrum[176], d'où l'italien bevero. Les langues celtiques insulaires comportent des traces de cet étymon celtique, à commencer par le nom propre vieil irlandais Bibar, par contre un doute subsiste sur la celticité du vieux cornique befer qui pourrait être un emprunt au vieil anglais[176] befer « castor » et du vieux breton beuer issu peut-être du latin tardif[176]. Les langues celtiques utilisent aujourd'hui des dérivés du proto-celtique *abankos adjectif signifiant « l'aquatique, celui de la rivière », d'où le vieil irlandais abac, le gallois afanc, le moyen breton avanc « castor, bièvre »[176] (breton avank). Le mot celtique est proche du mot germanique *bebruz « castor », d'où le vieil anglais befer, l'allemand Biber, néerlandais bever, vieux norrois bjórr d'où islandais bjór, vieux danois biūr, etc. L'indo-européen *bhebhrus dont sont issus tous les représentants en latin, en celtique continental, en germanique, en slave, etc. repose probablement sur la racine *bher- signifiant « brun »[176].
L'hydronymie et la toponymie de la France et de l'Europe, comme des noms de famille, conserve souvent cet élément européen, généralement gaulois ou germanique pour la France et la Belgique, suivi d'un autre appellatif ou un adjectif : Beuvry, Labeuvrière, Bièvre, Beuvron, Bouvron, Breuvanne [177] et dans le domaine (ex-)néerlandophone Beveren, Bever, Beerschot, Bevel, Beverdonck, Bierwart, Beverloo, etc. (liste non exhaustive).
Le type hydronymique normand Brévedent / Brèvedent (Le Brévedent, Calvados, ancien nom de la rivière, Bevredan 1148 ; Le Brèvedent, Seine-Maritime, Beveredan, Bievredan XIIe siècle et Bièvredant (Colomby, Manche, Buredan, Burredan, sans dates, Bieuvredan XVIIIe siècle) remontent vraisemblablement à l'anglo-saxon bever dam « barrage des castors »[178] (comprendre befer / beofor / byfor / beuer *damm > anglais beaver dam). On note en Grande-Bretagne, les toponymes Bevercotes (Nottinghamshire, Beurecote 1165) qui désigne un « endroit où les castors ont fait leur nid » et Beverley (Yorkshire, Beferlicc 1025, Bevreli 1086) « habitation des castors »[179].
Taxonomie
modifierL'Office national de la chasse et de la faune sauvage (ONCFS) considérait en 2012[180] que, si les castors des huit populations européennes résiduelles étaient autrefois considérés comme constituant différentes sous-espèces, les données génétiques récentes ne suggèrent l'existence que de deux sous-espèces réelles :
- sous-espèce occidentale (trouvée en France à partir du dernier refuge qu'à constitué le bassin rhodanien, dans l'Elbe et chez les castors scandinaves)[180] ;
- sous-espèce d'Europe orientale (trouvée à l'est de l'Oder, et à l'Est de la Vistule en Pologne)[180].
Les populations autochtones de l'Elbe récemment (2009) étudiées en Allemagne et Autriche sont génétiquement très semblables entre elles[74] et à celles des Castors d'Europe introduits depuis quelques années dans ces régions, sans indices d'existence de sous-espèces[74] ni de présence de C. canadensis. En France (selon l'ONCFS) dans ce contexte de faible spécificité génétique (n'ayant jamais existé ou ayant été perdue avec l'extermination de vastes sous-populations des populations), « puisque les brassages ont fait perdre l'identité originelle des autres populations sources (…) l'hybridation est considérée comme source de diversité génétique, améliorant l'adaptation de l'espèce européenne aux changements environnementaux. Hormis la souche rhodanienne en France, il serait illusoire de croire pouvoir maintenir la pureté de chaque groupe initial aujourd'hui. Et encore, la pureté de la souche rhodanienne sera probablement précaire d'ici quelques décennies ».
- Liste de sous-espèces
Comme une grande partie des populations de castor a été exterminée avant d'avoir pu être étudiée par les scientifiques, d'importantes lacunes persistent à propos des sous-espèces et de leur patrimoine génétique.
Une synthèse de la littérature a été publiée en 2014 par Dietrich Heidecke de l'université Martin-Luther de Halle-Wittenberg[181].
Bien que les échanges entre les populations relictuelles soient nombreux depuis la fin du XXe siècle en raison des processus de translocation/réintroduction, certains auteurs identifient toutefois encore des sous-espèces [182] ; leur existence en tant que taxon est cependant devenue douteuse au XXIe siècle.
Selon NCBI (24 janvier 2014)[183] :
- sous-espèce Castor fiber albicus
- sous-espèce Castor fiber birulai
- sous-espèce Castor fiber fiber
- sous-espèce Castor fiber galliae
- sous-espèce Castor fiber pohlei
- sous-espèce Castor fiber tuvinicus
D'autres auteurs comme Lavrov y ajoutent
- Castor fiber orientoeuropaeus[184]
- Castor albicus Matschie, 1907 [170]
D'autres enfin jugent ces taxons obsolètes (par exemple Corbet en 1984 pour Castor albicus, ou non crédibles (car décrits sur des caractères trop instables, ou à partir d'un seul individu ou d'un trop petit nombre d'individus). Certains préfèrent simplement distinguer plus ou moins formellement trois groupes (1) asiatique, 2) scandinave-Est européen et 3) Rhône-Elbe[181] en attendant d'éventuelles études génétiques plus larges et plus poussées.
Le Castor d'Europe et l'homme
modifierIl est chassé de la Préhistoire au XIXe siècle.
Son castoréum est recherché dès l'Antiquité. Sa fourrure l'est aussi et c'est une valeur sur laquelle on spécule, au point que l'empereur Dioclétien lui fixe en l'an 301 — parmi 1000 denrées courantes — un prix maximum de 20 deniers (30, si elle est déjà tannée), pour tout l'Empire romain, dans un édit connu sous le nom d'Édit du Maximum ; la peine de mort était prévue pour le non-respect de cet édit, mais on sait qu'il n'a jamais pu être respecté[185].
Les moines et les seigneurs ont déforesté les zones les plus riches par la voie de l'essartage. Ils ont aussi canalisé, rectifié, détourné et urbanisé de nombreux cours d'eau. Ils ont construit des milliers de moulins à eau, et drainé pour les mettre en culture d'immenses zones humides. Ces différentes actions ont fait régresser les territoires occupés par les castors.
À la suite de Charlemagne qui avait créé un corps d'officiers chargé de décimer les loups dans l'empire (la louveterie), Charles II le Chauve crée un corps d'officiers spécialisés (les « bévari » ou « bevarii », officiers des bièvres), spécialement chargés de la chasse aux castors, très recherchés pour leur fourrures et depuis l'antiquité pour le castoréum qu'ils produisent (Il est également probable que les moines se soient plaints des castors qui font volontiers des barrages sur les fossés de drainage que l'on creusait alors dans toute l'Europe pour gagner de nouvelles terres sur les marais et forêts inondées) ; on les accusait aussi de dégrader les cultures faites en bord d'eau[186].
Les écrits médiévaux le citent parfois comme aliment, mais rarement comme gibier, sans doute du fait que sa viande est mal considérée par l'Église. En 751, le pape Zacharie a en effet interdit la consommation du castor, qui faisait déjà l'objet d'un interdit alimentaire[187],[188] semble-t-il peu respecté[189]. Un temps aliment interdit, il est ensuite toléré pour les chrétiens de manger le vendredi (jour sans viande) sa queue plate et écailleuse, cuisinée comme du poisson (en raison de ses écailles, de sa texture et du caractère aquatique de l'animal)[190]. Sa partie arrière (immergée quand il nage) est ensuite aussi autorisée par l'Église[191].
Au XIVe siècle, c'est encore un gibier peu apprécié de la noblesse : Gaston Fébus ne le cite pas dans son ouvrage (rédigé de 1387 à 1389), et Bianciotto remarquait en 1980 qu'au Moyen Âge, certains bestiaires désignent les chasseurs de castoréum par le terme « paysan »[192].
S'il n'est pas un mets de choix, le castor est néanmoins pourchassé pour son castoréum et sa fourrure transformée en gilets, chapeaux et manteaux d'hiver, et sa population régresse[193].
Au XIIe siècle, il semble encore relativement abondant hormis en Angleterre et au Pays de Galles où il aurait déjà disparu, mais sa régression est rapidement constatée dans toute l'Europe[194]. Il disparaît ainsi d'Écosse au XVe siècle, et de Transylvanie, d'Espagne, d'Italie et de l'Ouest de la France au XVIe siècle.
Quelques petits groupes survivent à une pression de chasse et piégeage (« trappe ») en partie reportée vers l'Amérique du Nord, notamment à l'initiative du Cardinal de Richelieu qui, inquiet du déclin de l'industrie de la fourrure en Europe, accélère la conquête du Canada et crée en 1627 la Compagnie des Cent Associés ayant le monopole de la traite des fourrures et la responsabilité de faire établir des colons (catholiques autant que possible)[195],[196]. La France déclenchera la « guerre de Sept Ans » contre les Anglais de 1756 à 1763 notamment pour s'assurer la possession et le contrôle des principales zones de piégeage des castors (le castor canadien, l'espèce nord-américaine)[195]. Les Anglais gagneront cette guerre et le castor deviendra le symbole du Canada naissant.
Mais l'animal continue à y être traqué (la seule compagnie de la Baie d'Hudson vendra près de trois millions de peaux de castor de 1853 à 1877[197].
En Europe, le manque d'animaux entraîne un effondrement de la chasse, mais celle-ci se poursuit à petite échelle. Le dernier castor de Suisse aurait été tué en 1804. En Hollande c'est en 1825, en Lituanie en 1841 puis en Belgique en 1848 et en Finlande en 1868, en Suède en 1871, et en Prusse en 1879 que les derniers spécimens connus sont tués[136],[198].
« Au milieu du XIXe siècle, l'espèce est considérée en danger critique d'extinction, avec une population eurasienne estimée à 1 200 individus[199], répartis en huit régions isolées : le delta du Rhône (France), l'Elbe (Allemagne), le sud de la Norvège (Telemark), le système Dniepr (Belarus et Ukraine), le Woronech-Don, la région de Soswa (oblast de Sverdlovsk) Konda à l'est de l'Oural et la République de Touva (Russie), ainsi que la rivière Bulgan (Mongolie, Chine)[199],[194] ».
En France sa protection débute en 1909 dans les départements du Gard, du Vaucluse et des Bouches-du-Rhône, puis en 1922 de la Drôme, sous l'influence des savants-naturalistes notamment issus de la Société d'acclimatation et du Muséum d'histoire naturelle de Nîmes[200]. Cette protection d'une espèce est nouvelle à l'époque et entretient des liens importants avec le courant de protection des paysages[201].
Au début du XXe siècle, le castor n'est probablement presque plus consommé en Europe de l'Ouest, mais son élevage a été tenté[202] (dont en France), puis rapidement abandonné car peu rentable (le castor est mauvais reproducteur par rapport au rat musqué ou au ragondin, sa fourrure est moins recherchée qu'autrefois et il consomme un poids de nourriture très supérieur à celui des carnivores comme le renard ou le vison[203]).
Plusieurs pays européens adoptent des mesures visant à la recolonisation d'une partie de l'ancienne aire de répartition[194] ». Grâce à ces programmes, de petits noyaux de population se sont reconstitués sur certains cours d'eau, et on estime vers 2010 le nombre d'individus à environ 430 000. Mais l'espèce reste génétiquement peu diversifiée et vulnérable, selon l'Union internationale pour la conservation de la nature (UICN) : sur un territoire de plus en plus écologiquement fragmenté par les routes et les barrages, la colonisation d'une section de cours d'eau (naturelle ou à partir d'individus relâchés) ou du réseau de cours d'eau d'un sous-bassin versant reste difficile et se fait souvent à partir d'un seul couple fondateur d'une famille pionnière, ce qui peut poser des problèmes de consanguinité et de dérive génétique au sein d'une population dont le bassin génétique est encore très étroit. C'est pourquoi, bien que le nombre de Castors d'Europe ait été estimé à environ 39 000 en 2003[204] le statut de conservation du Castor d'Europe reste fragile, surtout en Asie alerte l'UICN[205].
Des problèmes récurrents de cohabitation du castor avec les activités humaines existent : abattage d’arbres, consommation de récoltes (maïs), inondations causées par des barrages. En France, le réseau Castor, piloté par l’ONCFS-OFB, constate peu de décès, majoritairement due aux collisions routières. Les difficultés de cohabitation se traduisent par des demandes de « mise sous tutelle du sauvage », « qu’il soit maintenu à sa juste place » par l’État[206].
Détermination de l'âge d'un castor
modifierElle est rendue délicate par le fait que tous les mammifères semi-aquatiques ont un âge biologique différent de l'« âge squelettique » tel qu'habituellement mesuré, en raison d'une épiphysation tardive des os[207].
L'âge d'un castor mort (ou d'un squelette) peut être établi (par un expert) selon d'autres critères[208] :
- degré d'éruption des molaires et prémolaires à partir de 12 mois[209] ;
- lignes de croissance circannuelles présentes du cément des molaires, méthode autrefois utilisée, mais qui n'apporte que des indices car le castor présente une forte variabilité intraspécifique de croissance dentaire (incisive, molaire et prémolaire), y compris sur les crânes fossiles selon Stefen en 2009[210]. Le développement des racines de la dent peut aussi apporter des indications[211] ;
- largeur de l'os zygomatique ;
- longueur de la face dorsale du crâne ;
- dimensions de l'os pénien (baculum)[212] ;
- présence/absence de crête sagittale externe et développement de la ligne temporale[213] ;
- mesure du crâne et des ossements[214] ;
- stades d'épiphysation[215] ;
Répartition
modifierOn le trouve aujourd'hui en Europe, au nord d'un axe incluant la France et la Russie, particulièrement sur les rives du Rhône, de l'Elbe et du Danube, ainsi qu'en Scandinavie.
Victime de la chasse, il avait au milieu du XXe siècle presque disparu de toute l'Europe : on estime la population à seulement 1 200 individus dans toute l'Eurasie[216]. Des mesures de protection de l'espèce et théoriquement de son habitat furent prises en France dès 1909, et dans divers pays, avec des réintroductions, comme en Scandinavie dès les années 1925-1935, suivies d'autres séries de réintroductions ou recolonisations naturelles sur certains cours d'eau dans de nombreuses régions d'Europe. Ces réintroductions lui ont permis de recoloniser certains de ses habitats.
Europe
modifierAutriche
modifierPlus de 3000 castors vivent en Basse-Autriche, issus d'individus réintroduits à partir de Pologne, Belarus et Suède dans le cadre d'un programme de réintroduction et restauration[217].
Quelques individus d'origine canadienne avaient aussi été introduits dans la partie autrichienne du bassin du Danube à l'Est de Vienne entre 1976 et les années 1990[146]. Une étude génétique récente (2013) n'a pas trouvé de traces de la subsistance de C. canadensis, mais les trois lignées de Castors d'Europe se sont plus ou moins croisées ; la majorité des échantillons révélaient une origine soit scandinave (subsp. fiber) soit d'Europe centrale (probablement C. fiber albicus x belorussicus/orientoeuropaeus)[146] et curieusement un échantillon provenait du groupe (ou sous-espèce) C. fiber pohlei, plutôt génétiquement distinct. Ceci était inattendu au vu de l'histoire documentée de la réintroduction en Autriche[146].
Belgique
modifierLe castor, jugé éteint en 1848, est réapparu en 1990 dans l'Est du pays, ce retour ayant d'abord été « constaté en juillet 1991 sur la Rour, probablement à partir d'individus venus de l'Eifel (prolongation des Ardennes belges en Allemagne)[109],[194] ». À partir de l'Allemagne (et comme au Luxembourg) des castors nord-américains se sont introduits en Belgique. Le premier individu fut capturé en 2009 (et 13 autres en 2010 dans le pays et au Luxembourg) ; ils semblent provenir d'un groupe échappé d'un Zoo/Parc animalier allemand de l'Eifel. Or, dans un même cours d'eau ou plan d'eau, le Castor d'Europe et le Castor du Canada ne coexistent pas ; ils défendent leur territoire en s'excluant mutuellement (souvent au profit du second en Finlande). Aussi des experts ont-ils recommandé de rechercher et capturer les castors canadiens en Europe de l'Ouest, d'étudier leur répartition (en utilisant les analyses génétiques), afin d'éviter que le C. canadensis ne se reproduise en repoussant l'espèce autochtone européenne.
Depuis la population se reconstitue peu à peu à partir de trois sources : un retour naturel depuis l'Allemagne voisine, des réintroductions officielles par les autorités, et des réintroductions non officielles par des protecteurs de la nature : de 1998 à 2000, une centaine de castors ont été relâchés sans autorisation dans des sous-bassins de la Wallonie.
À la faveur des nombreux lieux de lâcher, le castor recolonise progressivement son territoire historique, en Ardenne et un peu moins en Flandre. Il est plus rare dans les zones à forte population humaine, bien qu'on puisse l'apercevoir en ville, comme à Liège. Végétarien, le castor est moins sensible que les carnivores à la pollution de l'eau ; il peut s'installer dès qu'une ripisylve est présente.
Depuis 2005, en Belgique, le castor cohabite[218] de plus en plus avec l'Homme, faisant même l'objet d'une activité écotouristique en plein essor, dénommée le Tourisme castor ou encore le « Pays des castors » (très nombreux lieux-dits, rivières et communes portant la déclinaison du mot Bièvre). Des excursions à la découverte des sites de castors les plus spectaculaires sont proposées dans tout le pays[219]. « En 2009, [la population] compte environ 800 à 1 000 animaux, occupant au moins 220 sites. La colonisation se poursuit actuellement [en 2012] »[194] Une petite population s'est aussi établie en Flandre belge »[109].
- En Wallonie, « en 1998, différents indices confirment l'implantation de castors en Belgique, issus de lâchers illégaux. Entre 1998 et 2000, une centaine d'individus originaires du bassin de l'Elbe et de la Bavière sont relâchés »[194] (à l'initiative d'associations privées). Le nombre de sites choisis a été relativement important, favorisant pour l'avenir une recolonisation naturelle qui aurait été sinon gênée par les nombreux aménagements réalisés sur les rivières depuis la disparition de l'animal 150 ans plus tôt.
- En Flandre, une étude récente (2017) basée sur des modèles de distribution d'espèces a porté sur ses habitats potentiels futurs pour 71 "territoires". Elle montre que même dans un paysage fortement dominé par l'Homme il y a assez d'habitats disponibles (924 territoires) pour soutenir des populations viables de castors en Flandre. Les facteurs importants sont la distance à l'eau, la présence de saules et de végétaux de milieux humides et de peupliers[220]. Ceci ne signifie pas absence de conflit avec l'homme[220].
Le castor entre localement ou ponctuellement en conflit avec certaines activités humaines quand ses activités créent des étangs, ou qu'il creuse de petits chenaux, coupe des arbres en bord de berge ou d'étangs ou interfère avec le niveau d'eau d'une pisciculture…). Aujourd'hui, hormis quelques problèmes isolés, les acteurs belges de l'environnement s'accordent sur le rôle essentiel de l'espèce dans la préservation et surtout la restauration de la biodiversité des zones humides qu'il a recolonisé. Il est parfois même considéré comme un « auxiliaire » pour la gestion de l'eau dans les vallées[221].
12 ans après la réintroduction il reste un grand potentiel d'expansion en termes d'aires de répartition et de densité de castors dans la zone actuellement recolonisée[220]. La modélisation des habitats potentiels est proposée comme outil de gestion pour évaluer et prévenir les risques liés au retour des castors dans un paysage très anthropisé. En zones critiques, Swinnen et ses collègues estiment qu'une surveillance accrue et des mesures structurelles peuvent prévenir les conflits[220]. En empêchant ou en résolvant rapidement les conflits humains avec la faune, une coexistence à long terme entre les humains et les castors peut être atteinte[220].
France
modifierEn hiver les bonnets, gilets ou manteaux de peau et fourrure de castor étaient autrefois très prisés. Il y a plus de 1 000 ans, des corps de chasseurs spécialisés dans la traque des loups (lieutenant de louveterie), des loutres et des castors existaient (C'est Charles le Chauve qui en 875 a institué les « Bévarii » (lieutenants de castors) chargés de chasser autant de castors que possible[222].
Au XIIIe siècle le castor occupait encore la quasi-totalité des cours d'eau français[27],[223], mais sous le règne de Saint-Louis, la dépouille d'un castor atteint 120 francs (à comparer au prix d'un porc : 9 francs[222].
Vers 1900, la chasse, le piégeage et la destruction de ses milieux de vie avaient réduit l'espèce à une centaine d'individus[180], dont l'ultime refuge (hors de la zone balte) fut la basse vallée du Rhône, où il sera néanmoins encore persécuté (à partir de 1880 une prime (15 francs de l'époque) était offerte pour chaque castor tué, par le Syndicat des Digues du Rhône lors des premiers grands aménagements du fleuve).
En 1909, après de nombreux rapports et mémoires écrits au moins depuis 1889 alertant sur l'état critique de l'espèce, dont par le Professeur de zoologie Valéry Mayet qui alerte le Congrès international de zoologie (à Paris en 1889), la « prime de destruction » est abrogée en 1891[222]. Galien Mingaud (conservateur du Muséum d'histoire naturelle de Nîmes) lance un « appel à tous les naturalistes et à toutes les sociétés scientifiques afin d'amener les pouvoirs publics à s'intéresser à ces animaux »[224], en appelle à plusieurs ministres, dont celui de l'Instruction Publique, appelant à la « protection d'une espèce de mammifère unique et des plus intéressantes pour notre faune, que l'on pourrait par mesure administrative, conserver au même titre que les monuments mégalithiques et historiques »[224]. Il obtient enfin du Préfet (appuyé par un vœu émis par le Conseil général du Gard)[224], que l'administration publie (en 1909) un arrêté interdisant la chasse et la capture du castor en tous temps dans le département, qui sera à l'origine de la protection des derniers castors autochtones dans le Gard, les Bouches-du-Rhône et le Vaucluse[222] (c'est le premier animal à bénéficier d'une mesure de sauvegarde[85]). La population rhodanienne put se rétablir pour atteindre Lyon vers 1960 mais sans pouvoir remonter plus haut ou vers d'autres secteurs en raison de la construction de barrages. Il était important de diversifier géographiquement les colonies pour garantir la survie de l'espèce en cas de grave épizootie ou en raison d'une éventuelle autre catastrophe (naturelle ou non) ; 26 opérations de réintroductions furent faites en 50 ans (selon l'ONCFS) avec 273 reproducteurs disséminés dans 15 départements différents à partir des années 1950-60[225]. À partir des individus survivants, la population française de castors put alors se reconstituer, toujours à partir de la souche rhodanienne. Les grands bassins concernés sont la Loire, la Moselle[226], les affluents du Rhin (Doller, Ill, Moder), le Tarn dans le bassin supérieur de la Garonne[227]. En 1965, la population de castors sur le territoire français est estimée à 3 000 individus[228].
Le castor est protégé au niveau national depuis 1968[180], puis par l'arrêté ministériel du 17 avril 1981 en application de la loi relative à la protection de la nature du 10 juillet 1976[85]. Enfin la destruction du castor ou de son environnement (y compris les barrages) est interdite par l'arrêté ministériel du 23 avril 2007[229].
Dans les années 1990-2000, l'espèce se réinstalle plus au nord en France (présent dans les trois grands bassins Escaut-Meuse-Rhin) et est présente (à des degrés divers) dans 42 départements, surtout dans la moitié est et dans le centre de la France. En 2003, il y aurait en France de 8 000 à 10 000 individus selon l'ONCFS[227]. 10 ans plus tard, (2013), l'ONCFS estime « que l'ensemble de la population française compte plus de 14 000 individus sur une cinquantaine de départements ; elle est toujours en expansion, même si des différences existent dans la dynamique de la colonisation selon les bassins. […] Un travail récent […] a mis en évidence que 10 500 km de cours d'eau étaient occupés en permanence […] en 2012 pour 17 600 km de cours d'eau prospectés. L'espèce continue encore à étendre son aire de répartition notamment sur le bassin de la Loire et dans les régions du Nord-est (bassins de la Meuse et de la Moselle notamment). Des perspectives importantes de recolonisation existent aussi sur le bassin Saône/Doubs et, en aval du Tarn, sur tout le bassin de la Garonne[230] ». En 2012 environ 50 départements abritaient au moins un couple de castor.
Un groupe de travail transfrontalier associe depuis 2007 l'ONCFS à des représentants de 4 autres pays (et 7 régions) d'Europe afin de préciser où se trouvent les éventuels castors canadiens encore présents en Europe de l'Ouest. En 2012, toutes les analyses faites en France provenaient de castors d'Europe (et un programme vise à éradiquer la souche américaine au Luxembourg et en Allemagne)[231]. Là où le castor progresse des vallées vers le haut des bassins versants, il construit plus de barrages, ce qui implique un effort de gestion plus important.
Royaume-Uni
modifierAu Royaume-Uni, le castor européen était éteint depuis 400 ans, mais une recolonisation est actuellement amorcée, bien qu'encore timide.
Six castors ont ainsi été réintroduits dans le Gloucestershire[232].
Un autre projet existe dans le Kent avec le parc de découverte de Wildwood (une famille de castors, qui vit pour l'instant dans un site clôturé).
À l'ouest de l'Écosse, dans la région d'Argyll, sur proposition en 1995 du Scottish Natural Heritage après étude de l'histoire récente, préhistorique et paléontologique[233] du castor en Écosse[234],[235],[236], une réintroduction avec suivi scientifique de 4 familles de castors venant de Norvège, chacune composée d'un mâle, d'une femelle et parfois de petits, est en cours depuis 2008. Cet « essai » du Scottish Beaver Trial[237] porte sur 5 années de suivi de la biodiversité locale qui était bien connue avant le retour des animaux. Ce sont les premiers mammifères sauvages officiellement réintroduits dans ce pays d'où le castor a disparu il y a plus de 400 ans. Selon un sondage fait par les autorités écossaises, 73 % des habitants se sont dits favorables à cette tentative de réintroduction.
Toujours en Écosse, une population issue de castors bavarois échappés de parcs privés[238] s'est spontanément développée depuis les années 2000 dans la Tay (rivière de l'Est de l'Écosse connue pour ses saumons). Cette seconde population (160 individus), non désirée initialement, va faire l'objet d'une étude sur l'impact de l'espèce sur le milieu naturel avant qu'en 2015, le gouvernement décide officiellement de l'avenir de cette population au regard des résultats scientifiques récoltés, notamment concernant le bilan de ses impacts positifs et/ou négatifs sur la remontée et la croissance estivale du saumon[239].
- en 2016, le gouvernement écossais a annoncé souhaiter que les Castor réintroduits restent en Écosse en bénéficiant d'une protection légale. Ce fut un moment historique : la première réintroduction officiellement approuvée d'une espèce de mammifère au Royaume-Uni. Ce projet a fait durant 21 ans l'objet d'intenses débats publics et de travaux de recherches multidisciplinaires et interdisciplinaires, basée sur 2500 publications scientifiques et intégrant les retours d'expérience d'autres pays, entre autres pour évaluer l'opportunité et la faisabilité d'un retour du castor, avec notamment la création d'un groupe d'experts voué à l'étude des interactions entre castors et salmonidés... qui a « éclairé la décision du gouvernement » (selon MJ Gaywood (2018) c'est l'une des démarches les plus poussées jamais faites pour une proposition de réintroduction d'espèces). En 2018, selon Gaywood ce travail a confirmé que « les castors ont une influence très positive sur la biodiversité en général, bien que certaines espèces et certains habitats spécifiques d'une grande importance pour la conservation puissent être affectés si une gestion appropriée n'est pas mise en place. Les castors offrent une gamme de services écosystémiques présentant des avantages socio-économiques potentiels. Mais selon des conditions locales les activités des castors peuvent affecter certaines utilisations des sols, leur étendue et leur importance. Les techniques de gestion sont bien développées, bien que certaines nécessitent un affinement et des autorisations appropriées dans le cadre du droit écossais. Une approche stratégique du développement de la gestion dans toute l'Écosse devra être développée en partenariat avec les principales parties prenantes »[240].
Le castor devient une espèce protégée en Écosse à partir du , il devient dès lors illégal de les tuer ou de détruire les barrages ou les huttes sans un permis[241]. La population est alors estimée à 24 à 36 individus dans la forêt de Knapdale. Cependant, des réintroductions sans autorisation ont également eu lieu dans le Tayside, la population y est estimée à 550 individus.
Une enquête d'opinion est menée en 2017 au Pays de Galles sur l'éventualité de la réintroduction du castor. En cas de réponse positive, une dizaine de couples pourraient être relâchés dans la Conwy[242].
En novembre 2019, on annonce que les castors seront réintroduits en Angleterre, dans deux sites appartenant au National Trust, l'un dans le Somerset, l'autre dans le Sussex de l'Ouest, malgré l'opposition des agriculteurs[243].
Suisse
modifierEn Suisse 141 individus ont été réintroduits de 1956 à 1977, « sur trente sites […] provenant d'origines géographiques différentes : Rhône, Scandinavie, Russie. […] Un recensement est organisé en 2007-2008 où il est comptabilisé 1 600 castors[194] »».
Selon le dernier recensement en 2008, la Suisse compterait 1 600 castors. Les principaux effectifs se concentrent sur le plateau, entre le lac Léman et le lac de Constance. Récemment, des populations se sont installées le long du Rhône dans le Valais à partir du lac Léman. Au printemps 2008, les premiers castors sont revenus naturellement dans les Grisons depuis le Tyrol voisin en remontant la vallée de l'Inn[244].
On les observe depuis les années 1990 sur les rives nord du lac Léman, de la Venoge, de l'embouchure du Boiron, ainsi que dans le vallon de l'Aubonne. « Des gens m'ont dit avoir vu des arbres découpés de façon étrange sur un des coudes de la Venoge… des arbres avaient été coupés par des castors… entre Bussigny et Échandens… Des fruitiers… » Des individus ont aussi été observés dans la cité universitaire du bas de la ville de Lausanne, entre la Sorge, la Mèbre et la Chambronne.
On observe également des castors dans le canton de Neuchâtel, dans l'Areuse et dans le lac de Neuchâtel, à l'embouchure de l'Areuse (photo ci-contre) et à Auvernier.
En 2017, la population est estimée à 2 800 individus. L'Union suisse des paysans s'inquiète alors de sa prolifération et des dégâts aux cultures et aux cours d'eau [245].
Dans d'autres pays européens
modifier« Le Luxembourg n'a procédé à aucun lâcher. Mais la stratégie d'introduction des pays voisins y trouve une répercussion. Les premières observations datent de janvier 2000 […]. Entre 2006 et 2009, la présence de castors est confirmée sur neuf rivières[194] ».
En Allemagne, les castors proviennent de 3 sources : animaux ayant survécu à l'extinction sur l'Elbe où la population est en cours de restauration avec au moins 200 individus y vivant en 2012 (et 6000 en comptant les lands de l'Est[réf. nécessaire]. D'autres sont venus des pays voisins ou sont issus de réintroductions faites dans plusieurs Lands, dont en Bavière depuis 1966. À cause du Rideau de fer les premiers castors n'ont pas été réintroduits à partir des populations relictuelles de l'Est (Reichholf, 1999 : 138) mais de la souche rhodanienne (France), de Pologne, d'URSS et de Suède (via un centre d'élevage expérimental installé dans une ferme de Neustadt[Lequel ?] (Véron, 1992 : 90[27]). À l'arrivée des castors importés de Suède, les forestiers s'inquiètent d'abord du nombre d'arbres abattus par les castors suédois, mais ce nombre diminue dès la seconde année d'un tiers (hiver moins froid en Bavière qu'en Suède et premiers besoins comblés) ; le fonds créé pour les indemnisations est finalement très peu sollicité et la population et de nombreux forestiers semblent apprécier le retour de cet animal[246].
Après éradication complète au XIXe siècle, dans les années 1990, environ un millier de castors vivraient à nouveau sur le Danube et l'Inn (de Vienne au massif de Spessart) selon Schwab et Schmidbauer, 2002 : 53). Au début des années 2000 la recolonisation se poursuit, grâce aux efforts de la Hongrie et d'autres, avec l'aide du WWF[247] 14 000 individus vivraient sur le Danube (le plus grand bassin versant d'Europe) et ses affluents[réf. nécessaire]. Peut être grâce aux mélanges entre différentes provenances génétiques, la population des castors bavarois se porte si bien que de nombreux individus y ont été capturés afin d'être réintroduits dans d'autres pays européens.
En Espagne « 18 castors ont été lâchés clandestinement en 2003 sur l'Ebre (Aragon) et la Rioja en provenance, semble-t-il, de Bavière ». En 2012, cette réintroduction n'avait pas fait l'objet de suivi ni de gestion[194] ».
En Scandinavie l'animal n'a jamais totalement disparu, car une petite population a survécu au sud de la Norvège, dans le comté de Telemark[194]. En Suède, le dernier castor connu est tué en 1871. Le premier couple de castors norvégiens est cependant réintroduit en 1922 dans le Jämtland[216]. La population suédoise est estimée à plus de 130 000 individus en 2016, 8 000 à 9 000 sont prélevés chaque années par des chasseurs. Leur présence en trop grand nombre, par exemple à Stockholm, est source de nuisance pour les espaces verts et de danger pour les habitants, certains castors se montrant agressifs. Grâce à un rétablissement des populations, la Scandinavie devient source d'individus pour des réintroductions.
En Pologne, il a été réintroduit dans les Carpates polonaises dans les années 1980, s'adaptant assez vite à des milieux anthropisés de la vallée de la Raba et ailleurs. Trois modèles scientifiques y ont été produits pour montrer comment ils peuvent aider à la renaturalisation de cours d'eau anthropisés[248]. En 2010, la population polonaise est estimée à 50 000 individus[249]. Les castors sont alors accusés d'avoir contribué aux inondations dévastatrices en creusant les digues.
Aux Pays-Bas où le dernier castor connu avait été tué en 1825, de petits noyaux de populations réapparaissent, dont dans des eaux de médiocre qualité[250],[251] à la suite de réintroductions dans sept zones humides : Flevoland (14 huttes en 2005, et entre 70 et 100 individus (originellement issus (échappés) du « Natuurpark Lelystad »), Gelderse Poort (environ 80 castors en 2000), Meuse, rivière Hunze, vallée de la Dyle, vallée de la Lienne et dans le Parc national De Biesbosch (5 000 ha de zones humides parfois présentées comme la « jungle hollandaise »[252] voire le « lieu le plus riches des Pays-Bas »[252], où à partir de 5 couples importés en 1988 de l'Elbe (en ex-RDA), vivait en 2006 une descendance de plus de 150 individus, établis dans une soixantaine de huttes, sans aucune digue de barrage car le niveau toujours haut de l'eau du Biesbosch leur suffit amplement. Le Parc a fait du castor l'un de ses focus concernant la pédagogie à l'environnement et l'affiche comme « assistant gestionnaire de la nature »[252], mais une pollution des sédiments et de l'environnement par du cadmium apporté par le Rhin et la Meuse pose problème. Le cadmium a été retrouvé à haute concentration dans les feuilles de saule et de peupliers ; 6,9 µg/g sec en moyenne, soit plus que la concentration maximale tolérable pour les grands herbivores domestiques. Le taux de Cd des reins (55 µg/g sec) et des poils de castors est corrélé à celui de l'écorce des arbres qu'il consomme. Ce taux a triplé dans les poils des individus relâchés dans le Biesbosch[253].
En outre dans les polders néerlandais, de nombreuses digues sont faites de sable et les niveaux d'eau sont toujours hauts, ce qui encourage le castor à ne pas faire de hutte mais à creuser des terriers dans le sable (qui peuvent alors s'effondrer et dégrader la digue). Un suivi des castors et d'éventuelles mesures de gestion (beaver deceivers visant à éloigner les castors de zones à risque) sont prévus.
Asie
modifierQuelques populations de castor subsistent dans des régions isolées de Sibérie et de Mongolie[205]. Ces castors ont notamment été pourchassés (pour habiller en hiver les armées de Gengis Khan par exemple). Les Mongols et les Tartares faisaient commerce de peaux ou de castors et, dans les années 1960, « le chapeau traditionnel mongol était encore un bonnet pointu ou rond, à bords rabattus, bordé de fourrure de renard, de castor ou de zibeline (…) »[254].
Ceci pourrait expliquer la très faible diversité génétique de ces populations[73], qui pourrait les rendre plus vulnérables aux modifications de leur environnement ou au risque d'épidémie.
Menaces (historiques et contemporaines) pour l'espèce
modifierPlusieurs menaces pèsent encore sur l'espèce et elles combinent ou additionnent parfois leurs effets.
Le castor était mangé ; sa chasse et son piégeages l'ont décimé dès le Moyen Âge et l'ont conduit à l'extinction sur presque toute son aire naturelle de répartition avant même le XIXe siècle, surtout en Europe de l'Ouest. Malgré une protection officielle, il peut encore être tiré par erreur (confondu avec un rat musqué ou avec un ragondin, parfois appelé myocastor en référence à son nom latin). Ces deux espèces, introduites en Europe pour leur fourrure qui devait notamment remplacer celle du castor, par exemple pour la production de chapkas, sont invasives et considérées comme « nuisibles ». Leur destruction (par la chasse et par certains pièges) est autorisée et encouragée par diverses autorités car ces animaux dégradent fortement les berges et sont localement déprédateurs de cultures. Or ces deux espèces se sont répandues dans les habitats qui conviennent le mieux au castor ; ce dernier peut alors être victime de pièges ou d'appâts empoisonnés qui leur étaient destinés.
De l'Antiquité au XVIIIe siècle, le castor était aussi recherché pour son castoréum (qu'on ne pouvait extraire sans le tuer). Sa fourrure était également très appréciée. On le chassait en hiver, période où le poil est réputé plus dense et saison où le castor est le plus vulnérable ; en 1845, l'encyclopédiste Ph. Le Bas explique que la généralisation du chapeau (de feutre de poils castor) « nécessita l'établissement de grandes fabriques, notamment à Lyon et à Paris, et l'on fit bientôt une telle consommation de castors, que ceux que l'on trouvait en France, et spécialement dans les îles du Rhône, étant détruits, il fallut poursuivre ces animaux industrieux et inoffensifs jusque dans les lacs glacés du Canada »[255]. C'est le sous-poil (plus fin et dense), qui était utilisé pour le feutre ; il présente au microscope des écailles dites « ardillons », qui se chevauchent sur toute la surface des fibres, et qui permettent au feutre d'être exceptionnellement résistant, y compris à la pluie. « Les chapeliers faisaient mijoter ce sous-poil dans un mélange d'acétate de cuivre, de gomme arabique et de mercure, pour après foulage et séchage produire le feutre le plus réputé »[256],[257].
Dans le même temps, la généralisation du drainage agricole et la recherche conjointe d'une « connectivité hydrologique de surface » visant à accélérer les écoulements, la chenalisation puis la canalisation des cours d'eau et la création de chemins de halage ainsi qu'une urbanisation nécessitant de détruire la ripisylve ont détruit les habitats de vastes populations de castors. Plus tard, les grands barrages hydroélectriques ont été de nouveaux obstacles au déplacement des castors (nécessaire pour l'entretien d'une diversité génétique au sein de l'espèce et pour la colonisation de zones disponibles à la suite de la disparition locale (naturelle ou non) de l'espèce (le castor est vulnérable à des maladies qui peuvent décimer des familles entières lors d'hivers froids ou quand leur nourriture vient à manquer ; c'est un des processus naturels de contrôle des populations)
À cette dégradation physique des habitats, il faut ajouter une dégradation chimique liée aux nombreux eutrophisants et polluants introduits dans le milieu aquatique ou contaminant les arbres et écorces à partir de l'air. Au XXe siècle, le castor subit aussi les dangers liés aux poisons largement diffusés dans la nature (notamment ceux utilisés contre les rats et rats musqués).
Localement le castor européen est confronté à des castors canadiens échappés de parcs, zoos ou élevages producteurs de fourrure. Ce dernier est moins gros que lui, mais semble souvent plus entreprenant. « La récente découverte de castors nord-américains (Castor canadensis) dans trois pays voisins de la France a soulevé une question importante. Cette espèce peut supplanter le Castor d'Europe dans les endroits où les espèces entrent en contact ». Un programme de piégeage et de suivi génétique est en cours dans certains pays pour « éradiquer cette espèce non indigène »[198],[258].
Enjeux de conservation d'une espèce ingénieur
modifierUne des spécificités du castor est sa capacité à créer (si on le laisse tranquille) sur de petits cours d'eau, aux altitudes moyennes du bassin versant, des chapelets de zones humides peu profondes. Ces eaux sont généralement renouvelées (un barrage de castors n'est pas absolument étanche, et il est alimenté par un cours d'eau, une source ou la nappe) et bien exposées au soleil tout en bénéficiant d'une certaine inertie thermique, situation idéale pour une grande productivité biologique et de nombreuses espèces des zones humides. Or les étendues d'eau peu profondes sont ailleurs dans le bassin versant les plus vulnérables aux sécheresses et grandes chaleurs, de même que les petits cours d'eau à faible débit ;
- Du point de vue hydromorphologique, il est à noter que le castor ne creuse pas (de bauges ni de petites mares) dans le sol en donnant un accès au plafond de la nappe superficielle ou en drainant les eaux de surface proche (comme pourraient le faire ailleurs des éléphants par exemple). La population de castors d'un bassin versant creuse quelques petits canaux, mais surtout ajoute et conserve dans ce bassin - sous forme de petits étangs qui sont autant de petites réserves d'eau - une grande masse d'eau. Il le fait en rehaussant le niveau des eaux superficielles dans chacun de ses territoires familiaux. Par son étendue et sa hauteur (cf. Loi de Darcy) chacun de ces petits réservoirs d'eau contribue à mieux alimenter la nappe sous-jacente, toute l'année, ce qui a des répercussions positives sur la régulation du cycle de l'eau, et sur l'alimentation des sources proches et dans les grandes vallées le compartiment sous-fluvial (grâce au relèvement du niveau piézométrique moyen) ;
- Du point de vue écosystémique, les zones humides et ensoleillées ainsi créées fournissent un habitat essentiel pour de nombreuses espèces. De plus, les réserves d'eau créées en amont de chaque barrage le sont souvent dans des zones où les mares naturelles, étangs peu profonds sont les plus vulnérables aux chaleurs et sécheresses (estivales notamment). Or les prospectives climatiques laissent craindre des hivers plus humides et des étés plus chauds et secs qui pourraient conduire à une « crise de l'eau » pour l'agriculture et les écosystèmes[259].
- Du point de vue climatique, les données scientifiques montrent aussi un « effet castor ». ex. : Des chercheurs ont étudié une zone de l'Alberta d'où le castor avait disparu au XIXe siècle mais progressivement recolonisée par lui depuis 1954[260]. Dans cette forêt mixte boréale, des eaux libres estivales réapparaissent peu à peu depuis le retour du Castor du Canada (dont les effets qualitatifs sur l'environnement sont jugés comparables à ceux du Castor d'Europe là où il fait des barrages[261], même si ceux du premier sont souvent plus imposants). Il est admis et démontré que la biodiversité locale est améliorée par les barrages, mais peu d'études avaient porté sur les effets sur le climat[260]. Cette équipe a cherché à savoir si les barrages et leurs réservoirs d'eau avaient aussi des effets sur les microclimats voire sur le climat loco-régional (température, précipitations). Des photos aériennes faites de 1948 à 2002 ont permis d'observer les modifications de surfaces en eau sur la période de recolonisation (période comprenant des épisodes humides et secs)[260]. Résultats : le nombre de huttes occupées « expliquait » plus de 80 % de la variabilité de la présence d'eau libre durant ce demi-siècle[260]. Et les variables climatiques (températures et précipitations) avaient statistiquement « beaucoup moins d'importance » que la présence/absence de castor dans le maintien de ces zones d'eau libre[260].
« En outre, les années humides et sèches, l'étendue totale d'eaux libre était multipliée par 9 dans la zone où le castor était revenu (par rapport aux zones où il est resté absent) »[260]. Les auteurs en ont conclu que le castor a une influence considérable pour la création et l'entretien des zones humides, y compris durant une sécheresse extrême, et que pour cette raison, sa disparition doit être considérée comme néfaste aux zones humides et aux services écosystémiques qu'elles procurent[260].
Effets de la régression ou disparition du castor
modifierDe nombreux auteurs anciens se sont plaints de sa disparition en Europe, mais en ne le considérant que comme une source de fourrure et/ou de castoréum. Châteaubriand en 1829 s'inquiète de voir le castor américain régresser lui aussi rapidement, privant les hommes d'autres avantages ; ainsi écrivait il « On voyoit auprès de Québec un étang formé par des castors, qui suffisoit à l'usage d'un moulin à scie. Les réservoirs de ces amphibies étoient souvent utiles, en fournissant de l'eau aux pirogues qui remontoient les rivières pendant l'été. Des castors faisoient ainsi pour des sauvages, dans la Nouvelle-France, ce qu'un esprit ingénieux, un grand roi et un grand ministre ont fait dans l'ancienne pour des hommes policés[262] ». Sa vision est encore utilitariste.
C'est plus récemment qu'on a pris conscience des effets écologiquement négatifs de la disparition du castor. Ces impacts sont l'assèchement, la disparition ou la « fermeture » de zones humides, des inondations en aval et des sécheresses en amont, la dégradation des tourbières (qui sont aussi des puits de carbone), de l'eau et de la biodiversité causées par l'homogénéisation des cours d'eau[263], à la suite de la disparition de ses barrages là où il en faisait… (et des réseaux de microcanaux y afférents).
Effets du retour du Castor
modifierDès les années 1930-1960, de nombreuses opérations ou programmes de réintroduction et de conservation en faveur du Castor ont eu lieu en Europe, motivées par des raisons d'éthique environnementale, écologiques et/ou utilitaires. Elles ont contribué à ce que - à la fin du XXe siècle - le castor puisse réintégrer quelques cours d'eau, dans des régions ou pays d'où il avait disparu.
Là où il reconstitue peu à peu des populations viables, les riverains, les habitants des vallées et les scientifiques peuvent observer et parfois mesurer les modifications de l'environnement induites par cette « espèce-ingénieur ».
Parmi les pionniers ayant observé, utilisé et fait reconnaitre l'importance écologique du castor figure Éric Collier[264] qui en 1920 a décidé de vivre en autosubsistance dans la Meldrum Creek (région de Chilcotin, à l'ouest du grand fleuve Fraser en Colombie-Britannique), zone où les castors avaient été éradiqués par les trappeurs quelques décennies plus tôt. Il subit un incendie de forêt et observe que la faune et la flore désertaient la vallée, faute d'eau en été. Il constate que tous les marais, de grande ou petite taille de la région avaient pour origine un barrage de castors. Il décide dans les années 1930 de lui-même construire un barrage pour faire remonter le niveau de l'eau afin de pouvoir à nouveau cultiver, permettre à la nature de se reconstituer et aux animaux sauvages de revenir y boire. Au printemps 1935, le barrage qu'il a construit près de sa maison retenait 200 acres (environ 81 ha) d'eau et lui permettait d'irriguer. En 1941, Collier obtient un couple de castor du gouvernement. Deux heures après sa réintroduction dans l'étang du barrage, ces castors avaient déjà détecté et bouché la seule « fuite » de la digue (fuite volontairement entretenue pour apporter de l'eau à leur maison)[265],[266]. Ce couple de castors a fait des petits, et en 1950, seulement neuf ans plus tard, cette famille de castors avait fait réapparaitre plusieurs étangs qui ont de mieux en mieux stocké les pluies, de l'automne au printemps[264]. La végétation environnante est devenue exubérante ; les castors, grâce à leurs barrages, ont effectivement peu à peu restauré de vastes zones humides et ouvertes, qui ont efficacement bloqué ou limité les incendies de forêt et permis une restauration du sol et des écosystèmes[264] au point qu'un nouveau feu de forêt épargne la vallée et la maison des Collier, grâce à l'eau accumulée par les castors et que l'inondation de 1948 a été limitée dans cette zone par ces mêmes barrages, qui bien entretenus par les castors y ont résisté[264].
Les effets les plus spectaculaires du retour du castor sont liés à ses capacités à restaurer des zones humides, ouvrir le milieu et à complexifier les écotones.
Effet zones-humides
modifierChaque petit barrage, même de quelques dizaines de centimètres de hauteur conserve une provision permanente d'eau
En Croatie cinq chercheurs de la Faculté de sylviculture de Zagreb ont étudié les effets de la réapparition de barrages de castors sur de petits cours d'eau à très faibles débits estivaux et/ou antérieurement à sec en été[267]. Les auteurs ont conclu que le retour du castor a eu un rôle positif et même majeur en matière de restauration et de conservation des écosystèmes aquatiques et des zones humides. Ces barrages conservent de l'eau pour toute une flore et faune supplémentaire autour de sa réserve d'eau ; l'étude a montré que même de très petits barrages (ou série de barrages) de seulement 30 à 40 cm et d'une largeur de 5 à 8 m, dans lequel les castors n'intègrent que 1 à 2 m3 de matériaux suffisent à recréer des successions de petits étangs de 40 à 50 m3 d'eau offrent de nouvelles conditions de vie à la biodiversité locale. Sur des cours d'eau étroit, le Castor d'Europe peut établir des barrages mesurant jusqu'à 2 m de haut et 8, 10 voir 15 m de large et incorporant 20 à 50 m3 de bois et terre créant des retenues d'eau atteignant de 400 m3 à 3 000 m3 (selon sa surface et profondeur)[267]. Des loutres réapparaissent régulièrement sur ces lacs en raison des conditions favorables qu'ils offrent au développement des populations piscicoles, mais aussi de bivalves et de crustacés[267]. Les Cigognes sont systématiquement présentes le long des berges et les chercheurs ont aussi constaté une augmentation du nombre de canards sauvages (et d'oiseaux d'eau en général)[267]. Ils concluent qu'en régulant les flux d'eau, le castor a un rôle crucial pour la survie et la conservation de la flore et la faune de ces petits cours d'eau[267].
Une étude conjointement menée par des chercheurs des Universités de Gand (Belgique) et de Ferrara (Italie) a porté, dans la région belge la plus riche en castors, sur les effets spatio-temporels de leurs barrages sur l'hydrologie, l'hydrogéomorphologie et le transport sédimentaire. La comparaison des débits de 1978-2003 (avant l'arrivée des castors) et des débits des années suivantes a montré que les castors ont significativement réduit les débits de crue du ruisseau au niveau des barrages de castors ainsi qu'en aval : « les pics de crue sont significativement plus bas à l'aval de la série de barrages », avec des crues également moins fréquentes : dans le sous-bassin de l'Ourthe Orientale qui abrite la population de castors la plus dense de Belgique : Le débit de crue de 60 m3/s qui survenait tous les 3,4 ans ne survient plus que tous les 5,6 ans depuis que les barrages de castors sont là. De plus, un effet retard est observé : les 6 barrages de la Chevral écrêtent les crues d'approximativement 1 jour, limitant les risques d'inondation en aval. Un autre effet bénéfique est une nette amélioration du débit d'étiage : « le Q355 (c.à.d. le débit dépassé 355 jours par an) de l'Ourthe Orientale qui était 0,6 (±0,15) m3/s est remonté à 0,88 (±0,52) m3/s après l'établissement des barrages » ; dans les sous-bassins concernés, les épisodes extrêmes du cycle crue-étiage ont donc été atténués par les castors[261],[42].
Effets hydrogéomorphologiques et sédimentaires
modifierL'étude belgo-italienne citée ci-dessus a aussi mesuré[268],[261] le volume, la masse, la distribution granulométrique et la répartition des sédiments retenus par 34 barrages de castors sur la Chevral. Elle a montré que ces barrages filtrent et ralentissent une partie des matières en suspension et des matériaux colportés par l'eau. Le retour du castor se traduit par un tamponnement des flux sédimentaires, tout en conservant une hétérogénéité entre l'aval et l'amont d'un barrage et entre l'entrée et la sortie de chaque séquence de barrages. En 7 ans, de 2004 à 2011, malgré un débit parfois torrentiel (plus de 60 m3/s en période de pointe), les castors ont ainsi retenu 1 710 m3 de sédiments dans les étangs (25,1 cm d'épaisseur en moyenne, l'épaisseur étant significativement (p < 0.001) corrélée à la taille de l'étang de castor), selon un modèle de déposition irrégulier (ondulé) sur le cours d'eau (chaque étang riche en sédiment étant précédé par plusieurs étangs plus pauvres en sédiments[261]. S'agissant de la granulométrie, « un grossissement textural vers l'aval était également observé dans les séquences de barrages, ce qui est probablement à mettre en relation avec l'occurrence de brèches temporaires dans les barrages d'amont »[261]. L'épaisseur du sédiment varie dans le temps en lien avec l'hydrogramme de la rivière, avec « une déposition en phase montante et une légère érosion pendant les décrues ». En sept ans, deux séries de barrages ont « filtré 190 tonnes de sédiments hors du Chevral, ce qui est dans le même ordre de grandeur que les 374 tonnes mesurées dans les étangs, la différence correspondant aux excavations des castors (60 tonnes) et l'addition par ruissellement depuis les flancs des vallées »[261]. Comme d'autres, les auteurs concluent que dans ce type de contexte, la nature des effets hydrogéomorphologiques des barrages du Castor d'Europe est comparable à ceux observés en Amérique du Nord pour les barrages de C. canadensis[261], bien que ses barrages plus nombreux et souvent plus hauts aient des effets plus marqués (ex : jusqu'à un mètre d'épaisseur de sédiments stockés par certains grands barrages établis par C. canaensis)[269].
Effet lagunage naturel
modifierTselmovich & Otyukova (2006), parmi d'autres ont montré que les chaines d'étangs ont un rôle épurateur et améliorent les caractéristiques physico-chimiques de l'eau : les micro-organismes dont planctoniques, les végétaux et les organismes et qu'ils accueillent consomment ou transforment en biomasse une partie des nutriments et des matières en suspension. Ils dégradent de la nécromasse. Leurs mouvements et celui des castors homogénéisent l'oxygène dissous et mélangent les couches thermiques (évitant la formation d'une thermocline).
Effet nappe
modifierLes « digues » faites par les castors entretiennent une nappe superficielle toute l'année, favorable à la formation des tourbes ou tapis de sphaignes qui sont des puits de carbone, et alimentant la nappe sous-jacente quand elle existe. Si le substrat géologique est perméable, les étangs de castors alimentent la nappe (et les sources qui en dépendent) d'autant mieux que le barrage est haut et/ou sa largeur importante (Cf. Loi de Darcy).
Effet d'enrichissement de la biodiversité
modifierLe castor-ingénieur est une espèce facilitatrice[204] : là où il ouvre les berges et fait des barrages, le castor contribue à ensoleiller le milieu et à positivement complexifier les écotones et son environnement[270], en augmentant le nombre de niches écologiques, pour des animaux aquatiques (poissons[271],[114],[272]) et des ripisylves (amphibiens notamment[273]), mais aussi pour des mammifères volants tels que les chauves-souris[274],[275] dans les petites vallées.
Ray & al. (2001) ont montré que le retour des étangs de castors permet la venue d'une succession de macrophytes et de nouvelles ceintures de végétation qui n'existeraient pas là sans eux[276]. Ils ont étudié 36 étangs à castors canadiens âgés de 4 à 40 ans, isolés des autres masses d'eau en zone de tourbière : « la richesse et la diversité en espèces augmente de façon linéaire dans les étangs au cours des quatre premières décennies. L'âge de l'étang et le produit de la dimension de l'étang par le nombre d'étangs voisins dans un rayon de 250m expliquent 64 %[277] de la variation dans la richesse », avec une composition floristique qui semble fortement déterminée par le mode de dispersion des graines (apportées par le vent, les oiseaux ou d'autres animaux qui viennent profiter de ce nouveau point d'eau ou de la flore, faune ou fonge ou des microorganismes qu'il abrite)[276]. Dans ce cas les étangs de 11 à 40 ans présentaient la plus forte diversité en macrophytes, tant pour les espèces à feuilles flottantes que submergées. Dans les étangs plus anciens, les nymphéas (plante consommée par les castors) sont plus dominants, accompagnés d'espèces de Potamogeton. À cette occasion, un « modèle de prédiction pour la succession des macrophytes dans les étangs à castors »a été mis au point, qui pourra faciliter l'étude des processus écologiques liés aux macrophytes favorisés par les castors[276].
Gestion de populations en situation ou risque de conflits avec les activités humaines
modifierAprès son retour spontané ou sa réintroduction, ses barrages (il n'en fait pas toujours en zone rocheuse et n'en fait pas en eaux profondes) peuvent à nouveau inonder des surfaces significatives, ce qui diminue le risque d'incendies de forêt[265] et favorise le rechargement des nappes[265] (Cf. loi de Darcy) mais peut parfois perturber les usages de ces zones (ex : si l'on y a entre-temps construit des routes ou mis d'anciennes zones humides en culture). Certaines zones où le castor est revenu, après que des routes ou des voies ferrées y ont été construites, sont surveillées au Canada (dont par avion, avec éventuel « contrôle stratégique des populations ») de manière à prévenir d'éventuelles inondations ou problèmes hydrauliques gênants pour les infrastructures. Le déraillement le 7 avril 1997 d'un train du Canadien Pacifique causé par l'affaissement d'une voie ferrée[278] a été supposé lié à une pression hydrostatique trop importante, induite par l'élévation de la nappe à la suite de la construction d'un nouveau barrage par des castors, mais les experts ont aussi conclu que la voie était construite sur un « remblai de sable meuble » qui a « contribué à l'affaissement de la plate-forme ». « Des centaines de milles de chemins de fer canadiens sont sujets aux affaissements de plate-forme », mais l'implication des castors n'a été mise en cause que dans quelques cas et toujours pour des voies anciennes (un siècle environ ou 80 ans), et mal construites[279].
Autre exemple : La manière dont les ponceaux ont été conçus et des paramètres géomorphologiques et hydroécologiques locaux (dont la disponibilité en ressources alimentaires) peuvent ou non favoriser l'installation de barrages de castors sur des ponceaux[280]. Des solutions existent ou parfois on préfère détruire ou déplacer le barrage. Ainsi dans un cas de menace pour des routes et ponceaux de terrain militaire (CE SCFT Meaford, dans la région des Grands Lacs) ; l'armée, après une étude d'incidence sur l'environnement, a été autorisée à piéger et déplacer les castors, puis détruire le barrage, avec précaution « de manière à ne pas altérer, perturber ou détruire de façon dommageable l'habitat du poisson »[281]. Il arrive au Canada que l'on démantèle des digues de castors pour des raisons de drainage agricole. Si ceci se fait à proximité d'une réserve naturelle de faune, une étude d'incidence est obligatoire, pour évaluer les risques potentiels sur la santé humaine et sur l'environnement[282].
Inversement, la disparition brutale d'une famille de castors (maladie, chasse, empoisonnement, piégeage) a dans un cas causé l'affaissement d'une plate-forme ferroviaire[283] (attribué à la baisse d'un étang proche à la suite de la rupture d'un barrage de castors (néanmoins, l'expertise a montré que cette voie avait été construite au XIXe siècle, avant les normes modernes de sécurité, et sur une base fragile de tourbe et de limon glacio-lacustre, qui a été déstabilisée par la baisse de l'eau).
Un simple siphon auto-amorcant permet de contrôler le niveau d'un réservoir d'eau construit par le castor. Ce siphon doit être silencieux car le bruit de l'eau qui coule est l'un des deux stimuli qui déclenchent l'acte instinctif de colmater une brèche dans le barrage. L'entrée du siphon doit aussi être protégée ou éloignée vers le centre de la retenue d'eau, car s'il détecte un important courant de fuite, le castor en rebouchera l'entrée avec des branchages et de la terre[265]. Le tuyau peut être rigide ou souple et doit être adapté au débit.
L'olfaction
modifierL'olfaction est rarement prise en compte par les programmes de conservation/réintroduction ou de contrôle de l'espèce, mais comme chez d'autres mammifères nécessitant des efforts de conservation[284] son caractère d'émetteur « odorant » pourrait permettre de mieux surveiller sa santé, son bien-être et ses interactions sociales par des moyens non invasifs et non stressants pour lui. Il est aussi possible d'utiliser ses aptitudes olfactives et à la « communication chimique » ; des parfums (hormones, médiateurs chimiques) manipulés pourraient permettre de réduire les conflits homme-castor et de faciliter le succès des réintroductions en réduisant certains stress et conflits territoriaux et/ou en influençant sa dispersion et ses phénomènes et lieux de colonisation. La connaissance de ses codes olfactifs permettrait de faciliter une capture moins stressante des animaux, de réduire son stress en période de captivité ou de quarantaine, de reproduction ou formation du couple et pour la fidélité au site de réintroduction ou pour l'éloigner de zones où il risquerait de se faire écraser ou de produire des dégâts sur des arbres cultivés[285].
Protection des cultures, sylvicultures et jardins
modifierSelon Dewas & al. les castors doivent aujourd'hui souvent occuper des « habitats sous-optimaux pour eux, et en conséquence, entrent en conflit avec les activités humaines. Des solutions efficaces pour prévenir les dégâts de castors comprennent la restauration des habitats riverains, des moyens de décourager les dommages aux cultures et la fourniture de barrières physiques pour protéger les cultures »[198], limitant le risque de conflit avec la sylviculture ou l'agriculture (deux activités auxquelles le castor peut par ailleurs aussi rendre service en conservant l'eau qui risque de manquer en été, notamment dans le contexte des bouleversements climatiques attendus).
Si des populicultures ou autres sylvicultures (en particulier de fruitiers tels que pommiers et pêchers et plus rarement abricotiers, cerisiers, pruniers et poiriers) sont proches du bord de l'eau et non protégées (surtout dans les premiers 15 mètres et plus rarement jusqu'à 30 voire à 50 mètres de la berge), de même pour certaines cultures (maïs ou tournesol), le castor peut y faire quelques dégâts, surtout si la ripisylve est peu végétalisée ou peu arborée. De simples grillages et clôtures peuvent protéger des arbres ou des parcelles de populicultures[286], et le niveau d'eau peut être contrôlé (voir § ci-dessous).
Contrôle du niveau de l'eau des étangs ou de sa position
modifierCes mesures (préventive ou prises a posteriori) sont parfois localement nécessaires (pour protéger des infrastructures ou des cultures, ou pour interdire l'accès d'une zone polluée ou dangereuse pour le castor).
Des dispositifs ont fait leurs preuves[287] notamment au Canada et/ou dans certaines régions européennes très anthropisées :
- le pré-barrage : il « invite » le castor à faire son barrage là où on le souhaite (le site doit aussi convenir au castor, en particulier le fond doit permettre l'ancrage du nouveau barrage)[288] ;
- le « grillage éco-castor » ; ce long tuyau de solide grillage inoxydable et à grandes maille, préfabriqué est posé en amont d'un ponceau/tuyau ; le castor ne le bouche pas (installé sur plus de 600 sites de 1987 à 2010 au Canada, nécessitant peu d'entretien et résistant à la glace[286])
- le système « Clemson » (ou Clemson Beaver pond Leveler, inventé en 1987 par le Dr Gene Wood de l'université Clemson (Caroline du Sud), très efficace pour contrôler le niveau d'eau, maintenant utilisé dans plus de 40 États américains : un long tuyau percé, lui-même entouré d'un grillage, répartit l'écoulement de l'eau sur toute la surface du tuyau, le rendant indétectable par les castors[151] ;
- « cône de déprédation », l'un des moyens d'empêcher le colmatage d'un ponceau[289] ;
- un siphon associé à un ou des tuyaux perforés (ou un tuyau perforé en forme de T qui contrôleront le niveau de l'eau ;
- le tuyau bicylindre[290],[291] ;
- la « passe migratoire temporaire » posée dans une brèche creusée dans le barrage en période froide ou fraiche (fin d'hiver/printemps), avant la période de réparation du barrage par le castor (en été). En automne le castor cherchera aussi à boucher la brèche (qui doit alors être entretenue[292]). Depuis des millions d'années salmonidés et castors ont profité les uns des autres : les smolts et jeunes truites profitent des barrages et étangs pour grossir plus vite et plus nombreux. Les castors profitent aussi de l'iode et de certains sels nutritifs rares dans les hauts de bassin versant, remontés de la mer par les grands migrateurs qui la plupart meurent après la ponte.
Mais pour faciliter la migration de l'omble de fontaine, des modalités de gestion interactive ont néanmoins été développées au Canada[269] ;
- le « cube Morency » (cube de grillage protégeant une prise d'eau immergée d'un colmatage par le castor)[292] ;
- la capture et relocalisation des castors ; elle est parfois préférée aux solutions précédentes (après justification et autorisation ad hoc de l'autorité environnementale concernée), suivie d'un démantèlement du barrage[151],[293].
- un fil électrifié (dont l'animal apprend très vite à s'éloigner ; technique plutôt réservée aux zoos ou à certains parcs de vision) ;
Plusieurs de ces moyens peuvent éventuellement être combinés entre eux.
Les expériences canadiennes et européennes de réintroduction et de conservation montrent que des efforts de communication et de pédagogie auprès des riverains des cours d'eau où vit le castor, et quelques mesures simples permettent qu'il soit mieux accepté et évitent qu'il soit trop facilement confondu avec le rat musqué ou le ragondin (le castor est en effet souvent menacé par les pièges et appâts empoisonnés destinés à éliminer ces deux espèces). Des pièges et appâts uniquement accessibles à ces deux espèces ont été testés pour protéger les castors. En France, les pièges qui tuent sont interdits par arrêté préfectoral dans les zones fréquentées par le castor ; le piégeur peut ainsi libérer un castor malencontreusement capturé dans le piège.
Le poison a des effets négatifs pour d'autres espèces. Il est donc de plus en plus interdit et on lui préfère un piégeage sélectif. En aval de zones urbanisées et cultivées, le castor risque néanmoins encore d'être en contact avec d'autres rodenticides mal utilisés (non fixés) près des berges et emportés par les crues vers les cours d'eau, et vers les barrages de castors (quand ils existent).
Gestion des risques de piégeage accidentel
modifierLe Castor (comme la Loutre et le Vison d'Europe) peut être facilement accidentellement tué par des pièges destinés à des espèces dites nuisibles telles que le Rat musqué ou le Ragondin. Pour éviter cela, un arrêté du 8 juillet 2013, abrogé et remplacé par un nouvel arrêté du 24 mars 2014 (J.O. du 2 avril 2014, pour une entrée en vigueur le 1er juillet[294]) interdisent les pièges tuants de catégories 2 et 5, dans les zones de présence de ces espèces (définies par arrêté préfectoral annuel).
Contrôle de la démographie (piégeage, stérilisation)
modifierDans tout l'hémisphère nord, dont en Russie[295] des préoccupations de gestion plus « conservatoire » émergent. En Finlande où une dizaine de milliers de castors canadiens sont en compétition avec l'espèce autochtone, une gestion différenciée devrait être facilitée par l'apparition d'outils de discrimination biochimique et génétique des deux espèces[296].
En parc urbain par exemple, si une population devient « trop » importante par rapport aux capacités d'accueil du milieu, sa démographie peut être contrôlée par piégeage ou stérilisation des mâles (avec autorisation dérogatoire administrative, dans les pays où le castor est protégé).
Le piégeage avec translocation est souvent pratiquée (en plein Montréal par exemple), mais la « niche écologique » laissée vide sera volontiers réoccupée par de jeunes castors s'il en existe à proximité, ce pourquoi on préfère parfois la stérilisation (voir ci-dessous)[297] ;
La vasectomie rend le couple stérile (car le castor est fidèle), mais il va aussi continuer à défendre son territoire, avec des besoins alimentaires diminués, car ne faisant plus de petits (selon un suivi de cinq ans après vasectomies de castors sur l'île de Montréal). La vasectomie est préférée à castration qui, elle, modifierait le comportement, les liens familiaux et l'équilibre hormonal du mâle[297],[298],[299],[300]. La stérilisation, bien expliquée, serait la méthode préférée du public.
De nombreux auteurs[301],[302] plaident pour une gestion plus intégrée des populations de castors, mais aussi de la vie sauvage en général.
Sensibilisation du grand public
modifierLes associations étudiant le castor ont presque toutes engagé des actions de sensibilisation du grand public via des animations et des sorties de découverte de l'espèce in situ.
À l'initiative des naturalistes du Nord de la France et de Belgique travaillant sur le castor européen, une manifestation internationale : Beaver Spring, le Printemps des Castors, a vu le jour en 2011[303]. Ainsi chaque printemps (du 20 mars au 20 juin) des animations, conférences et sorties-nature sont organisées de l'Écosse à la Suisse (dont la France, au Benelux et en Allemagne) afin de faire découvrir l'animal. En France, la Société française pour l'étude et la protection des mammifères (SFEPM) porte nationalement l'événement (affiches, plaquettes, site internet).
Généralement seuls des naturalistes nyctalopes ou quelques chanceux ont l'occasion d'entrapercevoir ce rongeur semi-aquatique. Lors des sorties de découverte, les animateurs entretiennent parfois l'illusion que le public pourra observer le mammifère assez farouche. Cette frustration potentielle fait partie intégrante des sorties dédiées en premier lieu à la sensibilisation aux questions biologiques et surtout écologiques. Elles ont pour but de faciliter la connaissance de l'action et du rôle de l'animal pour la restauration des zones humides et la biodiversité, et donc l'acceptation de l'animal. Elles permettent souvent de désamorcer les conflits, car bien que possédant un important capital de sympathie, le castor peut ponctuellement dégrader des biens privés et alors provoquer des réactions parfois radicales des propriétaires concernés[304].
Facteurs de mortalité
modifierIls varient selon le caractère plus ou moins artificialisé du contexte écopaysager.
Mortalité naturelle
modifierDans la nature la prédation (par loups, lynx, loutre ou glouton) est première cause externe de mortalité. D'autres causes sont les maladies qui affectent le castor (les jeunes ou les vieux individus surtout) ainsi que les combats territoriaux qui opposent les castors entre eux. Les causes accidentelles ne doivent pas être négligées (castors écrasés par l'arbre qu'il abattait, ou mort dans l'effondrement de son terrier lors d'une crue par exemple (Ainsi « la crue de 1907 aurait détruit 30 castors sur 40 dans la colonie du château de Saint-Privat sur le Gardon »[305].
En milieu anthropisé, l'Homme est souvent la première cause, directe ou indirecte, volontaire ou non, de mortalité du Castor (pour les animaux retrouvés morts et ayant pu être étudiés). Peuvent être en cause la collision avec un véhicule (55 % des cadavres retrouvés en 2013 par l'ONCFS[306]) et plus discrètement la chasse, l'empoisonnement, le piégeage, le braconnage, l'asphyxie dans un engin de pêche, une chute dans un tuyau ou siphon où l'animal est piégé… 30 % des causes ne sont pas élucidés par l'ONCFS (pour 80 cadavres trouvés en 2013 par exemple[306]).
Causes anthropiques
modifierOutre la chasse et le piégeage qui sont désormais interdits ou strictement encadrés dans la plupart des pays eurasiatiques, les quelques études ayant porté sur les causes de mortalité des castors retrouvés morts montrent l'importance des causes anthropiques.
Ainsi, l'analyse des causes de mortalité du Castor en Rhône-Alpes (dans une population reconstituée à partir de 64 individus transplantés) a montré que pour 46 castors retrouvés morts, 47,5 % sont morts d'une cause anthropique (dont 34,7 % à la suite d'une collision avec un véhicule) et pour 32 % des cadavres, il n'a pas été possible de retrouver la cause de la mort, qui pouvait aussi être dans une partie des cas anthropique[307]. Le risque de mourir est le plus élevé durant les six premiers mois de vie et au moment de la dispersion (Payne 1984 ; Heidecke 1984 ; cités par Bart Nolet (1997)[3]).
Les translocations pour réintroduction peuvent être source de stress et peut-être de vulnérabilité aux maladies. Ainsi, de 1988 à 1994, sur 58 castors déplacés de l'Elbe (Allemagne) aux Pays-Bas, 43 ont été équipés de radio-émetteurs. Vingt-deux de ces animaux ont ainsi pu être récupérés à leur mort, afin d'étudier les causes de leur décès. Des maladies infectieuses semblaient en cause dans la moitié des cas (yersiniose et leptospirose essentiellement alors que la Yersiniose est jugée rare chez les castors de l'Elbe, et que la leptospirose n'avait pas été signalée auparavant chez les castors). Les auteurs supposent que le système immunitaire de ces castors a été affaibli par le stress au moment d'exposition à de nouveaux pathogènes et ont recommandé de limiter le stress des animaux réintroduits et de les vacciner contre Yersinia pseudotuberculosis et la leptospirose avant réintroduction[308], mais il a aussi été montré que les sédiments de la zone de réintroduction avait été fortement pollués par du cadmium retrouvé dans les saules et dans l'organisme des castors.
Maladies et parasitoses
modifierLe castor semble assez peu vulnérable à de nombreux parasites et microbes transportés par les rongeurs terrestres ou leurs carnivores prédateurs, malgré sa Cæcotrophie et une relative promiscuité dans le terrier ou la hutte et en dépit de conditions de vie souvent très rudes. Ceci est peut-être en partie dû à sa nourriture (l'écorce de saule contient beaucoup d'aspirine et les autres écorces contiennent de nombreuses molécules antibiotiques ou permettant à l'arbre de se défendre contre la plupart des attaques d'herbivores et contre les infections bactériennes et fongiques). Son cousin américain se montre par exemple souvent épargné par les Cryptosporidium spp. pourtant relativement fréquents chez d'autres animaux à fourrure. Une étude ayant porté sur les fèces de 481 mammifères à fourrure capturés dans le Maryland, dont 87 castors (les autres étant des renards, des rats musqués, des loutres et des ratons-laveurs), a déterminé que 8 % du total de ces animaux étaient infectés par au moins une espèce de Cryptosporidium spp. Une autre étude (de 3 ans, chez 62 castors du Massachusetts) a recherché 3 groupes de parasites (Microsporidia sp, Cryptosporidium spp et Giardia sp.). Dans ce cas 6,4 % de ces castors américains étaient porteurs de Protistes parasites (tous jeunes ou subadultes) et aucun ne portait de microsporidies, 4 portaient des Giardia spp et deux des Cryptosporidium spp, découverts pour la 1re fois chez des castors américains)[309] ; en Pologne une étude avait trouvé 2 sujets infectés sur 19 examinés[310]. Les animaux malades ou parasités sont supposés être plus vulnérables aux prédateurs, aux collisions avec des véhicules ou être plus souvent trouvés morts. Une recherche d'échinocoques faite en Alsace et en Lorraine sur quatre cadavres accidentés (à Barbonville, Bicqueley, Richardménil, Messein) a conclu à l'absence d'échinococcose, mais un cas a été signalé chez un individu capturé pour être réintroduit au Royaume-Uni[311].
Parasitoses
modifierComme toutes les espèces, le castor peut être parasité par divers organismes ; externes (ectoparasites) et internes (endoparasites), même si par rapport à d'autres rongeurs, il semble peu parasité, en Norvège par exemple[312].
Ectoparasites
modifierOn ignore s'il a de véritables ectoparasites spécifiques ou s'il s'agit de symbiotes ou de simples commensaux. Quelques espèces sont en tous cas parfois ou fréquemment trouvées sur sa peau ou dans sa fourrure, et semblent s'être parfaitement adaptées à son mode de vie semi-aquatique, comme chez son cousin américain[313] On lui connait des parasites acariens spécifiques, du genre Schizocarpus et de la famille Chirodiscidae[314], ou un petit coléoptère (Platypsyllus castoris (Leiodidae: Platypsyllinae)[315]) qui vivent dans la partie fine et profonde de sa fourrure.
En juillet 1988, les arthropodes présents dans la fourrure de 6 castors d'Europe de la région polonaise de Popielno près Ruciane ont été recueillis et étudiés[316]. Trois espèces d'acariens (Schizocarpus numerosus Dub., Schizocarpus fedjushini Dub. et Schizocarpus brachyurus Dub.), nouvelles pour la Pologne ont été identifiées à cette occasion. Ces castors étaient aussi porteurs de nombreuses tiques (femelles d'Ixodes hexagonus à l'état de larves et de nymphes), espèce qui semble en augmentation chez de nombreux animaux et dont l'aire de répartition augmente, capable de transmettre diverses maladies, dont l'encéphalite à tiques. Ont aussi été trouvés un ciron (Acarus farris Oud.), espèce appartenant à un genre déjà connu comme étant capable de se faire transporter par d'autres organismes comme des puces (association phorétique[317]) et Cunaxoides kielczewskii Mich. Et une femelle non identifiée de Phytoseiidae (c'est la première fois qu'un acarien cunaxidé est signalé sur un mammifère)[316].
En 1991, 8 espèces d'arthropodes (dont Platypsyllus castoris Rit.) avaient donc été observées chez le Castor d'Europe en Pologne[316].
Endoparasites
modifierLes vétérinaires amenés à soigner des castors ou à préparer les réintroductions ou translocations connaissent plusieurs endoparasites[318]. Divers œufs d'helminthes ont été observés dans des selles de castors, mais beaucoup moins que chez les autres rongeurs, semble-t-il[319].
-
Apothicaire en manteau à col de fourrure de castor (1526)
-
Konrad Rehlinger (de) en manteau de castor
-
Catherine II en tricorne de castor
-
La mode des chapeaux haut de forme, bicornes et tricornes en feutre de poils de castor a renforcé la demande européenne en peaux, réorientée vers l'Amérique
Voir aussi
modifierArticles connexes
modifier- Castor (genre)
- Mammalogie
- Zone humide
- Espèce ingénieur
- Hutte
- Noms de lieux dus à cet animal: voir les pages consacrées à:
Liens externes
modifier- Le Pays des Castors et cartographie nationale avec Carmen
- beaverwatch - Suivi du castor en Suisse
- Colonisation de Castor fiber
- publications du réseau Castor/ONCFS
Document radiophoniques
modifier- Interview pour une émission radiophonique d'une ingénieure d'étude de l'ONCFS, sur le thème Castors et loutre sur la Loire (podcast / MP3) :
Bibliographie
modifierOuvrages généraux ou de vulgarisation
modifier- Maurice Blanchet, Le Castor et son royaume (Le Roman de Bièvre), Le castor du Rhône chez lui et la réintroduction en Suisse d'une espèce disparue, Bâle, Ligue Suisse pour la protection de la nature, 1977, 242 p., (ISBN 978-3-85587-002-8) (et aussi : Delachaux et Niestlé, Paris et Neuchâtel)
- M Catusse ; A Lombardi, « Le castor en France. Histoire d'une reconquête », Le Courrier de la Nature, 2011, 263 p., p. 20-25
- P. Cordier-Goni, Castors du Rhône, 1947, Paris, Albin Michel, 254 p.
- P. Déom, Journal La hulotte, (no 85, p. 87 et 90.Plusieurs numéros sont consacrés au castor.
- G. Erome, Contribution à la connaissance éco-éthologique du castor dans la vallée du Rhône, Université Claude Bernard, 1982.
- Fédération des clubs CPN (2006) Sur la piste du castor, Petit cahier des indices de présence du castor et conseils d'observation, Cahier de la gazette de terrier no 109 CPN, (ISBN 2-9521382-3-0), 82 p.
- M. S. Jacquat, Le Castor Cahier du MNHC no 9 MNHC Ed. de la Girafe, 64 p., (ISBN 2-88423-045-9).
- Jean-Pierre Jost ; Yan-Chim Jost, Le Castor ingénieux bâtisseur, Bière, Cabédita, Coll. Regard et Connaissance, 2011, (ISBN 978-2-88295-603-3).
- G Larnac, Le castor, Petits secrets d'un patrimoine oublié, Préfacé par Laurent Ballesta, Ed : Nouvelles Presse du Languedoc, 2013, 152 p., (ISBN 978 2 35414 095 3).
- La Salamandre Sur les traces du castor, mini guide no 57, La Salamandre
- La Salamandre Le castor entre deux mondes no 211 - août-septembre 2012
- Bernard Richard, Les Castors, Paris, Balland, 1980, 171 p., (ISBN 978-2-7158-0274-2).
- Paul Henry Plantain, Aux pays des castors, Paris, Stock nature , 1975, 244 p., (ISBN 978-2-23400-268-5).
- Véron G (1992) Les castors, Lausanne, Payot, Coll. Atlas visuels, (ISBN 2-601-02226-4).
Littérature scientifique
modifier- Angst C. (2010) Vivre avec le castor. Recensement national de 2008, Perspectives pour la cohabitation avec le castor en Suisse, Connaissance de l'environnement, 1008. Office fédéral de l'environnement (OFEV, Berne) et Centre Suisse de Cartographie de la Faune (CSCF), Neuchâtel. PDF, 158 pages.
- Baguette T (1995) Le Castor : un instrument de gestion pour les fonds de vallée en Belgique. 2. Étude des potentialités d'accueil du castor dans deux systèmes hydrographiques fagnards, la vallée de la Roer et l'amphithéâtre des sources de la Vesdre. Cahiers éthologiques, vol. 15, no 1, p. 47-70.
- Batbold J, Batsaikhan N, Shar S, Amori G, Hutterer R, Kryštufek B, Yigit N, Mitsain G, Muñoz LJP, (2008) Castor fiber. In: IUCN (2010) IUCN Red List of Threatened Species. Version 2010.1. (www.iucnredlist.org)
- Pierre Cabard, Le castor, répartition, description, habitat, mœurs, observation, Paris, Delachaux Niestlé, coll. « Les sentiers du naturaliste », , 192 p..
- Campbell-Palmer R & Rosell F (2003), Captive Management Guidelines for Eurasian Beavers (Castor fiber), (ISBN 978-0-9513423-5-0).
- Campbell RD, Frank Rosell, Bart A. Nolet & VA Dijkstra (2005) Territory and group sizes in Eurasian beavers (Castor fiber): echoes of settlement and reproduction?. Behavioral Ecology and Sociobiology, 58(6), 597-607.
- Dewas & al. (2012) Le statut de Castor fiber et Castor canadensis en France et dans les pays voisins, Mammal Review (42), no 2, p. 144-165 (résumé).
- FRAPNA Rhône (2007) Cahier Nature culture castor 35p
- Ducroz JF, Stubbe M, Saveljev AP, Heidecke D, Samjaa R, Ulevicius A, Stubbe A, Durka A (2005) Genetic variation and population structure of the Eurasian Beaver Castor fiber in Eastern Europe and Asia. Journal of Mammalogy, 86(6): 1059-1067 (résumé).
- Erome G (1982) Contribution à la connaissance éco-éthologique du castor dans la vallée du Rhône, Université Claude Bernard.
- Esteve R (1988) http://rhone-alpes.lpo.fr/images/bievre/b87t9n2_03.pdf Analyse de la mortalié du castor (Castor fiber) en Haute-Savoie] (PDF, 6 p.)
- Fortin C, Laliberté M, Ouzilleau J (2001) Guide d'aménagement et de gestion du territoire utilisé par le castor au Québec, Ste-Foy, Fondation de la faune du Québec: 112 p
- Haarberg O, Rosell F (2006) Selective foraging on woody plant species by the Eurasian beaver (Castor fiber) Telemark, Norway. J Zool, no 270, p. 201-208. doi:10.1111/j.1469-7998.2006.00142.x
- D. Halley ; F. Rosell ; A. Saveljev, « Population and distribution of Eurasian beaver (Castor fiber) », Baltic Forestry, vol. 18 no 1, 2012, p. 168-175.
- Herr J (2009) Determining the sex and species of beavers (Castor sp.) based,
- Gamborg C, Sandøe P, Forest D & Kongevej H (2004) Beavers and biodiversity: the ethics of ecological restoration. Sustainability and biodiversity: Ethical perspectives on forest management, 135.
- Gaudemer B & Tharrault J, « Répartition du Castor d'Europe (Castor fiber) dans le Maine-et-Loire », Anjou Nature, 2008, no 2, p. 5-9.
- Gaudemer (2009) Castor d'Europe, dans Marchadour B. (coord). Mammifères, Amphibiens et Reptiles prioritaires en Pays de la Loire. Coordination régionale LPO Pays de la Loire, Conseil régional des Pays de Loire, p. 62-63.
- Gétaz D, Hunkeler P, Neet C, Rapin P (1993) Le castor: mode d'emploi. Centre de conservation de la faune, d'écologie et d'hydrobiologie appliquées de l'État de Vaud: 8 p.
- Halley DJ & Frank Rosell (2002) The beaver's reconquest of Eurasia : Status, population development, and management of a conservation success. Mammal Review, 2002, vol. 32, no 3, p. 153-178.
- (en) Duncan Halley et Frank Rosell, « Population distribution of European beavers (Castor fiber) », Lutra, no 46, , p. 91-101 (lire en ligne, consulté en ).
- Halley DJ (2009) Non-lethal methods of beaver impact management : a review. Conférence, 5th International Beaver Symposium. Dubingiai, Lituanie, 20 au 23 septembre 2009.
- Göran Hartman, « Long-term population development of a reintroduced beaver (Castor fiber) population in Sweden », Conservation Biology, 1994, vol. 8, no 3, p. 713-717.
- Lafontaine L (1995) Gestion des zones humides et des habitats rivulaires en faveur des mammifères semi-aquatiques d'intérêt communautaire (Loutre d'Europe, Castor, Vison d'Europe) : Mesures agri-environnementales, Fonds de Gestion de l'Espace Rural, Loi sur l'eau (SAGES), Directive Habitats (Réseau Natura 2000), Rapport Programmes européens objectif 5b/PNR d'Armorique/Conseil Général du Finistère l
- L. Lafontaine (coord.) et al., 2000. Dispersion des populations de castors Castor fiber galliae dans réintroduits dans les Monts d'Arrée (Finistère). Groupe Mammalogique Breton, PDF, 61 p.
- Jean Lamoureux, Claude Larocque et Alain Pelletier, « Guide de gestion de la déprédation du castor » [PDF], sur grobec.org, Ministère des ressources naturelles et de la faune, (consulté en )
- Leau W, Léger F & Landray (2006) Situation actuelle de l'aire de répartition du castor d'Europe sur les bassins versants Seine Normandie, Rhin Meuse et haut bassin de la Saône.
- Léger F (1995) Bilan de la réintroduction du castor Castor fiber en 1965/67 dans la région du Der (52 - Haute-Marne), O.N.C, C.N.E.R.A., Prédateurs et animaux déprédateurs, Gerstheim.
- Bart A. Nolet et Frank Rosell, « Comeback of the beaver Castor fiber : An overview of old and new conservation problems », Biology Conservation, vol. 83, no 2, , p. 165-173 (lire en ligne, consulté en ).
- OFEFP (2004) Concept Castor Suisse, Office fédéral de l'environnement, des forêts et du paysage, Berne: 6 p.
- ONC (1984) Piégeage en vue de la réintroduction de castors, Bulletin Mensuel de l'ONC, no 78
- ONC (1989) Réintroduction du castor en France, Bulletin Mensuel de ONC no 132
- ONCFS (2003) Le Castor sur le bassin de la Loire et en Bretagne. ONCFS Publication : 48p.
- ONCFS (2010) Le castor et la loutre sur le bassin de la Loire, Réseau des mammifères du bassin de la Loire, PDF, 84 p.
- ONCFS, Catusse M & Dubrulle PM (2013) Réintroduction du Castor en France, Recommandations, conseils et réglementation , Direction des études et de la Recherche, Centre National d'Études et de Recherche Appliquée Sur les Prédateurs et les Animaux Déprédateurs, aout 2013 (PDF, pages)
- Pilley M & Pailley P (1994), Évolution récente des populations de castors sur la Loire. Erminea, 18 : 16-18.
- Rahm U & Bättig M (1996) Le castor en Suisse. Recensement, menaces, protection. Office fédéral de l'environnement des forêts et du paysage, Berne, Cahiers de l'environnement no 249, 68 p.
- (en) Frank Rosell, Orsolya Bozsér, Peter Collen et Howard Parker, « Ecological impact of beavers Castor fiber and Castor canadensis and their ability to modify ecosystems », Mammal Review, vol. 35, nos 3-4, , p. 248-276 (DOI 10.1111/j.1365-2907.2005.00067.x, lire en ligne, consulté en ).
- Reichholf J (1999), Le retour des castors : Surprises écologiques, Paris, Flammarion, traduction de Reichholf J. (1993) : Comeback der Biber : Ökologische Überraschungen. Munich (CH beck).
- Richier A & Sarat E (2011) Le castor et la loutre sur le bassin de la Loire. Synthèse des connaissances 2010, Ouvrage collectif.
- Frank Rosell, Howard Parker et Ø Steifetten, « Use of dawn and dusk sight observations to determine colony size and family composition in Eurasian beaver Castor fiber », Acta Theriologica, vol. 51, no 1, , p. 107-112 (lire en ligne, consulté en ).
- Rouland P (1983) Le Castor (Castor fiber L.) , brochure ONC
- Philippe Rouland, « La réintroduction du Castor en France », Le Courrier de la cellule Environnement de l'INRA, no 14, , p. 35-42 (lire en ligne [PDF], consulté en )
- Rouland P et al. (1992) « Essai de synthèse nationale sur la réintroduction du castor en France et perspectives », dans Colloque francophone de Mammologie, Ann. Biol. Centre : 33-57.
- Rouland P & Migot P (1990) « La réintroduction du Castor (Castor fiber L.) en France. Essai de synthèse et réflexions », Revue d'Écologie (Terre Vie)- suppl.5 : 145-148.
- Rouland P & Migot P (1997) « Le castor dans le Sud-Est de la France », Office National de la Chasse et de la Faune Sauvage, Paris, 51 p.
- Rouland P, Léonard Y, Migot P & Landry P (2003) « Le castor sur le bassin de la Loire et en Bretagne », Office National de la Chasse et de la Faune Sauvage, Paris.
- Schmitt V & Groupe d'étude des Mammifères de Lorraine (2007) « Le castor européen" (Castor fiber L.) en vallée de la Moselle depuis sa réintroduction en 1983
- Ulmer A, 1999. Recolonisation récente du département de la Loire, en aval de Villerest, par le Castor d'Europe Castor fiber L. Le Bièvre, 16 : 81-82.
- Varray S (2011), Étude des continuités écologiques du Castor et de la Loutre sur le bassin de la Loire : Analyse de la franchissabilité des obstacles à l'écoulement, ONCFS, février 2011
- Varray Sylvie, Étude des continuités écologiques du castor et de la loutre sur le bassin de la Loire : analyse de la franchissabilité des obstacles à l'écoulement (à partir du référentiel des obstacles à l'écoulement (ROE), piloté par l'ONEMA), ONCFS (Délégation interrégionale Centre – Île-de-France), février 2011.
- Géraldine Veron, « Histoire biogéographique du castor d'Europe (Castor fiber) », Mammalia, vol. 56, no 1, , p. 87-108 (ISSN 1864-1547 et 0025-1461, DOI 10.1515/mamm.1992.56.1.87, lire en ligne, consulté en ).
- Winter C. (2001) Données de base d'une protection coordonnée du castor, L'environnement pratique, OFEFP, 3003 Berne: 68 p.
- Adrian Zwolicki, « European Beaver Castor fiber — a keystone species for the river valley ecosystems », Ecology Questions, no 6, , p. 106-109.
- Nouvelle publication sous le même titre :
- Pawel Janiszewski, Vladimír Hanzal et Wojciech Misiukiewicz, « European Beaver Castor fiber — a keystone species for the river valley ecosystems », Baltic Forestry, vol. 20, no 2, , p. 277 - 286 (lire en ligne [sur researchgate.net], consulté en ).
- Collectif, Une place pour les mammifères des zones humides et des cours d'eau, Agence de l'eau Loire-Bretagne, , 42 p. (présentation en ligne, lire en ligne [PDF] sur donnees-documents.eau-loire-bretagne.fr).
Vidéographie
modifier- vidéos sur le castor
- Le castor d'Europe: des Ramières de la Drôme au Rhône.
Références taxonomiques
modifier- (fr) Référence INPN : Castor fiber Linnaeus, 1758 (TAXREF)
- (en) Référence Mammal Species of the World (3e éd., 2005) : Castor fiber Linnaeus, 1758 (consulté le )
- (en) Référence Animal Diversity Web : Castor fiber (consulté le )
- (fr + en) Référence CITES : espèce Castor fiber Linnaeus, 1758 ssp. birulai Serebrennikov, 1929 (+ répartition) (sur le site de l’UNEP-WCMC) (consulté le )
- (fr) Référence CITES : taxon Castor fiber (sur le site du ministère français de l'Écologie) (consulté le )
- (fr) Référence DORIS : espèce Castor fiber (consulté le )
- (en) Référence Fauna Europaea : Castor fiber Linnaeus, 1758 (consulté le )
- (fr + en) Référence ITIS : Castor fiber Linnaeus, 1758 (consulté le )
- (en) Référence NCBI : Castor fiber (taxons inclus) (consulté le )
- (en) Référence Paleobiology Database : Castor fiber Linnaeus 1758 (consulté le )
- (en) Référence UICN : espèce Castor fiber (consulté le )
Notes et références
modifier- « Page consacrée au Castor »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur oncfs.gouv.fr, Office national de la chasse et de la faune sauvage (consulté le ) - site disparu ; cliquer sur « Archive.is » pour voir la page archivée.
- « Le Castor d'Europe », fiche 1337 [PDF], sur inpn.mnhn.fr, INPN (consulté en ).
- [Nolet 1997] Bart A. Nolet, La gestion du castor (Castor fiber) : vers la restauration de son ancienne répartition et de sa fonction écologique en Europe, Council of Europe, , 34 p., sur books.google.fr (lire en ligne).
- Lahti, S. & Helminen, M. (1974) The beaver Castor fiber (L.) and Castor canadensis (Kuhl) in Finland. Acta Theriologica, no 19, p. 177-189.
- (de) Gustav Hinze, Der Biber. Körperbau und Lebensweise, Verbreitung und Geschichte, Berlin, Akademie Verlag, , VIII + 216 (présentation en ligne).
- (en) Michael Aleksiuk et Ian McTaggart Cowan, « Aspects of seasonal energy expenditure in the beaver (Castor canadensis) », Canadian Journal of Zoology, vol. 47, , p. 471-481 (résumé).
- E.P Hill, « Beaver (Castor canadensis) », dans J. A. Chapman & G. A. Feldhamer, Wild mammals of North America, Baltimore / London, Johns Hopkins University Press, , p. 256-281.
- « Le castor », Les cahiers Nature-Culture, sur frapnaardeche.files.wordpress.com (consulté en ).
- Frahnert S & Heidecke D (1992), Kraniometrische Analyse eurasischer Biber, Castor fiber L. (Rodentia, Castoridae) - Erste Ergebnisse, dans Materialen des 2. Internationalen Symposiums Semiaquatische Säugetiere, ed. R. Schröpfer, p. 175-189. Martin-Luther-Universität, Halle/Saale ; 15 p. (fiche Get Info).
- (de) Heidecke D (1986) « Taxonomical aspects of species conservation exemplified with the Eurasian beaver », Hercynia, N.F., n° 2, p. 146–161.
- Richard PB (1978) « Recherches sur la vision du Castor (C. fiber et C. canadensis). I. La discrimination chromatique ». Mammalia, vol. 42, n° 3, p. 365-376 (résumé).
- Keller A (1983), « Étude comparative des différentes structures pileuses du Castor canadensis (Kuhl) et du Castor fiber Linné (Mammalia, Castoridae) », Revue Suisse de Zoologie, no 90, p. 183-189.
- Henri Agasse (1794), Encyclopédie méthodique : Dictionnaire de toutes les espèces de chasses, Paris, Henri Agasse, 456 p. (lire en ligne, sur books.google.fr.
- Richard PB (2009), « Les pattes du Bièvre (Castor fiber) », Mammalia, vol. 22, nos 1-4, novembre 2009, p. 566-574, ISSN (Online) 1864-1547, ISSN (Print) 0025-1461, DOI: 10.1515/mamm.1958.22.1-4.566.
- Steen I & Steen JB (1965), « Thermoregulatory importance of the beaver's tail », Comp. Biochem. Physiol., vol. 15, p.267-270 (2855) (résumé).
- Zahner, Volker;, & Müller, Reinhold (2003). Thermoregulation — a main function of the beaver tail, dans Proc 3rd International Beaver Symposium, VZZ, Arnhem (poster).
- Kühn, Ralph, Schwab, Gerhard, Schröder, Wolfgang, & Rottmann, Oswald (2002). « Molecular sex diagnosis in Castoridae », Zoo Biology, vol. 21, n° 3, p. 305-308 (résumé).
- Fiona Sharpe, R. Rosell (2003), « Time budgets and sex differences in the Eurasian beaver », Animal Behaviour, vol. 66, n° 6, p. 1059-1067 (résumé).
- Rosell F & Schulte BA (2004) Sexual dimorphism in the development of scent structures for the obligate monogamous Eurasian beaver (Castor fiber). Journal of mammalogy, 85(6), 1138-1144 (résumé).
- Osborn, D. J. (1955), Techniques of sexing beaver, Castor canadensis. Journal of Mammalogy, 36(1), 141-143 (résumé).
- Rosell, Frank, & Sun, Lixing (1999). « Use of anal gland secretion to distinguish the two beaver species Castor canadensis and C. fiber », Wildlife Biology, vol. 5; n° 2, p. 119-123 (résumé).
- « Le Castor », sur larousse.fr, Encyclopédie Larousse (consulté en ).
- Gravure illustrant l'article de Buffon sur le castor dans Buffon et Daubenton (ill. Jacques de Sève, gravure de Juste Chevillet), L'Histoire naturelle, générale et particulière, avec la description du cabinet du Roy, t. 8 : Quadrupèdes V, Paris, Imprimerie royale, (lire en ligne), p. 332, Planche XLII.
- Gravure dans Buffon & Daubenton 1760, p. 332, Planche XL.
- [Horn et al. 2011] (en) Susanne Horn, Walter Durka, Ronny Wolf, Aslak Ermala, Annegret Stubbe, Michael Stubbe et Michael Hofreiter, « Mitochondrial genomes reveal slow rates of molecular evolution and the timing of speciation in beavers (Castor), one of the largest rodent species », PloS one, vol. 6, no 1, , e14622 (lire en ligne [sur journals.plos.org], consulté en ).
- « Genre Steneofiber Geoffroy, 1833 », sur vertebresfossiles.free.fr (consulté en ).
- Veron G (1992), Histoire biogéographique du castor d'Europe, Castor fiber (Rodentia, Mammalia). Mammalia, 56(1), 87-108 (résumé).
- Samuels, J. X., & Zancanella, J. (2011). An Early Hemphillian Occurrence of Castor (Castoridae) from the Rattlesnake Formation of Oregon. Journal of Paleontology, 85(5), 930-935 (résumé) [PDF].
- Rybczynski, N. (2008). Woodcutting behavior in beavers (Castoridae, Rodentia): estimating ecological performance in a modern and a fossil taxon. Paleobiology, 34(3), 389-402.
- Stefen, C. (2011). A Brief Overview of the Evolution of European Tertiary Beavers. Baltic Forestry, 17(1), 148-153 [PDF], 6pp.
- Zharkov IV & Sokolov VE (1967) « The Europeanbeaver (Castor fiber Linnaeus, 1758) in the Soviet Union ». Acta Theriologica , no 12, p. 27-46.
- Djoshkin WW & Safonov WG (1972) Die Biber deralten und neuen Welt. A. Ziemsen Verlag, Wittenberg.
- Barisone, G., Argenti, P., & Kotsakis, T. (2006). Plio-Pleistocene evolution of the genus Castor (Rodentia, Mammalia) in Europe : C. fiber plicidens of Pietrafitta (Perugia, Central Italy). Geobios, 39(6), 757-770.([1]).
- Halley DJ (2011). « Sourcing Eurasian beaver Castor fiber stock for reintroductions in Great Britain and Western Europe » ; Mammal review, 41(1), 40-53.
- Durka, W, Babik W, Ducroz JF, Heidecke D, Rosell F, Samjaa R… & Stubbe M (2005), Mitochondrial phylogeography of the Eurasian beaver Castor fiber L. Molecular Ecology, 14(12) 3843-3856.[PDF], 15 pages.
- [Liarsou 2005] Alexandra Liarsou, Un exemple de biodiversité historique : le castor (Castor fiber) et la loutre (Lutra lutra) en France depuis 18 000 ans (mémoire de DEA), Université Paris I Panthéon-Sorbonne, , 152 p..
- [Liarsou 2012] Alexandra Liarsou, Contribution de l'archéologie à la réflexion sur le partage entre nature et culture et mise en perspective des stratégies de gestion de la biodiversité : analyse de quelques interactions entre les sociétés humaines et d'autres espèces animales (thèse de doctorat sciences humaines / sciences de la nature), Université Paris I-Panthéon Sorbonne, , 699 p..
- M. Magny, « Holocene fluctuations of lake levels in the French Jura and Subal pine ranges and their implications for past general circulation patterns », The Holocene, no 3, p. 306-313.
- [Wright, Flecker & Jones 2002] (en) Justin P. Wright, Alexander S. Flecker et Clive Garrett Jones, « An ecosystem engineer, the beaver, increases species richness at the landscape scale », Oecologia, no 132, , p. 96-101 (lire en ligne [sur researchgate.net], consulté en ).
- [Larsen, Lane & Larsen 2017] (en) Annegret Larsen, Stuart Lane et Joshua Larsen, « A global review on the influence of beavers (Castor fiber, Castor canadensis) on river and floodplain dynamics », proceedings of the EGU General Assembly Conference held 23-28 April, 2017 in Vienna, Austria, vol. 19, , p. 17714 (résumé).
- Medwecka-Kornas A. & Ha Wro R (1993), Vegetation on beaver dams in the Ojcow National Park (Southern Poland), Phytocoenologia, 23 : 611 - 618.
- [Nyssen, Pontzeele & Billi 2011] (en) Jan Nyssen, Jolien Pontzeele et Paolo Billi, « Effect of beaver dams on the hydrology of small mountain streams : example from the Chevral in the Ourthe Orientale basin, Ardennes, Belgium », Journal of hydrology, vol. 402, nos 1-2, , p. 99-102 (lire en ligne [PDF] sur academia.edu, consulté en ).
- Duval J, Callou C & Horard-Herbin MP (2011), Le castor Castor fiber Linnaeus, 1758 en France. Étude archéozoologique. Anthropozoologica, 46(2), 7-39. autre lien vers l'article.
- [Larsiou 2013b] Alexandra Liarsou, « Incidence des activités du castor (C. fiber L.) sur la dynamique d'évolution morphologique des rivières au Tardiglaciaire et durant l'Holocène en France : tentative de réinterprétation de quelques résultats d'analyse de dépôts alluvionnaires » [PDF] (pré-publication, document de travail), sur halshs.archives-ouvertes.fr, (présentation en ligne, consulté en ).
- Tolksdorf, J. F., Turner, F., Veil, S., Bittmann, F., & Breest, K. (2017). Beaver (Castor fiber) Activity in an Archaeological Context: A Mid-Holocene Beaver Burrow Feature and a Late-Holocene Ecofact at the Late Palaeolithic Grabow Site, Northern Germany. Journal of Wetland Archaeology, 17(1), 36-50.
- Johannes Marius, Johannes Francus, Marc Antoine Eidous (1746) 'Traité du castor, dans lequel on explique la nature, les propriétés et l'usage médico-chymique du castoreum dans la médecine' ([Livre numérique Google] ou Autre version).
- (Bestiarium – « de castore et natura ejus « ; Bibliothèque nationale de France, ms. Latin 6838 B, fol 5v.
- Pline l'Ancien, livre XXXII (p. 421 dans la version : Pline l'Ancien, traduit par Poinsinet de Sivry (1778) Histoire naturelle de Pline traduite en françois, avec le texte latin rétabli d'après les meilleures leçons manuscrites ; accompagnée de Notes critiques pour l'éclaircissement du texte, et d'Observations sur les connoissances des anciens comparées avec les découvertes des modernes. Tome Premier-Douzième [par Louis Poinsinet de Sivry. A. G. Meusnier de Querlon, J. E. Guettard et autres] (Livre numérique Google).
- bestiaire de Pierre de Beauvais au chapitre « Castor « (Bestiarium – « de castore et natura ejus « ; Bibliothèque Nationale de France, ms. Latin 6838 B, fol 5v).
- Cabard 2009.
- Traduction faite par Bianciotto, Gabriel (1980), dans Bestiaires du Moyen Âge, mis en français moderne et présentés ; Paris, Stock.
- Dioscoride, Mathée (1580), livre 2 ; Les Six livres de Pedacion Dioscoride Anazarbeen, De la Matière medicinale… relueus et corrigez outre les precedentes impressions. Mis en françois [du latin] par Martin Mathée, Medecin [auteur de l'ép. déd. à Charles, card. de Lorraine, archev. de Reims, et de : Description de plusieurs simples non mentionnez par Dioscoride] ; pour Loys Cloquemin, 1580 - 2 pages (Livre numérique Google).
- traité du Castor de Marius, Traité du Castor de Marius (1746).
- Moyse Charas, Anisson & Posuel (1717) Pharmacopée royale galenique et chymique (Livre numérique Google) (Lyon) chez Anisson & Posuel, 884 pages.
- Boessneck J (1974), Ergänzungen zur einstige Verbreitung des Bibers, Castor fiber (Linné, 1758). Säugetierkundliche Mitteilungen, 22 (1974), p. 83-88.
- Warren, E. R. (1927). The Beaver-its Work and Ways. The Williams and Wilkins Company, Baltimore. Monographs of the American Society of Mammalogists, 2. (cité par Veron G, 1992).
- Libois RM (1982), Atlas des mammifères sauvages de Wallonie (1re partie). cahiers Ethol. appl., 2 (suppl 1-2): 207 p.
- Gervais-François Magné de Marolles (1788), La Chasse au fusil : ouvrage divisé en deux parties ; Barrois (voir p. 308 sur 582) (Livre numérique Google).
- Tous les castors, européen et américain, modifient leur environnement en créant des marais, et nombreux sont les marais créées par eux dans notre géographie : Lewis Henry Morgan, Le castor américain, Les presses du réel, Dijon, 2010.
- Valette, M. G. (1963). La présentation des richesses artistiques de la Faculté: Conférence de Mme G. Valette et visite. Revue d'histoire de la pharmacie, 51(177), 103-116.
- Source carte de Cassini: GenCom - Carte de Cassini , no 1 et plan d'Intendance : étang de La Minièrehttp://www.cg78.fr/archives/seriec/db/notices/365.htm.
- (en) Frank Rosell, Orsolya Bozsér, Peter Collen et Howard Parker, « Ecological impact of beavers Castor fiber and Castor canadensis and their ability to modify ecosystems », Mammal Review, vol. 35, nos 3-4, , p. 248-276 (DOI 10.1111/j.1365-2907.2005.00067.x, lire en ligne, consulté en )
- Lavrov LS & Orlov VN (1973), Karyotypes and taxonomy of modern beavers (Castor, Castoridae, Mammalia). Zoologische Zhurnal, no 52, p. 734-742.
- Graphodatsky AS (2006), Castor fiber. In: O_Brien SJ, Nash WG, Menninger JC, eds. Atlas of Mammalian Karyotypes. New Jersey: Wiley, p. 182.
- Sieber J, Suchentrunk F et Hart, GB (1999) A biochemical – genetic discrimination method for the two beaver species, Castor fiber and Castor canadensis, as a tool for conservation, p. 61-65, dans P. E. Busher and R. M. Dzieciolowski, eds. Beaver protection, management, and utilization in Europe and North America. Kluwer Academic/Plenum, New York.
- Babik, W., Durka, W. & Radwan, J. 2005. Sequence diversity of the MHC DRB gene in the Eurasian beaver (Castor fiber). Mol. Ecol. 14: 4249-4257 (résumé), PDF, 9 p.
- Graphodatsky AS, Yang F, Dobigny G, Romanenko SA, Biltueva LS, Perelman PL… & Robinson TJ (2008), Tracking genome organization in rodents by Zoo-FISH. Chromosome Research, 16(2), 261-274.
- Pelz-Serrano K, Munguia-Vega A, Piaggio AJ, Neubaum M, Munclinger P, Pártl A, Van Riper III C & Culver M (2009), Development of nine new microsatellite loci for the American beaver, Castor canadensis (Rodentia: Castoridae), and cross-species amplification in the European beaver, Castor fiber. Culver M. Mol Ecol Resour. 2009 Mar; 9(2):551-4. Epub 2009 Jan 31.
- GabrysG, Wasna A (2003) Subspecies of the European beaver Castor fiber Linnaeus, 1758. Acta Theriologica, 48, 433-439.
- Ducroz, J.-F.; Stubbe, M.; Saveljev, A. P.; Heidecke, D.; Samjaa R.; Ulevicius, A.; Stubbe, A. & W. Durka (2005), Genetic variation and population structure of the Eurasian beaver Castor fiber in eastern Europe and Asia ; Journal of Mammalogy 86 (6): 1059-1067. (3581) (résumé).
- Babik, W., Durka, W., & Radwan, J. (2005). Sequence diversity of the MHC DRB gene in the Eurasian beaver (Castor fiber). Molecular Ecology, 14(14), 4249-4257 (http://onlinelibrary.wiley.com/doi/10.1111/j.1365-294X.2005.02751.x/abstract?deniedAccessCustomisedMessage=&userIsAuthenticated=false résumé]) [PDF].
- Denk, M., Haase, P., Jung, J., & Lohse, S. Europäischer Biber Castor fiber (L., 1758).
- Ducroz, J. F., Stubbe, M., Saveljev, A. P., Heidecke, D., Samjaa, R., Ulevičius, A.… & Durka, W. (2005). Genetic variation and population structure of the Eurasian beaver Castor fiber in Eastern Europe and Asia. Journal of Mammalogy, 86(6), 1059-1067 (résumé).
- Kautenburger, R., & Sander, A. C. (2009). Population genetic structure in natural and reintroduced beaver (Castor fiber) populations in Central Europe. Animal Biodiversity and Conservation, 31(2), 25-35.
- Saveljev, A. & Milishnikov, A. (2002) Biological and genetic peculiarities of cross-composed and aboriginal beaver populations in Russia Acta Zoologica Lituanica, no 12, p. 397-402.
- Ernst, M., Putnová, L., Štohl, R., & Matoušková, J. (2017). Comparison of Czech and Latvian Beaver Population by Microsatellite Analysis and Genetic Differences between Castor Fiber and Castor Canadensis. Transylvanian Review, 1(7)|résumé.
- Aldous SE (1938). Beaver Food Utilization Studies. Journal of Wildlife Management 2: 215-222.
- O'Connell MJ, AtkinsonSR, Gamez K, Pickering SP & Dutton JS (2008), « Forage preferences of the European beaver Castor fiber: implications for re-introduction ; Conservation and Society, 6(2), 190.
- Basey, J.M., Jenkins, S. H. and Busher, P.E. (1988), « Optimal central-place foraging by beavers: tree-size selection in relation to defensive chemicals of quaking aspen ». Oecologia 76: 278-282.
- Jenkins SH et Miller GC (1990) « Food selection by beavers in relation to inducible defenses of Populus tremuloides ». - Oikos 59: 5742 (résumé).
- (en) Gary E. Belovsky, « Summer Diet Optimization by Beaver », American Midland Naturalist, vol. 111, no 2, , p. 209-222 (lire en ligne [PDF], consulté en ).
- Flagham Fen lake sur le Lower Mill Estate près de Somerford Keynes, dans le complexe de zones humides issues d'anciennes gravières dit « les 146 lacs » (formant le « Cotswold Water Park ») dans le Gloucestershire, dans le sud de l'Angleterre (source).
- O'Connell M J, Atkinson S R, Gamez K, Pickering S P, Dutton J S (2008), « Forage Preferences of the European Beaver Castor fiber: Implications for Re-introduction ». Conservat Soc, vol. 6, p. 190-4.
- Haarberg O et Rosell F (2006), Selective foraging on woody plant species by the Eurasian beaver (Castor fiber) in Telemark, Norway. J. Zool. (Lond.) 270: 201-208.
- Emannuelle Sarat, ingénieur à l'ONCFS, « Castor et loutre : deux espèces semi-aquatiques à observer en bord de Loire », émission Canal Académies, 10 février 2013.
- Nolet BA, & Rosell F. (1994) Territoriality and time budgets in beavers during sequential settlement. Canadian Journal of Zoology, 72(7), 1227-1237 ([PDF], 11p)(résumé).
- (en) Angela M. Gurnell, « The hydrogeomorphological effects of beaver dam-building activity », Progress in Physical Geography, vol. 22, no 2, , p. 167-189 (résumé).
- A. Currier, W. D. Kitts, I. McT. Cowan (1960), Cellulose digestion in the beaver (Castor canadensis) ; Canadian Journal of Zoology, Vol. 38, no 6 : p. 1109-1116 (doi: 10.1139/z60-115).
- Fryxell, J.M., S.M. Vamosi, R.A. Walton et al. (1994), « Retention time and the functional response of beavers ». Oikos 71: 207-214 (résumé/extrait).
- Buech RR (1984), « Ontogeny and diurnal cycle of fecal reingestion in the North American beaver (Castor canadensis) », Journal of Mammalogy no 65-347, p. 50.
- Heidecke, D. (1992), « Protokoll zum Biber-Worshop », dans Materialien des 2. Internationalen Symposiums Semiaquatische Saugetiere (R. Schropfer, M. Stubbe & D. Heidecke, eds.), p. 461-464. martin-Luther Universitat, Halle/Saale.
- « Beaver »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) [PDF], sur anl.de. Voir photo p. 6 du PDF, voir aussi la carte de répartition de la population bavaroise de castors, p. 2.
- Catusse M « Dubrulle P-M (2013) Réintroduction du Castor en France ; Recommandations, conseils et réglementation, aout 2013.
- Rouland 1991, p. 40.
- ONCFS (2012), Bilan 2012 du réseau Castor de l'ONCFS voir notamment, p. 34.
- ONCFS (2012), Bilan 2012 du réseau Castor de l'ONCFS voir tableau, p. 35 sur 97.
- Arjo WM, Joos RE, Kochanny CO, Harper JL, Nolte DL & Bergman DL (2008) Assessment of transmitter models to monitor beaver Castor canadensis and C. fiber populations. Published By: Nordic Board for Wildlife Research, Wildlife Biology, 14(3), 309-317 DOI:https://dx.doi.org/10.2981/0909-6396(2008)14[309:AOTMTM]2.0.CO;2 ; URL: http://www.bioone.org/doi/full/10.2981/0909-6396%282008%2914%5B309%3AAOTMTM%5D2.0.CO%3B2.
- Wheatley M (1997) A new surgical technique for implanting radio transmitters in beavers, Castor canadensis. Canadian Field-Naturalist 111: 601-606.
- Ranheim B, Rosell F, Andreas Haga H & Arnemo JM (2004) Field anaesthetic and surgical techniques for implantation of intraperitoneal radio transmitters in Eurasian beavers Castor fiber.-WildlifeBiology vol. 10, p. 11-15.
- Richard Bernard (1980) Les Castors Ed : Balland ; (ISBN 978-2-7158-0274-2) voir p. 37-41 et 105 sur 171.
- Richard PB (1964). « Les matériaux de construction du Castor (Castor fiber), leur signification pour ce rongeur. » Zeitschrift für Tierpsychologie, 21(5), 592-601 (résumé).
- Graf, P. M., Wilson, R. P., Sanchez, L. C., Hacklӓnder, K., & Rosell, F. (2018). Diving behavior in a free‐living, semi‐aquatic herbivore, the Eurasian beaver Castor fiber. Ecology and Evolution.
- Campbell, R. (2000), Territoriality in the European beaver Castor fiber. University of East Anglia, Norwich, UK.
- Campbell RD, Rosell F, Nolet BA, Dijkstra VAA. (2005), Territory and group sizes in Eurasian beavers (Castor fiber): echoes of settlement and reproduction ? Behav. Ecol. Sociobiol. 58: 597-607.
- Haarberg, O., & Rosell, F. (2006). Selective foraging on woody plant species by the Eurasian beaver (Castor fiber) in Telemark, Norway. Journal of Zoology, 270(2), 201-208.
- FRosell, F., & Czech, A. (2000), Responses of foraging Eurasian beavers Castor fiber to predator odours..
- Aleksiuk M (1968) Scent mound communi cation, territoriality, and population regulation in beaver (Castor canadensis Kuhl). J Mammal, vol. 49, p. 759-762.
- Rosell F & Nolet BA (1997) Factors affecting scent-marking behavior in Eurasian beaver (Castor fiber). Journal of Chemical Ecology, 23(3), 673-689 (résumé) PDF, 32 p.
- Jean-Pierre Quéré et Henri Le Louarn (2011). Les rongeurs de France : Faunistique et biologie ; 3e éd. revue et augmentée. Paris, Quae, p. 36 (éditions précédentes : INRA éditions, collection « Mieux comprendre »).
- Frank Rosell, Liat R. Thomsen, Journal of Chemical Ecology, 2006. Sexual Dimorphism in Territorial Scent Marking by Adult Eurasian Beavers (Castor fiber). 32 (6), 1301 - 1315.
- Frank Rosell, Bruce A. Schulte, Journal of Mammalogy, (2004). Sexual dimorphism in the development of scent structures for the obligate monogamous eurasian beaver (Castor fiber). 85 (6), 1138 - 1144.
- Helga Veronica Tinnesand, Susan Jojola, Andreas Zedrosser, Frank Rosell (2013), The smell of desperadoes? Beavers distinguish between dominant and subordinate intruders ; Behavioral Ecology and Sociobiology (résumé).
- Frank Rosell, Geir Johansen, Howard Parker (2000), Eurasian beavers (Castor fiber) behavioral response to simulated territorial intruders ; Canadian Journal of Zoology, 2000, 78(6): 931-935, 10.1139/z00-037 (résumé).
- Peter Collen et R.J. Gibson, « The general ecology of beavers (Castor spp.) as related to their influence on stream ecosystems and riparian habitats, and the subsequent effects on fish — a review », Reviews in Fish Biology and Fisheries, no 10, , p. 439-461 (DOI 10.1023/A:1012262217012, lire en ligne [PDF], consulté en ).
- (Rosell & Hovde, 1998).
- Rosell et al. 2005, p. 19.
- Rosell et al. 2005, p. 21.
- Lovallo, M. J., Gilbert, J.H. & Gehring, T.M. (1993) Bobcat, Felis rufus, dens in an abandoned beaver, Castor canadensis, lodge. The Canadian Field-Naturalist, no 107, p. 108-109.
- le Thouet angevin, Le castor des marais de Distré fait barrage à la sécheresse, consulté 2012-07-22.
- Benoit Manet (2012); Biologie du castor et évolution de sa présence en Wallonie, novembre 2012, PDF, 2 p.
- (en) Hartman, « Patterns of spread of a reintroduced beaver Castor fiber population in Sweden », Wildlife Biology, vol. 1, no 2, , p. 97-103 (lire en ligne, consulté en ).
- Heidecke D & Ibe P (1997) Der Elbebiber. Biologie und Lebensweise. Biosphiirenreservat « Mittlere Elbe », Dessau, Germany.
- Gurney WSC & Lawton JH (1996), The population dynamics of ecosystem engineers. Oikos 76: 273-283 (résumé/extrait).
- Hartman G (1994) « Long-term population development of a reintroduced population in Sweden », Conservation Biology 8: 713-717.
- Hartman, G. (1994) Ecological studies of a reintroduced beaver Castor fiber population (thèse de doctorat), Swedish University for Agricultural Sciences, Uppsala.
- (en + cy) Duncan J. Halley, Adrian Lloyd Jones, Sarah Chesworth, Chris Hall, Derek Gow, Robert Parry et Jane Walsh, The reintroduction of the Eurasian beaver Castor fiber to Wales: an ecological feasibility study [« Ail-gyflwyniad yr afanc Ewropeaidd Castor fiber i Gymru »] (NINA Report 457), Trondheim, Astudiaeth dichonoldeb ecolegol., (lire en ligne). § 3.1 « Patterns of spread » (p. 23 et suiv.) : concernant les capacités de dispersion.
- Fryxell JM (2001) Habitat suitability and source–sink dynamics of beavers. J. Anim. Ecol. 70: 310-316.
- (canton de Bø, dans le comté du Telemark).
- Parker H, Rosell F, & Gustavsen PØ (2002). Errors associated with moose-hunter counts of occupied beaver Castor fiber lodges in Norway ; Fauna norvegica 22 (2002), no 1, p. 22-31 (https://teora.hit.no/handle/2282/300 résumé]), [PDF], 9pp.
- Rosell, Parker & Steifetten 2006.
- Göran Hartman (1997), Notes on age at dispersal of beaver (Castor fiber) in an expanding population ; Revue canadienne de zoologie, 75(6): 959-962, 10.1139/z97-116 (résumé).
- Illinois EPA, Bevers and muskrats Lake notes.
- Leighton, A.H. (1933) Notes on the relation of beavers to one another and to the muskrat ; Journal of Mammalogy, Vol. 14, No. 1 (Feb., 1933), p. 27-35.
- Danilov PI (1995) Canadian and European beavers in Russian northwest (distribution, number, comparative ecology). In: Proceedings of the Third Nordic Beaver Symposium (Ed. by A. Ermala & S. Lahti), p. 10–16. Iiomats, Finland, 15-17 September 1992. Finnish Game and Fisheries Research Institute, Helsinki.
- Rosell F & Parker H (2011) A population history of the beaver Castor fiber fiber in Norway. Restoring the European Beaver, no 50, p. 19-25.
- Veron 1992.
- Reichholf Josef H (1993) Comeback der Biber : Ökologische Überraschungen. Munich (trad CH beck).
- Ermala, A., Helminen, M. & Lahti, S. (1989) Some aspects of the occurrence, abundance and future of the Finnish beaver population. Suomen Riista, no 35, p. 108-118.
- Daszkiewicz, P. Réflexions sur la politique environnementale de la Pologne Indépendante (1918-1939). Organon, no 26, p. 171-183 (voir chap Réintroduction et reconstruction des espèces menacées ou disparues, p. 180).
- Danilov PI (1992) « Introduction of North-American semiaquatic mammals in Karelia and its consequences for aboriginal species ». Semiaquatische Säugetiere. Wissenschaftliche Beiträge Universität Halle, no 1, p. 267-276.
- Danilov PI & Kan'shiev VY (1983) The state of populations and ecological characteristics of European (Castor fiber L.) and Canadian (Castor canadensis Kuhl.) beavers in the northwestern USSR. Acta Zoo-logica Fennica, no 174, p. 95-97.
- Safonov VG & Saveliev AP (1999) Beavers in CIS : resources, translocation and trapping, dans Proceedings of the First Euro-American Beaver Congress (Ed. by P. Busher & Y. Gorshkov), p. 22-39. First Euro- American Beaver Congress, 24-28 August 1999. Transactions of the Volga-Kama National Nature Zepovednik, Kazan, Russia.
- Richard, P.B. (1985) Peculiarities on the ecology and management of the Rhodanian beaver (Castor fiber L.). Zeitschrift für Angewandte Zoologie, no 72, p. 143-152.
- Bozsér, O. (2001) History and reintroducion of the beaver (Castor fiber) in Hungary, with special regard to the floodplain of the Danube in Gemenc area. In: The European Beaver in a New Millennium (Ed. by A. Czech & G. Schwab), p. 44-46. Proceedings of the Second European Beaver Symposium, 27-30 September 2000, Bialoviecza, Poland. Carpathian Heritage Society, Kraków.
- Sieber, J. (1989) Biber in Oberösterreich: eine aktuelle Bestandsaufnahme an Inn und Salzach. Jahrbücher Oberösterreichischer Museum-Verein, no 134, p. 277-285.
- Kropff, M., Hölzler, G., & Parz-Gollner, R. (2013). Genetic evidence on the origine ot the current beaver (Castor fiber) population in lower Austria. Šumarski list, 137(11-12), 591-596 (résumé).
- Rouland P (1993), Plan d'élaboration d'un dossier de réintroduction ; Charte de recommandations et conseils, mars 2013, PDF 9p.
- Anonyme (1998) « Guidelines for Reintroductions. IUCN », Gland, Switzerland and Cambridge, UK. ([PDF], 10 p.).
- (en) Duncan Halley et Frank Rosell, « The beaver's reconquest of Eurasia: status, population development and management of a conservation success », Mammal Review, vol. 32, no 3, , p. 153-178 (lire en ligne, consulté en ).
- Sørensen CE (2013) Castor fiber på Klosterheden - Populationens udvikling siden reintroduktionen og udvalgte habitatparametres indvirkning på ynglesuccessen (Doctoral dissertation).(PDF, 57 p).
- Lamoureux, Larocque et Pelletier 2007.
- Thomas Ruys, Historique et caractéristiques écologiques du processus d'invasion des ardennes françaises par trois rongeurs aquatiques : le rat musqué (Ondatra zibethicus), le ragondin (Myocastor coypus) et le castor d'Europe (Castor fiber) (thèse de doctorat en Écoéthologie, Alain Marre dir.), Reims, (résumé).
- Rouland 1991, p. 41.
- David W. Macdonald, Fran H. Tattersall, E.D. Brown et D. Balharry, « Reintroducing the European beaver to Britain ; nostalgic meddling or restoring biodiversity? », Mammal Review, no 25, , p. 161-200 (lire en ligne, consulté en ).
- ONCFS (2010), Contribuer à la sauvegarde de la biodiversité > Gestion des dégâts de castor ; Màj. 28/07/2010, consulté 2014-02-01.
- (voir, p. 7/9 de la version PDF).
- Mascanzoni, D (1986), « The aftermath of Chernobyl in Sweden: Levels of 137Cs in foodstuffs » IAEA/INIS, vol. 18, no 20 ; 50 p., SLU-REK--62, (ISBN 91-576-2933-1) résumé voir, p. 18/52.
- Hardman B et Moro D (2006), Optimising Reintroduction Success by Delayed Dispersal : Is the Release Protocol Important for Hare-wallabies ? Biological Conservation 128(3): 403-411 (résumé).
- S. Pupininkas, The State of the Beaver (Castor Fiber) Population and Characteristics of Beaver Sites in Eastern Lithuania ; Acta Zoologica Lituanica ; vol. 9, no 1, janvier 1999, p. 20-2 (résumé).
- Sidorovich, V. E., Tikhomirova, L. L., & Jedrzejewska, B. (2003). Wolf Canis lupus numbers, diet and damage to livestock in relation to hunting and ungulate abundance in northeastern Belarus during 1990-2000. Wildlife Biology, 9(2), 103-111.
- Andersone, Ž., & Ozoliņš, J. (2004). Food habits of wolvesCanis lupus in Latvia. Acta Theriologica, 49(3), 357-367.
- Andersone, Ž. (1999). « Beaver: A New Prey of Wolves in Latvia ? », Beaver Protection, Management, and Utilization in Europe and North America, p. 103-108. Springer US (résumé).
- Thérèse poulain (1983), Note annexe sur l'outillage osseux ; Bulletin de la Société préhistorique française, tome 80, N. 10-12. p. 360.
- Gabriel de Mortillet, Bois incisés de Saint-Andéol ; lien Bulletins de la Société d'anthropologie de Paris ; 1872, vol. 7, no 7 p. 527-533.
- P Garrigou ((1872), Sur les bois incisés du lac Saint-Andéol ([PDF], avec Persée).
- Davies, R. W. (1971). The Roman military diet. Britannia, 2(122), 42.
- Gabriel de Mortillet, Bois incisés de Saint-Andéol ; lien Bulletins de la Société d'anthropologie de Paris ; 1872, vol. 7, no 7 voir notamment p. 529-530.
- Olaûs Magnus, Historia de gentibus septentrionalis, ouvrage in-folio publié à Rome en 1555.
- Brehm, <La Vie des animaux illustrée, mammifères, Tomes II, p. 153-454. Ed. Gerbe.
- Piechocki R (1989) ElbebiberCastor fiber albicus Matschie. [In: Buch der Hege. Band 1. Haarwild. 5. Auflage. H. Stubbe, ed]. VEB Deutscher Landwirtschaftsverlag, Berlin: 588-615.
- Meyer C., ed. sc., 2009, Dictionnaire des Sciences Animales ; consulter en ligne. Montpellier, France, Cirad.
- (en) Murray Wrobel, Elsevier's dictionary of mammals : in Latin, English, German, French and Italian, Elsevier, 2007, 857 p., (ISBN 978-0-44451-877-4). Rechercher dans le document numérisé.
- Voir définition donnée par le Grand dictionnaire terminologique de l'Office québécois de la langue française.
- Schmitt, V. (2007). Le castor européen (Castor fiber L.) en vallée de la Moselle depuis sa réintroduction en 1983. Ciconia, no 31, p. 117-131.
- bièvre sur le site du CNRTL (lire en ligne) [2]
- Xavier Delamarre, Dictionnaire de la langue gauloise, éditions Errance, Paris, 2003, p. 69
- Albert Dauzat et Charles Rostaing, Dictionnaire étymologique des noms de lieux en France, Paris, Librairie Guénégaud, , p. 65a
- François de Beaurepaire (préf. Michel Tamine), Les Noms de lieux du Calvados (annoté par Dominique Fournier), Paris, L'Harmattan, (ISBN 978-2-14-028854-8), p. 101
- (en) A. D. Mills, A Dictionary of British Place Names, Oxford University Press, 2011 (ISBN 9780199609086)
- Pierre Marie Dubrulle, Michel Catusse (2012), Où en est la colonisation du Castor en France ; Faune sauvage (Revue de l'ONCFS), no 297 ; Connaissance & gestion des espèces, [PDF] 12 pages.
- Heidecke D(2014) Taxonomische aspekte des artenschutzes am beispiel der biber Eurasiens. Hercynia-Ökologie und Umwelt in Mitteleuropa, 23(2), 146-161.
- Mammal Species of the World (version 3, 2005), consulté le 24 janvier 2014
- NCBI, consulté le 24 janvier 2014
- [Lavrov & Lavrov 1983] L. S. Lavrov et VL Lavrov, « Osteological differences between the East-European (Castor fiber orientoeuropaeus) and Canadian (C. canadensis) beavers », Zoologicheskiï Zhurnal, no 62, , p. 1434-1436.
- Leguilloux M (2004), Le Cuir et la pelleterie à l'époque romaine, Errance, Paris.
- Jost, J. P., & Jost, Y. C. (2011). Le castor: Ingénieux bâtisseur. Éditions Cabedita.
- Laurioux B (1989) Manger l'impur. Animaux et interdits alimentaires durant le Haut Moyen Âge, dans Couret A. & Oge F., Histoire et animal. Première partie. Des sociétés et des animaux : homme, animal, société. Presses de l'Institut d'études Politiques de Toulouse, Toulouse: 73-87.
- Laurioux B (1988), « Le lièvre lubrique et la bête sanglante ; Réflexions sur quelques interdits alimentaires du haut Moyen Âge ». Anthropozoologica 2 (n° spécial) : 127-132.
- Bonnassie P (1989.), « Consommation d'aliments immondes et cannibalisme de survie dans l'Occident du haut Moyen Âge ». Annales ESC 44(5) : 1035-1056.
- Delort R (1984.), Les animaux ont une histoire. Seuil, Paris.
- Manger au Moyen Âge, Bruno Laurioux, éditions Hachette Pluriel, 2002, p. 115.
- Bianciotto G (1980), Bestiaires du Moyen Âge ; Stock, Paris.
- Delort robert (1978) Le commerce des fourrures en Occident à la fin du Moyen Âge (vers 1300-vers 1450). Rome, École française de Rome. 2 vol. in-8°, LXVI-1383 p., illustrations et planches hors texte (Bibliothèque des Écoles françaises d'Athènes et de Rome, 236.) (ou pdf allégé).
- faune sauvage no 297, 4e trimestre 2012.
- « Page sur l'histoire du castor au Canada », sur lacigogneetlecaribou.kazeo.com (consulté en ).
- page consacrée à l'histoire de Samuel de Champlain, la chute du Québec et la Company of One Hundred Associates (Compagnie des Cent-Associés), qui laisse entendre qu'une seule fourrure de castor semblait avoir plus de valeur qu'une vie humaine à cette époque en France.
- Strivay, L. (2010), Introduction au Castor américain de Lewis Henry Morgan. American Beaver and his Works (résumé).
- (en) Maeva Dewas, Jan Herr, Laurent Schley, Christof Angst, Benoît Manet, Philippe Landry et Michel Catusse, « Recovery and status of native and introduced beavers Castor fiber and Castor canadensis in France and neighbouring countries », Mammal Review, vol. 42, no 2, , p. 144-165 (lire en ligne, consulté en ).
- Nolet & Rosell 1997, p. 167-168, chap. « Past and present distribution ».
- [Luglia 2013] Rémi Luglia, « Le castor d'Europe (Castor fiber). Regards historiques anciens et nouveaux sur un animal sauvage », Trajectoires, no 7, (lire en ligne [sur trajectoires.revues.org], consulté en ).
- [Luglia 2015] Rémi Luglia, « De la patrimonialisation du castor d'Europe à la protection d'un paysage », Projets de paysage, no 11, (lire en ligne [sur journals.openedition.org]).
- LS Lavrov (1938) Essai d'elevage du castor de riviere en cage. Testing the raising of river beaver while caged. Voronezh State Res Trans., Moscow.
- Aigneaux GP (1926), Rapport sur les conditions d'élevage en France des animaux à fourrure ; Hachette, Paris.
- Halley et Rosell 2003.
- « Castor Fiber », sur iucnredlist.org, UICN (consulté en ).
- Rémi Luglia, Vivre en castor. Histoires de cohabitations et de réconciliation, Versailles, éditions Quae, , 160 p. (ISBN 978-2-7592-3884-2, lire en ligne), p. 112
- Osborn 1953, cité par Masson 2007 ; Masson E, (2007), L'exploitation du castor du Canada pendant la période paléohistorique au Québec. L'exemple d'un site du sylvicole moyen : la station 3-avant de la pointe du Buisson. Mémoire de Master II, Université François Rabelais, Tours.
- Joseph S. Larson & F. C. Van Nostrand ; An evaluation of beaver age techniques The Journal of Wildlife Management, Vol. 32, No. 1 (Jan., 1968), p. 99-103 Ed: Allen Press ; Consulté: 07/04/2009 [PDF], 6 p.
- Cook AH & Maunton ER (1954), A study of criteria for estimating the age of beavers. New York Fish and Game J. 1(1): 27-46 (résumé).
- Stefen, C. (2009). Intraspecific variability of beaver teeth (Castoridae: Rodentia). Zoological Journal of the Linnean Society, 155(4), 926-936.
- Piechocki R & Stiefel A (1977) Eruption and shedding of the teeth in the beaver, Castor fiber albicus (author's transl)]. Anatomischer Anzeiger, 142(4), 374.
- Osborn, D. J. (1953). Age classes, reproduction, and sex ratios of Wyoming beaver. Journal of Mammalogy, 34(1), 27-44.
- Van Nostrand FC & Stephenson AB (1964), Age determination for beavers by tooth development. J. Wildl. Mgmt. 28(3): 430-434.
- Rosell, F., Zedrosser, A., & Parker, H. (2010). Correlates of body measurements and age in Eurasian beaver from Norway. European Journal of Wildlife Research, 56(1), 43-48 (résumé).
- Fandén A (2005) Ageing the beaver (Castor fiber L.): a skeletal development and life history calendar based on epiphyseal fusion. Archaeofauna, no 14, p. 199-213.
- (en) James Owen, « Beavers Returning to Sweden's Capital Can Be a Dam Nuisance », sur National Geographic Channel, (consulté le ).
- Sieber J (1999) The Austrian beaver, Castor fiber, reintroduction program. [In: Beaver protection, management, and utilization in Europe and North America. (Ed : Busher & Dzięciołowski). Kluwer Academic/Plenum Publishers, New York : 37-41.
- La cohabitation avec le castor en Wallonie : compte rendu du colloque du 6 novembre 2012.
- Le Pays des Castors.
- Swinnen, K. R., Strubbe, D., Matthysen, E., & Leirs, H. (2017). Reintroduced Eurasian beavers (Castor fiber): colonization and range expansion across human-dominated landscapes. Biodiversity and Conservation, 26(8), 1863-1876.
- Baguette T (1995), Le Castor : un instrument de gestion pour les fonds de vallée en Belgique. 2. Étude des potentialités d'accueil du castor dans deux systèmes hydrographiques fagnards ; la vallée de la Roer et l'amphithéâtre des sources de la Vesdre. Cahiers éthologiques, 15(1):47-70.
- Historique sur les populations de castors, association Castor et Homme.
- Cartographie de la répartition géographique du castor en France.
- Marcel Méric (1989) Les castors dans le Gard, mars 1989 - voir : La Protection du castor du Rhône par M. Galien Mingaud ; Ex. Bulletin de la Sté d'Étude des Sciences Naturelles de Nîmes - Séance du 13 mars 1896.
- Catusse M & Dubrulle PM (2013) Réintroduction du Castor en France ; Recommandations, conseils et réglementation ; Direction des études et de la Recherche de l'ONCFS, Centre national d'études et de recherche appliquée, Sur les prédateurs et les animaux déprédateurs, aout 2013 (PDF, pages).
- Virginie Schmitt, Le castor européen (Castor fiber L.) en vallée de la Moselle depuis sa réintroduction en 1983, CICONIA 31 (3), no 2007, p. 117-131 (par le Groupe d'Étude des Mammiferes de Lorraine, [PDF], 15 pages).
- Office national de la chasse et de la faune sauvage, « Le castor sur le bassin de la Loire et en Bretagne », ONCFS 2003.
- Daniel Pépin, « Castor : les traces visibles d'un animal très discret », sur La nouvelle république, (consulté le ).
- Arrêté du 23 avril 2007 fixant la liste des mammifères terrestres protégés sur l'ensemble du territoire et les modalités de leur protection sur Legifrance.
- Page consacrée au Castor, sur oncfs.gouv.fr, section « État des populations ».
- ONCFS (2012), Bilan 2012 du réseau Castor de l'ONCFS voir chap Enquête génétique, p. 53/97.
- (en) « Beavers in 'wild' after centuries », BBC News, .
- Kitchener AC & Lynch JM (2000) A morphometric comparison of the skulls of fossil British and extant European beavers, Castor fiber ; Review No 127. Scottish natural heritage.
- Kitchener A & Conroy J (1997), The history of the Eurasian Beaver Castor fiber in Scotland, Mammal review, 27 (2) : 95 - 108 (résumé).
- Conroy, J. W. H., & Kitchener, A. C. (1996). The Eurasian beaver (Castor fiber) in Scotland: a review of the literature and historical evidence. SNH Review ([PDF] 51 p.).
- Webb A, French D & Flitsch A (1997) Identification and assessment of possible beaver sites in Scotland. Scottish natural herit age research, Survey and Monitoring Report No. 94.
- Scottish Beaver Trial..
- Castors en Écosse, Bulletin de la BBC.
- Sigourney D, Letcher B& Cunjak R (2006) Influence of Beaver Activity on Summer Growth and Condition of Age-2 Atlantic Salmon Parr. Transactions of the American Fisheries Society, no 135, p. 1068-1075.
- Gaywood M.J (2018). Reintroducing the Eurasian beaver Castor fiber to Scotland. Mammal Review, 48(1), 48-61 |résumé.
- (en) Libby Brooks, « 'Historic day for Scotland' as beavers get protected status », sur The Guardian, (consulté le ).
- (en) « Opinions sought over beaver reintroduction in Wales », sur BBC, (consulté le ).
- (en) Helena Horton, « Beavers to be reintroduced on two National Trust sites, despite farmers' opposition », sur telegraph.co.uk, (consulté le ).
- Article du 2 mai 2008 dans le NZZ.
- Lucie Monnat, « L'embarrassant retour du castor », sur 24heures.ch, (consulté le ).
- Weinzierl, Hubert (1973) Projekt Biber, Wiedereinbürgerung von Tieren. Stuttgart (Kosmos).
- Schwab, G., Lutschinger, G., 2001. The return of the beaver (Castor fiber) to the Danube watershed, dans The European Beaver in a new millennium. Proceedings of 2d European Beaver Symposium, 27-30 septembre 2000. eds A. Czech, G. Schwab, p. 47-50. Carpathian Heritage Society, Cracovie, Bialowieza, Pologne.
- Gorczyca, E., Krzemień, K., Sobucki, M., & Jarzyna, K. (2018). Can beaver impact promote river renaturalization? The example of the Raba River, southern Poland. Science of the Total Environment, 615, 1048-1060.résumé
- AFP, « Les castors accusés d'être responsables des inondations en Pologne », sur Le Monde, (consulté le ).
- « Europäischer Biber », WWF Österreich (consulté le ).
- Sluiter H (2003) The reintroducti on and the present status of the beaver in the Netherlands : an overview. Lutra, vol. 46, p. 129-133.
- Parc national De Biesbosch Brochure (20006), Parc national De Biesbosch, juin 2006, voir le § « gestion », page 5 [PDF], 12pp en français.
- Nolet BA, Dijkstra VAA & Heidecke D (1994), Cadmium in beavers translocated from the Elbe River to the Rhine/Meuse Estuary, and the possible effect on population growth rate ; Archives of Environmental Contamination and Toxicology, 27(2), 154-161 (résumé).
- Antar B (1963) La Mongolie entre Moscou et Pékin. Politique étrangère, 28(4), p. 371-404.
- Dictionnaire encyclopédique de Philippe Le Bas, pages 505 et 506.
- Mangin L (2012). Vermeer, la carte et le castor. Pour la science, (412).
- Claudette Toulmonde (2012) « Timothy Brook, Le chapeau de Vermeer », Cahiers d'histoire. Revue d'histoire critique [En ligne], 118 | 2012, mis en ligne 01 janvier 2012, consulté 16 avril 2014. URL:[3].
- Parker, H., Nummi, P., Hartman, G., & Rosell, F. (2012) Invasive North American beaver Castor canadensis in Eurasia: a review of potential consequences and a strategy for eradication. Wildlife Biology, 18(4), 354-365.
- Schindler DW, Donahue WF (2006), An impending water crisis in Canada's western prairie pro vinces. Proceedings of the National Academy of Sciences , no 103, p. 7210-7216.
- Glynnis A. Hood, Suzanne E. Bayley (2008), Beaver (Castor canadensis) mitigate the effects of climate on the area of open water in boreal wetlands in western Canada ; biological conservation 141 556-567, PDF, 12 p.
- Nyssen JA, Billi PB, Pontzeele JA, De Visscher MA, Frank A (2012), L'effet des barrages de castors sur les événements de crues des petits cours d'eau, Région Wallonne, 2012-11-14.
- François-René Chateaubriand (vicomte de) (1829), Voyages en Amérique, en Italie, etc Lefèvre, 464 pages (p. 105-106).
- Burchsted D., Daniels MD, Thorson RM, and Vokoun JC (2010), The River Discontinuum: Beavers (castor canadensis) and Baseline Conditions for Restoration of Forested Headwaters. Bioscience 60(11): 908-922 (Résumé).
- Présentation de Eric Collier et de son livre autobiographique Three against the Wilderness, PDF.
- Eric Collier, La rivière des castors, Ed: Flammarion, 01/01/1961.
- Page présentant la maison des Collier et l'étang des castors, avec petite vidéo explicative.
- Grubešić, M., Zrinski, T., Tomljanović, K., Bjedov, L., & Vucelja, M (2012). « The importance of beaver (Castor fiber L.) for preservation of small streams », dans 6th International Beaver Symposium”, Book of abstracts / Bjedov, Linda ; Schwab, Gerhard ; Grubešić, Marijan (ed). - Zagreb : Faculty of Forestry, University of Zagreb, septembre 2012, (ISBN 978-953-292-027-7), p. 104-104 (résumé).
- Visscher, M., Nyssen, J., Pontzeele, J., Billi, P., & Frankl, A. (2013). « Spatio‐temporal sedimentation patterns in beaver ponds along the Chevral river, Ardennes, Belgium ». Hydrological Processes (résumé).
- Bernier S, Gauvreau M & Dulude P (1997) Le castor (Castor canadensis) et l'omble de fontaine (Salvelinus fontinalis) : modalités de gestion interactive. 37 p. (Collection Association des Gestionnaires de territoires Fauniques de Charlevoix/Bas-Saguenay inc. Ministère de l'Environnement et de la faune et Fondation de la faune de Québec.).
- DeBano LF, Heede BH (1987) Enhancement of riparian ecosystems with channel structures. Water Resour Bull, no 23, p. 463-470. doi:10.1111/j.1752-1688.1987.tb00824.x.
- Kemp PS, Worthington TA, Langford TE, Tree AR & Gaywood MJ (2012) Qualitative and quantitative effects of reintroduced beavers on stream fish. Fish and fisheries, 13(2), 158-181. (résumé).
- Avery, E.L. (1983) A bibliography of beaver, trout, wildlife, and forest relationships with special references tobeaver and trout. Technician Bulletin, no 137, p. 1-23. Wisconsin Department of Natural Resources, Madison, WI.
- Dalbeck L, Lüscher B, Ohlhoff D (2007) Beaver ponds as habitat of amphibian communities in a central European highland. Amphib Reptil, no 28, p. 493-501. doi:10.1163/156853807782152561.
- Nummi P, Kattainen S, Ulander P & Hahtola A (2011) Bats benefit from beavers: a facilitative link between aquatic and terrestrial food webs. Biodiversity and Conservation, 20(4), 851-859.
- Mateusz Ciechanowski, Weronika Kubic, Aleksandra Rynkiewicz, Adrian Zwolicki. (2010) Reintroduction of beavers Castor fiber may improve habitat quality for vespertilionid bats foraging in small river valleys. European Journal of Wildlife Research Online publication date: 23-Dec-2010. (« Résumé »).
- Ray AM, Rebertus AJ & Ray HL (2001) Macrophyte succession in Minnesota beaver ponds. Canadian Journal of Botany, 79(4), 487-499 (résumé).
- (p = 0,001).
- Déraillement survenu au « point milliaire » 44,8 de la subdivision Parry Sound, près de Pointe au Baril (Ontario).
- Rapport Rail, 1997, R97V0063.
- Tremblay, G. (2010). Caractérisation des paramètres de l'habitat du castor qui favorisent l'utilisation des ponceaux comme site de construction du barrage. Mémoire de Maîtrise en Biologie, Québec, avril 2010, PDF, 59 p.
- Enlèvement des castors et des barrages de castors au CE SCFT Meaford - 2007/08 Meaford Range and Training Area (Archives, Registre canadien d'évaluation environnementale : 07-01-35610).
- Exemple : contrôle des digues de castor : RNF du lac Saint-François Lac Saint-François National Wildlife Area (QC), archive : Registre canadien d'évaluation environnementale : 07-01-32829.
- Affaissement en juillet 1992 de la plate-forme au point milliaire 135,0 de la subdivision Caramat du CN, près de Nakina (Ontario) ; Rapport no R92T0183 du BST).
- Campbell-Palmer, R., & Rosell, F. (2011). The importance of chemical communication studies to mammalian conservation biology: a review. Biological Conservation, 144(7), 1919-1930.
- Campbell-Palmer R & Rosell, F. (2010), Conservation of the Eurasian beaver Castor fiber: an olfactory perspective. Mammal Review, 40(4), 293-312. (résumé).
- Lamoureux, Larocque et Pelletier 2007, p. 19.
- Major L, Vallières A & Banville D (1980), Expérimentation de différents dispositifs visant à contrôler le niveau de l'eau aux barrages de castors nuisibles. Ministère du Loisir, de la Chasse et de la Pêche, direction générale de la faune ; 39p.
- Lamoureux, Larocque et Pelletier 2007, p. 21.
- Lamoureux, Larocque et Pelletier 2007, p. 29.
- Lamoureux, Larocque et Pelletier 2007, p. 34.
- Maldague M (1977), Un appareil permettant d'abaisser le niveau de l'eau dans les étangs à castor : le bicylindre ; Forêt-Conservation, oct. 1977, p. 34-77.
- Lamoureux, Larocque et Pelletier 2007, p. 36.
- Lamoureux, Larocque et Pelletier 2007, p. 39-40.
- Arrêté du 24 mars 2014 pris pour l'application de l'article R. 427-6 du code de l'environnement et fixant la liste, les périodes et les modalités de destruction des espèces non indigènes d'animaux classés nuisibles sur l'ensemble du territoire métropolitain..
- Savelev AP & Safonov VG (1999)The beaver in Russia and adjoining countries. Recent trends in resource changes and management problems. [dans Beaver protection, management, and utilization in Europe and North America. P. E. Busher and R. Dzięciołowski, eds]. Kluwer Academic/Plenum Publishers, New York: 17-24.
- Sieber J., Suchentrunk F. and Hartl G. B. 1999. A biochemical-genetic discrimination method for the two beaver species, Castor fiber and Castor canadensis, as a tool for conservation. [In: Beaver protection, management, and utilization in Europe and North America. P. E. Busher and R. Dziêciołowski, eds]. Kluwer Academic/Plenum Publishers, New York: 61-65.
- Fournier D & Dancosse J (2005), La stérilisation du castor, Castor canadensis, en milieu urbain, Le naturaliste canadien ; 129(2) ; pdf 4 p.
- Brooks RP (1977), Induced sterility of the adult female beaver (Castor canadensis) and colony fecundity. M.S. Thesis, Univ. Massachusetts, Amherst. 90 p.
- Robert P. Brooks, Michael W. Flemming et James J. Kennelly, « Beaver colony response to fertility control : evaluating a concept », The Journal of Wildlife Management, no 44, , p. 568-575 (lire en ligne, consulté en ).
- F LEMMING, M.W. 1977. Induced sterility of adult male beaver (Castor canadensis) and colony fecundity. Master of science in wildlife biology thesis. University of Massachusetts, 59 p.
- Glynnis Hood, The Beaver Manifesto, Rocky Mountain Books Ltd, , 130 p. (lire en ligne).
- [Müller-Schwarze & Sun 2003] Dietland Müller-Schwarze et Lixing Sun, The beaver : natural history of a wetlands engineer [« Le castor : histoire naturelle d'un ingénieur des zones humides »], Cornell University Press, , sur books.google.fr (lire en ligne).
- Printemps des Castors.
- Emmanuel Holder, « L'invisible castor ou de la difficulté, pour l'animateur, à parler d'un animal qu'on ne verra pas », Penn ar Bed, no 209, , p. 9-11.
- Michel Cointat, « Le Castor rhodanien : Extension - Dégâts », Revue forestière française, no 1, , p. 19-29 (ISSN 0035-2829, présentation en ligne, lire en ligne, consulté en ), p. 19.
- « Bilan 2013 du réseau castor »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur oncfs.gouv.fr, ONCFS, .
- Roger Esteve, « Analyse de la mortalité du castor (Castor fiber) en Haute-Savoie », Le Bièvre, t. 9, no 2, , p. 171-176 (lire en ligne, consulté en ).
- [Nolet et al. 1997] Bart A. Nolet, S. Broekhuizen, Gerry M. Dorrestein et K. M. Rienks, « Infectious diseases as main causes of mortality to beavers Castor fiber after translocation to the Netherlands », Journal of Zoology, vol. 241, no 1, , p. 35-42 (résumé).
- Ronald Fayer, Mónica Santín, James M Trout, Stephen DeStefano, Kiana Koenen et Taranjit Kaur, « Prevalence of Microsporidia, Cryptosporidium spp., and Giardia spp. in beavers (Castor canadensis) in Massachusetts », Journal of Zoo and Wildlife Medicine, vol. 37, no 4, , p. 492-497 (lire en ligne, consulté en ).
- [Zhou et al. 2004] Ling Zhou, Ronald Fayer, James M. Trout, Una Ryan, Frank W Schaefer et Lihua Xiao, « Genotypes of Cryptosporidium species infecting fur-bearing mammals differ from those of species infecting humans », Applied and Environmental Microbiology, vol. 70, no 12, , p. 7574-7577 (lire en ligne [sur researchgate.net], consulté en ).
- A. M. Barlow, Bruno Gottstein et Norbert Müller, « Echinococcus multilocularis in an imported captive European beaver (Castor fiber) in Great Britain », Veterinary Record, vol. 169, no 13, , p. 339-339 (résumé).
- (en) Hannah B Cross, Róisín Campbell-Palmer, Simon Girling et Frank Rosell, « The Eurasian beaver (Castor fiber) is apparently not a host to blood parasites in Norway », Veterinary Parasitology, vol. 190, , p. 246-248 (lire en ligne, consulté en ).
- [Whitaker et al. 2007] John Ogden Whitaker, Jr., Brianne L. Walters, Linda K. Castor, Chris M. Ritzi et Nixon Wilson, « Host and distribution lists of mites (Acari), parasitic and phoretic, in the hair or on the skin of North American wild mammals north of Mexico: records since 1974 », Faculty Publications from the Harold W. Manter Laboratory of Parasitology, University of Nebraska, (lire en ligne [PDF] sur core.ac.uk, consulté en ).
- Andre V Bochkov et HV Dubinina, « Mites of the genus Schizocarpus (Acariformes: Chirodiscidae) parasitizing the eurasian beaver Castor fiber (Rodentia: Castoridae) in the Voronezh National Reserve », Acarina, vol. 19, no 1, , p. 53-66 (lire en ligne [PDF], consulté en ).
- (en) Andrew Duff, Róisín Campbell-Palmer et Robert Needham, « The beaver beetle Platypsyllus castoris (Leiodidae: Platypsyllinae) apparently established on reintroduced beavers in Scotland, new to Britain », The Coleopterist, no 22, , p. 9-19 (résumé).
- [Ryszard 1991] (en) Haitlinger Ryszard, « Arthropods found on European beaver (Castor fiber L.) in Poland », Wiadomości Parazytologiczne, vol. 37, no 1, , p. 107-109 (lire en ligne [sur researchgate.net], consulté en ).
- A. Fain et Jean-Claude Beaucournu, « Les hypopes des Astigmates phorétiques sur les Puces », Bulletin de l'Institut royal des sciences naturelles de Belgique, no 63, , p. 77-93 (lire en ligne, consulté en ).
- (en) J. Drózdz, A.W. Demiaszkiewicz, J Lachowicz, Anna Maria Pyziel, Grzegorz Bełżecki, Renata Miltko, Barbara Kowalik, Wojciech Gogola et Zygmunt Giżejewski, « Endoparasites of the beaver Castor fiber (L.) in northeast Poland », Bulletin of the Veterinary Institute in Pulawy, no 58, , p. 223-227 (lire en ligne, consulté en ).
- (en) Joëlle Goüy de Bellocq, Nathalie Charbonnel et Serge Morand, « Coevolutionary relationship between helminth diversity and MHC class II polymorphism in rodents », Journal of Evolutionary Biology, vol. 21, no 4, , p. 1144-1150 (lire en ligne, consulté en ), Tableau no 1 : « Allelic diversity of MHC class II genes and helminth species diversity for rodent species ».