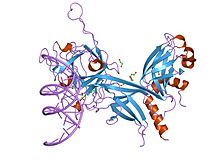
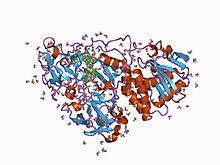
Trèfle bêta
Un trèfle β est une structure protéique comprenant trois séquences β–β–β–boucle–β repliées de telle sorte que deux épingles à cheveux β à deux brins se forment avec le premier et le dernier brin β pour la première, et avec les deuxième et troisième brins β pour la seconde épingle à cheveux β. L'ensemble forme un tonneau β de 1,6 nm de diamètre avec une coiffe triangulaire et une symétrie approximativement d'ordre 3[1],[2].
Parmi les protéines qui présentent un domaine en trèfle β, on peut noter les inhibiteurs à domaine de Kunitz (en) de plantes telles que le soja, l'arbre corail africain (en) et le blé ; les cytokines de la famille des interleukines 1 (interleukine 1α (en), interleukine 1β, antagoniste du récepteur des interleukines 1 (en)) ainsi que des facteurs de croissance des fibroblastes 1 (en) et 2 (en).
Notes et références
modifier- (en) Alexey G. Murzin, Arthur M. Lesk et Cyrus Chothia, « β-Trefoil fold: Patterns of structure and sequence in the Kunitz inhibitors interleukins-1β and 1α and fibroblast growth factors », Journal of Molecular Biology, vol. 223, no 2, , p. 531-543 (PMID 1738162, DOI 10.1016/0022-2836(92)90668-A, lire en ligne)
- (en) Shachi Gosavi, Paul C. Whitford, Patricia A. Jennings et José N. Onuchic, « Extracting function from a β-trefoil folding motif », Proceedings of the National Academy of Sciences of the United States of America, vol. 105, no 30, , p. 10384-10389 (PMID 18650393, PMCID 2492465, DOI 10.1073/pnas.0801343105, lire en ligne)
- (en) Rhett A. Kovall et Wayne A. Hendrickson, « Crystal structure of the nuclear effector of Notch signaling, CSL, bound to DNA », The EMBO Journal, vol. 23, no 17, , p. 3441-3451 (PMID 15297877, PMCID 516623, DOI 10.1038/sj.emboj.7600349, lire en ligne)
- (en) Tahir H. Tahirov, Tian-Huey Lu, Yen-Chywan Liaw, Yung-Liang Chen et Jung-Yaw Lin, « Crystal Structure of Abrin-a at 2.14 Å », Journal of Molecular Biology, vol. 250, no 3, , p. 354-367 (PMID 7608980, DOI 10.1006/jmbi.1995.0382, lire en ligne)