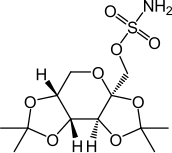
Topiramate
Le topiramate est un médicament antiépileptique utilisé pour les épilepsies de type généralisée ou partielle. On le trouve, en France, sous le nom d'Epitomax et aux États-Unis, au Canada, au Royaume-Uni, en Australie et dans certains autres pays sous le nom de Topamax. Il peut aussi être utilisé comme traitement préventif des crises de migraine.
| Topiramate | |
| |
| Identification | |
|---|---|
| Nom UICPA | sulfamate de [(3aS,5aR,8aR,8bS)-2,2,7,7-tétraméthyltétrahydro-3aH-bis[1,3]dioxolo[4,5-b:4',5'-d]pyran-3a-yl]méthyle |
| Synonymes |
sulfamate de 2,3,4,5-bis-O-(1-méthyléthylidéne)-β-D-fructopyranose |
| No CAS | |
| No ECHA | 100.129.713 |
| Code ATC | N03 |
| DrugBank | APRD00237 |
| PubChem | 5284627 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C12H21NO8S [Isomères] |
| Masse molaire[1] | 339,362 ± 0,019 g/mol C 42,47 %, H 6,24 %, N 4,13 %, O 37,72 %, S 9,45 %, |
| Données pharmacocinétiques | |
| Biodisponibilité | 80 % |
| Métabolisme | 30 % hépatique, 70 % est excrété inchangé |
| Demi-vie d’élim. | 19 à 23 heures |
| Excrétion |
70 % rénal (la forme inchangée) |
| Considérations thérapeutiques | |
| Voie d’administration | oral |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|

Des études ont été aussi portées sur son utilité dans le traitement des effets induits par la kétamine, utilisé alors comme modèle de la schizophrénie.
Chimie
modifierPharmacocinétique
modifierLa biodisponibilité est supérieure à 80 %, sans modification significative par les prises alimentaires. Sa demi-vie est d'environ 24 heures et l'excrétion est rénale. La phénytoïne et la carbamazépine diminuent de moitié sa demi-vie, imposant une augmentation des doses[3].
Efficacité
modifier- Épilepsie
Épilepsie de l'enfant et de l'adolescent. C'est sa première utilisation. Chez l'enfant, il est indiqué pour le traitement du syndrome de Lennox-Gastaut[réf. nécessaire]. - Migraines
Par ailleurs, il diminue notablement le nombre de crises migraineuses lorsqu'il est donné en traitement de fond [4]. - Trouble de la personnalité borderline
Trouble de personnalité borderline notamment instabilité de l'humeur. Cette indication est recommandée par une revue de la Collaboration Cochrane de 2010[5]. - Trouble bipolaire
Cependant cette indication est critiquée par une revue de la Cochrane qui conclut en une efficacité insuffisante[6].
Utilisation expérimentale
modifierDes études ont été aussi portées sur son utilité dans le traitement des effets induits par la kétamine, utilisé alors comme modèle de la schizophrénie[7],[8].
Effets secondaires
modifierLes plus fréquents sont les sensations de fourmillements (paresthésies présents dans la moitié des cas et conduisant à l'arrêt du traitement dans un peu moins d'un cas sur 10) et une perte assez importante de poids durant le traitement[9].
L'ANSM met en garde contre la tératogénicité du topiramate : les femmes enceintes sont exposées à un risque 3 fois plus grand de malformations du fœtus, notamment des becs-de-lièvre[10] ou des hypospadias. Par ailleurs des cas de troubles neurodéveloppementaux sont rapportés[11]. Un registre scandinave montre une augmentation du risque du trouble du spectre autistique[12] qui n'a cependant pas été retrouvé dans un registre américain[13]. L'ANSM modifie alors les conditions de prescription mentionnant que le risque observé de malformations majeures s’élève jusqu’à 8,2 %, ainsi qu'un risque de survenue de troubles du spectre autistique qui se situe entre 2 et 6 %, enfin un risque de survenue d’une déficience intellectuelle qui situe entre 1 et 8 %[14].
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Shank RP, Maryanoff BE, « Molecular pharmacodynamics, clinical therapeutics, and pharmacokinetics of topiramate » CNS Neurosci Ther. 2008;14:120-42.
- (en) Bialer M, Doose DR, Murthy B. et al. « Pharmacokinetic interactions of topiramate » Clin Pharmacokinet. 2004;43:763-80.
- (en) Brandes JL, Saper JR, Diamond M. et al. « Topiramate for migraine prevention: a randomized controlled trial » JAMA. 2004;291:965-73.
- (en) Klaus Leib, Birgit Völlm, Gerta Rücker, Antje Timmer et Jutta M Stoffers, « Pharmacotherapy for borderline personality disorder: Cochrane systematic review of randomised trials », British Journal of Psychiatry, vol. 196, no 1, , p. 4–12 (DOI 10.1192/bjp.bp.108.062984)
- (en) Kamini Vasudev, Karine MacRitchie, John Geddes, Stuart Watson, Allan H Young et Allan H Young, « Topiramate for acute affective episodes in bipolar disorder », Cochrane database of systematic reviews (Online), no 1, , p. CD003384 (PMID 16437453, DOI 10.1002/14651858.CD003384.pub2)
- (en) Deutsch SI, Rosse RB, Billingslea EN, Bellack AS, Mastropaolo J, « Topiramate antagonizes MK-801 in an animal model of schizophrenia », Eur J Pharmacol, vol. 449, nos 1-2, , p. 121-5. (PMID 12163115)
- (en) Micallef J, Gavaudan G, Burle B, Blin O, Hasbroucq T, « A study of a topiramate pre-treatment on the effects induced by a subanaesthetic dose of ketamine on human reaction time », Neurosci Lett, vol. 369, no 2, , p. 99-103. (PMID 15450676)
- (en) Edvinsson L, Linde M, « New drugs in migraine treatment and prophylaxis: telcagepant and topiramate » Lancet. 2010;376:645-55.
- Bromley R, Adab N, Bluett-Duncan M et al. Monotherapy treatment of epilepsy in pregnancy: congenital malformation outcomes in the child, Cochrane Database Syst Rev, 2023;8:CD010224-CD010224
- ANSM - Antiépileptiques au cours de la grossesse : État actuel des connaissances sur les risques de malformations et de troubles neuro-développementaux - Point d'information
- (en) Marte-Helene Bjørk et al., « Association of Prenatal Exposure to Antiseizure Medication With Risk of Autism and Intellectual Disability », JAMA Neurol., vol. 79, no 7, , p. 672-681 (DOI 10.1001/jamaneurol.2022.1269, lire en ligne, consulté le ).
- Hernández-Díaz S, Straub L, Bateman BT et al. Risk of autism after prenatal topiramate, valproate, or lamotrigine exposure, N Engl J Med, 2024;390:1069-1079
- « Topiramate et risques chez les enfants exposés pendant la grossesse : modification des conditions de prescription et de délivrance aux femmes concernées », Produit de santé, Agence nationale de sécurité du médicament et des produits de santé, (consulté le ).
Liens externes
modifier- Compendium suisse des médicaments : spécialités contenant Topiramate
- Page spécifique sur le Vidal.fr