Fructose
Le fructose (la forme D est aussi nommée lévulose) est un ose (sucre simple non hydrolysable) du groupe des cétoses, que l'on trouve en abondance dans les fruits et le miel. C'est un hexose (sucre à six atomes de carbone) qui présente la même formule brute, décrite par Augustin-Pierre Dubrunfaut en 1847, que ses isomères, en particulier le glucose : C6H12O6.
| Fructose | |
 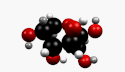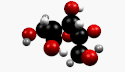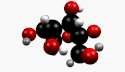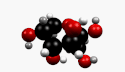  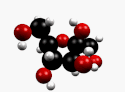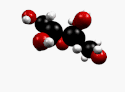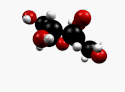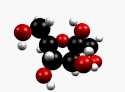 β-D-Fructopyranose et β-D-fructofuranose, les formes les plus courantes. |
|
| Identification | |
|---|---|
| Nom UICPA | (2R,3S,4R,5R) -2,5-bis(hydroxyméthyl) oxolane-2,3,4-triol |
| No CAS | D(–) (α-D-fructofuranose) |
| No ECHA | 100.000.303 |
| No CE | 200-333-3 |
| SMILES | |
| Apparence | solide blanc |
| Propriétés chimiques | |
| Formule | C6H12O6 [Isomères] |
| Masse molaire[1] | 180,155 9 ± 0,007 4 g/mol C 40 %, H 6,71 %, O 53,29 %, |
| Propriétés physiques | |
| T° fusion | β-D-fructose : 103 °C[réf. souhaitée] |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | P212121[2] |
| Paramètres de maille | a = 8,088 Å b = 9,204 Å |
| Volume | 744,36 Å3[2] |
| Précautions | |
| SIMDUT[3] | |
Produit non contrôlé |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Sa formule semi-développée est CH2OH-CHOH-CHOH-CHOH-CO-CH2OH ou C4H9O4-CO-CH2OH si on veut faire apparaître sa fonction cétone. Il a tendance à se cycliser sous sa forme pyranose (cycle à cinq atomes de carbone et un oxygène) plutôt que sous sa forme furanose (cycle à quatre atomes de carbone et un atome d'oxygène).
Le D-fructose est le monomère de l'inuline et est attaché au D-glucose par une liaison osidique pour former le saccharose (ou sucre de table). On le trouve aussi dans d'autres osides comme le lactulose (un diholoside), l'erlose et le raffinose (deux triholosides) ainsi que le stachyose (un oligoside).
Lorsqu'il est sous sa forme D, l'activité optique du fructose est lévogyre de −93 degrés, d'où son autre nom : le lévulose.
-
D-fructose et L-fructose (représentation de Fischer).
-
Formule de Haworth du α-D-fructofuranose.
-
Formule de Haworth du β-D-fructofuranose.
-
Formule de Haworth du α-D-fructopyranose.
La consommation de fructose, largement utilisé comme édulcorant dans les aliments ultratransformés, a fortement augmenté (elle a été multipliée par 15 depuis le siècle dernier aux États-Unis) ce qui présente un risque pour la santé. En particulier, des métabolites du fructose favorisent la croissance tumorale de cancers[4].
Chimie
modifierDans l'eau, la forme tautomère prédominante est la forme bêta-D-fructopyranose (73 % à 20 °C), suivie de la forme bêta-D-fructofuranose (20 %)[5].
L'analyse aux rayons X a montré que le D-fructose sous sa forme cristalline est un bêta-D-fructopyranose en conformation chaise 2C5[6].
| Isomères du D-fructose | ||
|---|---|---|
| Forme linéaire | Projection de Haworth | |
| α-D-fructofuranose 5 % |
β-D-fructofuranose 20 % | |
| α-D-fructopyranose 2 % |
β-D-fructopyranose 73 % | |
Digestion
modifierL'absorption du D-fructose est plus lente que celle du D-glucose. Le D-fructose est absorbé au niveau des intestins, selon un mécanisme différent de celui du D-glucose : son transport à l’intérieur des cellules de la muqueuse intestinale découle d'un processus de diffusion facilitée passif, alors que le D-glucose est transporté activement. Le taux de diffusion du D-fructose est supérieur à celui attendu par la diffusion passive. Le mécanisme complet d'absorption du D-fructose n'est pas complètement élucidé[7],[8].
À forte dose, le D-fructose est mal assimilé, même si son absorption nette est augmentée. Flatulences et diarrhée sont fréquentes lors d'ingestion par voie orale si les doses de fructose sont supérieures à 50 g. Mais la présence de D-glucose facilite l'absorption du fructose, qui est alors complètement absorbé, même chez les personnes qui absorbent mal le D-fructose seul. Étant donné que dans l'alimentation le D-fructose n'est généralement pas le seul glucide présent, son absorption ne pose pas de problème particulier[7],[8].
Dans les cellules de la paroi intestinale, le D-fructose est partiellement transformé en lactate ou en D-glucose, le reste étant déversé dans la circulation sanguine. Il arrive par la veine porte dans le foie, où se déroule l'essentiel de sa métabolisation[7].
Le foie capte l'essentiel du D-fructose dès le premier passage grâce à la forte efficacité des enzymes fructokinase et aldolase B. Le D-fructose restant apparaît en faible concentration dans le sang et peut être utilisé par les reins[7].
Métabolisme
modifierLe D-fructose est globalement métabolisé de la même manière que le glucose, mais l'assimilation est plus passive[8] et plus variable selon les individus. Dans la plupart des tissus, le fructose rejoint la glycolyse au niveau du glucose 6-phosphate, après avoir été phosphorylé par l'hexokinase en fructose 6-phosphate, puis isomérisé. Il intervient donc lors de la néoglucogenèse. Certaines maladies génétiques empêchent le métabolisme du fructose : intolérance héréditaire au fructose, déficit en fructose-1,6-diphosphatase.
Le foie est l'organe principal métabolisant le fructose[7].
Alors que le D-glucose est métabolisé en fonction des besoins énergétiques du foie et que ce métabolisme est ralenti par l'insuline, le métabolisme du D-fructose dépend principalement des apports en D-fructose[7].
Les molécules issues du métabolisme du D-fructose favorisent le transport du D-glucose dans le foie et son stockage sous forme de glycogène. Lorsque les apports de fructoses sont importants, la production d'acide urique augmente. Il est estimé qu'environ la moitié du D-fructose ingéré est relarguée dans le sang sous forme de glucose et un quart sous forme de lactate, qui servent de substrats énergétiques pour d’autres tissus. 15 à 20 % du D-fructose est stocké sous forme de glycogène et 5 à 10 % est transformé en lipides, ces données étant obtenues après ingestion de D-fructose pur[7].
Le catabolisme hépatocytaire du D-fructose est différent de celui du D-glucose. En effet, dans le foie, l'absence d'hexokinase — remplacée par une glucokinase absolument spécifique du D-glucose — empêche la phosphorylation du D-fructose en fructose 6-phosphate. Le premier carbone du D-fructose est donc phosphorylé par la fructokinase 1 pour donner du fructose 1-phosphate. Celui-ci subit ensuite le clivage habituel de la glycolyse en deux trioses par l'aldolase, ce qui produit du dihydroxyacétone-phosphate ainsi que du glycéraldéhyde. Pour rejoindre la glycolyse, le glycéraldéhyde va être phosphorylé en glycéraldéhyde-3-phosphate, et le dihydroxyacétone-phosphate va être isomérisé en glycéraldéhyde 3-phosphate.
Finalement, le catabolisme hépatocytaire du D-fructose, bien que légèrement différent du catabolisme du glucose, produira le même nombre de molécules d'ATP.
Dans le foie, le fructose peut être transformé en glucose, lactate, glycogène et en triglycérides[9],[10].
Nutrition
modifierLa plupart des fruits contiennent du D-fructose, soit sous forme libre, soit sous forme de résidu dans le saccharose (sucre de table)[11], rapidement hydrolysé dans l'intestin en D-fructose et D-glucose. De très nombreux produits alimentaires contiennent du D-fructose, à travers l'utilisation, en tant qu'ingrédients, du sucre et du sirop de maïs à haute teneur en D-fructose (HFCS : High-Fructose Corn Syrup).
Tout comme les autres glucides (saccharose, lactose, amidon, etc.) et les protéines, le D-fructose apporte 4 kcal/g, contre 7 kcal/g pour l’alcool et 9 kcal/g pour les lipides.
Le D-fructose a un pouvoir sucrant supérieur au saccharose, de 20 à 40 % selon les conditions[12].
Le fructose possède un indice glycémique inférieur à celui du glucose mais ceci est lié à son métabolisme hépatique spécifique. Le pouvoir sucrant du fructose est compris entre 1,1 et 1,3 selon les sources et les utilisations[13].
En tant qu'édulcorant de charge, on le trouve sous la forme de fructose cristallin mais également sous forme de sirops de fructose-glucose (comme le sirop de maïs à haute teneur en fructose). Dans ces ingrédients, la teneur en fructose (pour les références dites high-fructose) peut atteindre 42 à 55 % de la matière sèche.
Une source importante de D-fructose dans l'alimentation humaine se trouve dans la consommation de saccharose qui, lors de sa digestion, est hydrolysé par l'invertase en quantités égales de D-glucose et de D-fructose.
Le D-fructose des fruits n'a pas les mêmes effets nutritionnels que le D-fructose industriel[14] car si les molécules sont les mêmes, elles sont accompagnées dans les fruits par d'autres nutriments, tels les phytophénols, qui contrebalancent les effets délétères du D-fructose pur[pas clair].
Effets positifs et négatifs
modifierCertains auteurs estiment que le D-fructose a un effet délétère sur l'organisme, par nature. Mais, d'autres estiment que la nature de ce nutriment n'est pas en cause : les effets négatifs découleraient d'un excès de consommation[7]. En ce qui concerne une consommation faible de D-fructose, les auteurs s'accordent à estimer qu'en dessous de 50 g/j, il n’y a pas d’élément objectif indiquant un risque métabolique[7],[15].
D'après Anne-Françoise Burnol, biologiste directrice de recherche au CNRS, les avis ne sont « pas unanimes sur l’existence d’effets toxiques propres au fructose chez l’homme. Si les études réalisées chez les animaux de laboratoire montrent sans ambiguïté que le fructose à haute dose entraîne des conséquences néfastes sur la régulation du métabolisme énergétique, l’obésité et le diabète de type 2, il est beaucoup plus difficile de tirer des conclusions aussi claires d’études menées sur l’homme ». Selon elle, il est « extrêmement compliqué » d'obtenir des études prospectives probantes à long terme concernant la consommation alimentaire dans les cohortes humaines, car l’autoévaluation des volontaires est très peu fiable. Elle invoque également l'existence d'intérêts financiers en jeu « énormes » qui peuvent avoir des conséquences sur la pertinence des conclusions des études[16].
Effets positifs
modifier- À une époque, le D-fructose était conseillé aux diabétiques, car le D-fructose a un faible impact sur le taux de D-glucose dans le sang (glycémie)[7],[17]. S'appuyant sur cette caractéristique, un avis scientifique de la EFSA a conduit l'Union européenne à autoriser en 2013 une allégation de santé sur le fructose[7]. Mais la réputation du D-fructose s'est ensuite dégradée. Simone Lemieux de l’Institut des nutraceutiques et des aliments fonctionnels (INAF) affirme que « lorsqu’il est consommé en grande quantité, le fructose fait augmenter le taux de triglycérides dans le sang, ce qui constitue un facteur de maladie cardiovasculaire et de résistance à l’insuline »[18].
- Le D-fructose fournit une énergie lentement utilisée et permet d'éviter les pics de glycémie souvent liés à une consommation importante de glucose ou en saccharose[17]. Le fructose ne provoque pas non plus les effets associés aux hyperglycémies, tels l'hyper-excitation qui, bien comprise, s'exprime par des activités positives très soutenues, mais peut aussi s'exprimer sous forme d'agressivité.
Effets négatifs
modifier- Une consommation de plus de 50 g de fructose (équivalent de 800 g de pommes)[19] par jour peut causer des ballonnements[20], des flatulences, pertes de selles et diarrhée dépendant de la quantité ingérée et d'autres facteurs.
- Le fructose même naturel reste un glucide (un sucre). Il y a une corrélation entre la consommation de sucre ajouté (fructose ou non) ou de jus de fruits et la fréquence de l'obésité[21],[22],[23],[24]. Il faut néanmoins rappeler que la relation entre suralimentation et prise de poids est connue. Et prendre du fructose en excès, ou du glucose en excès, ou des lipides en excès, dans des grandeurs caloriques équivalentes, provoque la même prise de poids[7].
- Le fructose, comme les autres sucres réducteurs, peut réagir avec les protéines par la réaction de Maillard (glycation), ce qui peut expliquer plusieurs complications du diabète sucré et l'accélération du vieillissement[25]. Une étude a montré in vitro que le fructose mélangé à l'albumine, une protéine, conduit au phénomène de glycation. Il a été également observé in vivo, dans le cristallin, que les protéines du cristallin avaient réagi avec le fructose endogène. La signification possible de ces processus chez les sujets diabétiques est discutée[26]. Une étude a été menée sur des rats, nourris soit avec du fructose, soit du glucose, soit du saccharose. Les produits issus de la glycation ont été observés chez ces rats à des taux plus élevés pour le fructose. Les auteurs concluent « que la consommation à long terme de fructose induit des effets néfastes sur le vieillissement ; des études complémentaires sont nécessaires pour clarifier le rôle précis du fructose dans le processus de vieillissement »[25].
- Les études menées à l'université de Valence sur des rats posent la question d'un rôle oxydant du fructose. Ces études suggèrent un effet délétère du fructose lorsqu'il est consommé sous forme purifiée et de façon excessive. Les auteurs notent qu'ils ont utilisé pour leurs expériences avec les rats des régimes très riches en fructose, plus riches que les régimes propres à l'être humain, ce qui rend complexe l'extrapolation des résultats[15].
- La survenue de la goutte serait favorisée par la consommation excessive de fructose, principalement sous forme de sucre ajouté dans les boissons non alcoolisées ou bien les jus de fruits, un risque existant également avec les fruits très sucrés (pomme, orange)[27],[28]. Le fructose, et en particulier sa capacité à stimuler la production de lipides par le foie, favorisent une augmentation des triglycérides circulants, ainsi que la production de lipoprotéines athérogènes, ce qui peut occasionner le développement d’une hyperuricémie[7].
- Lorsque de très grandes quantités de fructose sont consommées, la plupart des individus absorbent mal le fructose. Et lorsque le fructose n'est absorbé que partiellement, il est alors fermenté par la flore intestinale. Cela peut conduire, chez certaines personnes intolérantes, à des symptômes comme les ballonnements, crampes et douleurs abdominales, diarrhées et constipation, reflux, nausées ou vomissements. La réduction de la consommation de fructose à un niveau individuellement toléré soulage en quelques jours les symptômes pour la plupart des individus. Environ 30 % des adultes en bonne santé ont une mauvaise absorption de fructose même avec des doses en dessous de 50 g et environ 10 % ont une intolérance symptomatique. Cette intolérance apparait généralement chez les adultes et peut être déclenchée par le stress, une inflammation ou des antibiotiques, qui modifient l’activité des protéines de transport déterminant l’absorption du fructose. Les intolérances au sorbitol, xylitol et au fructose coexistent de manière très commune et peuvent s’exacerber mutuellement. Il existe une intolérance héréditaire sévère au fructose, qui est distincte du problème de malabsorption, et qui est due à une anomalie génétique[29].
- Le mélange glucose-fructose, présent notamment dans le sirop de maïs, largement utilisé par l’industrie comme agent sucrant, est métabolisé en graisse dans le foie, altère la barrière intestinale et ne déclenche pas de réponse insulinique, ce qui favorise l'addiction[30]. Lorsqu'il s'agit de fructose présent dans les fruits, il existe un effet compensatoire : la présence de fibres ralentit le transport du fructose vers le foie et aide à renforcer la barrière intestinale[30].
Débat sur la satiété
modifierLe fructose augmente les taux de ghréline, hormone qui stimule l'appétit[31]. Mais les études directes montrent que, au contraire de l'effet théorique attendu, il semblerait que l'ingestion de fructose provoque un effet de satiété à court terme plutôt qu'une stimulation de l'appétit. Plusieurs études montrent que l'ingestion de fructose avant un repas inhibe la consommation pendant le repas de 44 % de plus qu’une précharge de glucose et de 60 % de plus qu’une ingestion d’eau[7].
En ce qui concerne le rassasiement, comme tous les produits sucrés, le fructose stimule l’appétit pendant la consommation jusqu’à ce que s’installe le rassasiement sensoriel[7]. Mais le fructose n'induit pas ou peu de sécrétion d'insuline, et pas non plus de sécrétion de leptine qui sont des hormones intervenant dans la satiété[32]. Or l'insuline et la leptine sont deux éléments majeurs de la régulation de la prise alimentaire[33],[16]. Le fructose induit également une sécrétion plus faible d'une hormone de la satiété, le GLP-1[32]. Une étude de l'université Yale menée auprès de vingt volontaires montre que les taux sanguins d'insuline et de GLP-1 après consommation de fructose sont inférieurs à ceux obtenus avec une consommation équivalente de glucose, et que l'hypothalamus, centre de contrôle régulant la sensation de faim, est moins stimulé lors de l'ingestion de fructose[34],[35]. Une étude menée auprès de 24 participants par les chercheurs de l'université du Sud de la Californie montre que la consommation de glucose augmente l'envie de nourriture. Les chercheurs, qui ont observé les réactions des cerveaux des participants donnent comme conclusion de leur étude : « l'ingestion de fructose, vs glucose, active les zones du cerveau impliquées dans l'attention et la récompense et peut ainsi favoriser le comportement alimentaire. Mais ce n'est pas une raison pour se priver de fruits[36],[37]. »
Santé
modifierLa consommation de fructose a considérablement augmenté depuis 50 ans, du fait de l'utilisation de sirop de maïs à haute teneur en fructose comme édulcorant. Des études montrent que la consommation de fructose favorise la croissance tumorale dans plusieurs types de cancer.
Les cellules cancéreuses ne sont pas capables d'utiliser le fructose comme nutriment. En revanche, le foie (dont les hépatocytes primaires expriment la cétohexokinase-C (KHK-C)) est capable de l'assimiler et réalise une fructolyse produisant des espèces lipidiques dont des lysophosphatidylcholines (LPC). Ce sont ces dernières qui alimente la croissance tumorale[38],[39].
Localisation et commerce
modifier- Le fructose est plus cher que le saccharose pour des raisons d'économie d'échelle de production et de matière première. Il se trouve facilement en grande distribution.[réf. nécessaire].
- Dans les aliments et boissons industriels où il est souvent associé au glucose, le fructose est couvert par l'appellation « sucres ajoutés ». Ces sucres ajoutés génèrent une dépendance avantageuse selon des critères commerciaux, mais aussi des problèmes de foie et sont donc dommageables du point de vue de la santé globale de la population mondiale. C'est pourquoi il est important de promouvoir la consommation de fruits et légumes plutôt que des aliments comportant des sucres ajoutés[40].
- Le fructose est présent dans les fruits[41], leurs jus, le miel (38 % de ses sucres), le sirop d'agave.
- Dans le cas du miel, la composition en sucres peut faire varier fortement l’indice glycémique (de l'ordre de 40 pour le miel d'acacia, qui contient plus de fructose que de glucose, et 66 pour le miel de colza, riche en glucose).
Divers
modifierLe fructose est également présent dans les sécrétions séminales, il constitue une petite partie de leur extrait sec[42] et est retrouvé à hauteur de 1,5 à 6,5 mg/mL dans le liquide séminal[43].
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fructose », sur reciprocalnet.org (consulté le ).
- « Fructose (d-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- Nathalie Mayer, « Ce sucre ajouté dans de nombreux aliments booste la croissance des tumeurs, révèle une étude », sur Futura (consulté le )
- (en) B. Schneider, F. W. Lichtenthaler, G. Steinle et H. Schiweck, « Distribution of Furanoid and Pyranoid Tautomers of D-Fructose in Dimethylsulfoxide, Water and Pyridine via Anomeric Hydroxyl Proton NMR Intensitites », Liebigs Ann. Chem., , p. 2454 – 2464.
- (en) J.A. Kanters, G. Roelofsen, B.P. Alblas et I. Meinders, « The Crystal Structure of β-D-Fructose with Emphasis on the Anomeric Effect », Acta Crystallographica, vol. B33, , p. 665 – 672 (DOI 10.1107/S0567740877004439, lire en ligne).
- « Le Fructose, État des lieux » [PDF], sur Fonds français pour l’alimentation et la santé, .
- (en) « Digestion, absorption and energy value of carbohydrates », sur Organisation des Nations unies pour l'alimentation et l'agriculture.
- (en) Sucrose, High-Fructose Corn Syrup, and Fructose, Their Metabolism and Potential Health Effects: What Do We Really Know?, sur advances.nutrition.org.
- (en) « Consuming fructose-sweetened, not glucose-sweetened, beverages increases visceral adiposity and lipids and decreases insulin sensitivity in overweight/obese humans », The Journal of Clinical Investigation, (DOI 10.1172/JCI37385, lire en ligne).
- Teneur en fructose, glucose et saccharose de certains fruits, sur sugar.ca.
- Bernard Guy-Grand, « Les sucres dans l’alimentation : de quoi parle-t-on ? », Cahiers de Nutrition et de Diététique, vol. 43, , p. 2S7–2S11 (ISSN 0007-9960, DOI 10.1016/S0007-9960(08)71549-9, lire en ligne, consulté le ).
- Académie française du chocolat et de la confiserie, Encyclopédie du chocolat et de la confiserie, Sous la direction éditoriale de Nikita Harwich, .
- (en) Michael Greger, M.D., « If Fructose is Bad, What About Fruit? », sur Nutrition facts, (consulté le ).
- J. Busserolles (2003), « Le fructose : gare à l’overdose » [PDF], sur nutriaa.com, .
- Anne-Françoise Burnol, biologiste, « Le fructose, un additif problématique ? », sur CNRS Le journal, (consulté le ).
- « Le sucre fructose, définition et description de ce glucide », sur passeportsante.net, (consulté le ).
- F. Ruby (2005), « Le sucre cause-t-il le diabète ? », , sur passeportsante.net.
- Nutriments pour 100 g de pommes.
- Aliments qui peuvent causer des ballonnements et des gaz.
- Wylie-Rosett 2004.
- Havel 2005.
- Bray 2004.
- Dennison, Rockwell et Baker 1997.
- (en) Levi B. et Werman M.J., Long-term fructose consumption accelerates glycation and several age-related variables in male rats, J. Nutr., 1998, 128, 1442-9, .
- (en) McPherson JD, Shilton BH et Walton DJ (1988), Role of fructose in glycation and cross-linking of proteins, Biochemistry, 27, 1901-7, .
- (en) Choi HK et Curhan G, « Soft drinks, fructose consumption, and the risk of gout in men: prospective cohort study », TheBMJ, no 336, , p. 309-312 (DOI 10.1136/bmj.39449.819271.BE, lire en ligne).
- « L’Anses actualise les repères de consommations alimentaires pour la population française », sur anses.fr (consulté le ).
- « Les intolérances au fructose (sucre de fruit), le fructane et autres fructo-oligosaccharides », sur foodintolerances.org (consulté le ).
- « Le sirop de glucose-fructose, emblème de l’ultratransformation », Le Monde, (lire en ligne, consulté le ).
- J. Delarue (2003), « Attention au fructose ! », Alimentation et santé, no 165, .
- « Le fructose, omniprésent, réduit moins l'appétit que les autres sucres », sur Psychomédia, (consulté le ).
- Les signaux de la régulation du comportement alimentaire = Signals regulating eating behavior.
- « Le fructose, cause de l’obésité? », sur Le Devoir, (consulté le ).
- (en) Kathleen A. Page et al., « Effects of Fructose vs Glucose on Regional Cerebral Blood Flow in Brain Regions Involved With Appetite and Reward Pathways », JAMA, vol. 309, no 1, , p. 63-70 (DOI 10.1001/jama.2012.116975, résumé).
- « Satiété : Pourquoi le fructose rassasie moins que le glucose ? », sur santé log, (consulté le ).
- « Sucres : le fructose donne faim et le glucose réduit l'appétit », sur topsante.com, (consulté le ).
- (en-US) Talia Ogliore, « Research reveals how fructose in diet enhances tumor growth », sur The Source, (consulté le )
- (en) Ronald Fowle-Grider, Joe L. Rowles, Isabel Shen et Yahui Wang, « Dietary fructose enhances tumour growth indirectly via interorgan lipid transfer », Nature, , p. 1–8 (ISSN 1476-4687, DOI 10.1038/s41586-024-08258-3, lire en ligne, consulté le )
- (en) Andreia Ribeiro, Maria-Jose Igual-Perez, Ermelinda Santos Silva et Etienne M. Sokal (nl), « Childhood Fructoholism and Fructoholic Liver Disease », Hepatology Communications, vol. 3, no 1, , p. 44–51 (ISSN 2471-254X, PMID 30619993, PMCID PMC6312651, DOI 10.1002/hep4.1291, lire en ligne, consulté le ).
- Taux de fructose dans divers fruits, le miel.
- (en) Fructose, lactic acid and citric acid content of the semen, table 2 [PDF].
- Cours du professeur et chercheur en biochimie Michel Catheline, CHU de Rennes, France[source insuffisante].
Bibliographie
modifier- (en) Judith Wylie-Rosett et al., « Carbohydrates and Increases in Obesity: Does the Type of Carbohydrate Make a Difference? », Obesity Research (en), vol. 12, no S11, , p. 124S-129S (DOI 10.1038/oby.2004.277, lire en ligne).
- (en) P.J. Havel, « Dietary fructose: Implications for dysregulation of energy homeostasis and lipid/carbohydrate metabolism », Nutrition Reviews (en), vol. 63, no 5, , p. 133-157 (DOI 10.1301/nr.2005.may.133-157, lire en ligne).
- (en) P.J. Havel, « Peripheral signals conveying metabolic information to the brain: short-term and long-term regulation of food intake and energy homeostasis », Experimental Biology and Medicine (en), vol. 226, no 11, , p. 963-977 (DOI 10.1177/153537020122601102, lire en ligne).
- (en) G.A. Bray (en), « Consumption of high-fructose corn syrup in beverages may play a role in the epidemic of obesity », American Journal of Clinical Nutrition, vol. 79, no 4, , p. 537-543 (DOI 10.1093/ajcn/79.4.537, lire en ligne).
- (en) Barbara A. Dennison, Helen L. Rockwell et Sharon L. Baker, « Excess Fruit Juice Consumption by Preschool-aged Children Is Associated With Short Stature and Obesity », Pediatrics (en), vol. 99, no 1, , p. 15-22 (lire en ligne) (« Erratum » en octobre dans le même périodique : DOI 10.1542/peds.100.4.733).
- (en) Noori S. Al-Waili, « Natural honey lowers plasma glucose, C-reactive protein, homocysteine, and blood lipids in healthy, diabetic, and hyperlipidemic subjects: comparison with dextrose and sucrose », Journal of Medicinal Food (en), vol. 7, no 1, , p. 100-107 (DOI 10.1089/109662004322984789, lire en ligne).
- (en) Frieder W. Lichtenthaler (de), « Carbohydrates », Ullmann's Encyclopedia of Industrial Chemistry, , p. 48 (lire en ligne) (6e éd.).
Voir aussi
modifierArticles connexes
modifierLiens externes
modifier
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :




