Tétrafluorure de zirconium
Le tétrafluorure de zirconium est un composé chimique de formule ZrF4. Il se présente sous la forme d'un solide blanc cristallisé translucide à indice de réfraction élevé peu soluble dans l'eau et qui s'hydrolyse au-dessus de 50 °C[5].
| Tétrafluorure de zirconium | |||
| |||
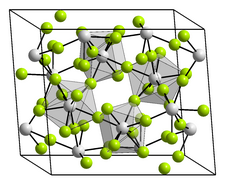
| __ Zr4+ __ F− Structure cristalline du fluorure de zirconium(IV) |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | tetrafluorozirconium | ||
| Synonymes |
fluorure de zirconium(IV) |
||
| No CAS | (monohydrate) |
||
| No ECHA | 100.029.107 | ||
| No CE | 232-018-1 | ||
| No RTECS | ZH7875000 | ||
| PubChem | 82216 | ||
| SMILES | |||
| InChI | |||
| Apparence | poudre blanche[1] | ||
| Propriétés chimiques | |||
| Formule | ZrF4 | ||
| Masse molaire[2] | 167,218 ± 0,002 g/mol F 45,45 %, Zr 54,55 %, |
||
| Propriétés physiques | |||
| T° fusion | 910 °C[3] 640 à 1 184 °C[1] |
||
| T° ébullition | 905 à 1 661 °C[1] | ||
| Masse volumique | 4,43 g/cm3[3] | ||
| Cristallographie | |||
| Système cristallin | monoclinique[4] | ||
| Classe cristalline ou groupe d’espace | I2/c (no 15) [4] |
||
| Paramètres de maille | a = 957 pm, b = 993 pm, c = 773 pm, β = 94,28°[4] | ||
| Précautions | |||
| SGH[1] | |||
| H314, P280, P310, P301+P330+P331, P303+P361+P353 et P305+P351+P338 |
|||
| NFPA 704[1] | |||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Le composé anhydre a une structure cristalline monoclinique stable, notée β, qui appartient au groupe d'espace I2/c (no 15, position 8) et a pour paramètres cristallins a = 957 pm, b = 993 pm, c = 773 pm et β = 94,28°[4]. Il existe également une forme α tétragonale du groupe d'espace P42/m (no 84)[6] ainsi qu'une forme γ non caractérisée[7]. La forme β contient des unités ZrF8 de géométrie antiprismatique carrée dans laquelle chaque atome de fluor est coordonné à deux atomes de zirconium. Le trihydrate ZrF4·3H2O a une structure dimère triclinique[8], le monohydrate ayant quant à lui une structure cristalline tétragonale avec le groupe d'espace I42d (no 122)[9].
On peut obtenir le fluorure de zirconium en faisant réagir du chlorure de zirconium(IV) ZrCl4 avec du fluorure d'hydrogène HF[5] :
Il est également possible de le préparer en traitant du dioxyde de zirconium ZrO2 avec de l'acide fluorhydrique HF[5] :
Il peut être purifié par distillation ou par sublimation[10].
Utilisation
modifierLe fluorure de zirconium entre dans la composition des verres fluorés ZBLAN (en).
Mélangé à d'autres fluorures, tels que par exemple le fluorure de lithium LiF et le fluorure de béryllium BeF2 formant le FLiBe, c'est un liquide de refroidissement utilisé pour la conception de réacteurs nucléaires à sels fondus. Il entrait par exemple dans la conception du réacteur expérimental ARE (en) pour la propulsion nucléaire d'avions supersoniques dans les années 1950[11] ainsi que de son successeur, le réacteur expérimental à sels fondus[12] (MSRE). Mélangé avec du fluorure de sodium NaF, c'est un liquide réfrigérant possible pour réacteurs nucléaires à très haute température.
Notes et références
modifier- « Fiche du composé Zirconium(IV) fluoride, 99.9% (metals basis) », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Zirconium(IV) fluoride, consultée le 30 décembre 2021.
- (en) C. Legein, F. Fayon, C. Martineau, M. Body, J.-Y. Buzaré, D. Massiot, E. Durand, A. Tressaud, A. Demourgues, O. Péron et B. Boulard, « 19F High Magnetic Field NMR Study of β-ZrF4 and CeF4: From Spectra Reconstruction to Correlation between Fluorine Sites and 19F Isotropic Chemical Shifts », Inorganic Chemistry, vol. 45, no 26, , p. 10636-10641 (PMID 17173418, DOI 10.1021/ic061339a, lire en ligne)
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. 1, Ferdinand Enke, Stuttgart 1975, p. 260. (ISBN 3-432-02328-6)
- R. Papiernik, D. Mercurio et B. Frit, « Structure du tétrafluorure de zirconium, ZrF4 α », Acta Crystallographica Section B, vol. B38, , p. 2347-2353 (DOI 10.1107/S0567740882008760, lire en ligne)
- (en) OECD, Federico J. Mompean, Jane Perrone et Myriam Illemassène, Chemical Thermodynamics of Zirconium, Elsevier, 2005,p. 144. (ISBN 978-0080457536)
- (en) R. L. Davidovich, M. A. Pushilin, V. B. Logvinova et A. V. Gerasimenko, « Crystal structure of monoclinic modifications of zirconium and hafnium tetrafluoride trihydrates », Journal of Structural Chemistry, vol. 54, no 3, , p. 541-546 (DOI 10.1134/S0022476613030104, lire en ligne)
- (en) B. Kojic-Prodic, F. Gabela, Z. Ruzic-Toros et M. Sljukic, « Structure of aquatetrafluorozirconium(IV) », Acta Crystallographica Section B, vol. B37, , p. 1963-1965 (DOI 10.1107/S0567740881007772, lire en ligne)
- (en) Ricardo C. Pastor et Morton Robinson pour DirecTV Group Inc, Raytheon Co, Brevet U.S. 4578252A : Method for preparing ultra-pure zirconium and hafnium tetrafluorides, déposé le 14 mai 1985, publié le 25 mars 1986, sur Google Patents.
- (en) W. B. Cottrell, H. E. Hungerford, J. K. Leslie et J. L. Meem, Operation of the Aircraft Reactor Experiment, Oak Ridge National Laboratory, United States Atomic Energy Commission, 6 septembre 1955, DOI 10.2172/4237975.
- (en) « Molten Salt Reactor Experiment », sur public.ornl.gov, Laboratoire national d'Oak Ridge, (consulté le ).





