Lisdexamfétamine
La lisdexamfétamine est un produit chimique. Le dimésylate de lisdexamfétamine (LDX) est la prodrogue de la dextroamphétamine. Son utilisation pharmaceutique est autorisée dans le traitement d'un trouble déficitaire de l'attention/hyperactivité (TDAH). La Food and Drug Administration autorise également son emploi chez l'adulte pour remédier au syndrome d'hyperphagie incontrôlée (en anglais : binge eating disorder).
| Lisdexamfétamine | ||
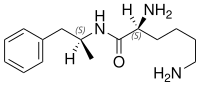
| ||
 | ||
| Identification | ||
|---|---|---|
| DCI | lisdexamfétamine | |
| Nom UICPA | N-[(2S)-1-phényl--2-propanyl]-L-lysinamide | |
| Synonymes |
L-lysine-D-amphétamine, |
|
| No CAS | ||
| Code ATC | ||
| Propriétés chimiques | ||
| Formule | C15H25N3O |
|
| Masse molaire[1] | 263,378 5 ± 0,014 7 g/mol C 68,4 %, H 9,57 %, N 15,95 %, O 6,07 %, |
|
| Considérations thérapeutiques | ||
| Classe thérapeutique | sympathicomimétiques centraux | |
| Voie d’administration | per os | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Histoire
modifierLa lisdexamfétamine fut développée par New River Pharmaceuticals en partenariat avec Shire Pharmaceuticals (racheté par Takeda en 2018). L’objectif annoncé est alors de développer une alternative ayant un potentiel d’abus plus faible et une durée d’action plus longue que les psychostimulants disponibles pour le traitement du TDAH[2]. Des analystes notent à cette époque que le produit phare de Shire pour cette indication, l’Adderall XR, est sur le point de tomber dans le domaine public[3].
En 2007, Shire acquiert New River Pharmaceuticals[4] et commercialise la molécule sous le nom de Vyvanse aux États-Unis[5]. D’abord uniquement indiqué chez l’enfant, Vyvanse est approuvé pour le TDAH de l’adulte en 2008 par la Food and Drug Administration[6]. La molécule est introduite sur le marché canadien en 2010[7].
En 2012, les ventes de Vyvanse augmentent deux fois plus vite que la moyenne de celles des médicaments du TDAH aux États-Unis[8]. La même année, Shire obtient une autorisation de mise sur le marché dans huit pays européens à l’issue d’une procédure décentralisée (Allemagne, Danemark, Espagne, Finlande, Irlande, Norvège, Royaume-Uni et Suède)[9]. La molécule est commercialisée en Suisse en 2014 sous le nom de Elvanse par OpoPharma Vertriebs AG, partenaire commercial de Shire jusqu’à son rachat par Takeda[10].
En 2015, la FDA approuve la lisdexamfétamine pour le traitement du syndrome d'hyperphagie incontrôlée (Binge Eating Disorder). Shire conserve le nom de Vyvanse pour commercialiser son médicament dans cette indication.
Après avoir obtenu une autorisation de mise sur le marché en mai 2020, Takeda rend disponible la lisdexamfétamine dans les pharmacies belges via sa filiale Shire Pharmaceuticals Ireland en novembre 2021[11]. La molécule est alors disponible dans une dizaine de pays européens, mais pas en France (sauf ATU).
En 2023, la FDA autorise les premières versions génériques de la lisdexamfétamine, mettant ainsi fin à l'exclusivité détenue jusqu'alors par Takeda sur cette molécule[12].
La lisdexamfétamine est commercialisée à travers le monde sous les noms suivants (liste non exhaustive) : Aduvanz (version adulte en Norvège), Elvanse (UE, UK et Suisse), Samexid (Chili), Tyvense (Irlande), Venvanse (Brésil), Vyvanse (Australie, Canada, États-Unis, Japon, Singapour).
Efficacité
modifierPharmacologie
modifier
| lisdexamfétamine | |
| Informations générales | |
|---|---|
| Princeps |
|
| Classe | Psychoanaleptiques, psychostimulants, agents utilisés en cas de trouble déficit de l'attention/hyperactivité (TDAH) et nootropiques, ATC code N06BA12 |
| Forme |
|
| Administration | per os |
| Sels | dimésylate |
| Laboratoire | Takeda AG (Suisse), Takeda Canada Inc., Shire Pharmaceuticals Ireland Ltd. |
| Statut légal | |
| Statut légal |
|
| Identification | |
| No CAS | |
| Code ATC | N06BA12 |
| DrugBank | DB01255 |
| modifier | |
Indications
modifierLes spécialités pharmaceutiques à base de lisdexamfétamine sont autorisées dans le traitement d'un trouble déficitaire de l'attention/hyperactivité (TDAH)[14],[15],[16]. La Food and Drug Administration autorise également son emploi chez l'adulte pour remédier au syndrome d'hyperphagie incontrôlée (en anglais : binge eating disorder)[17].
En Belgique, la lisdexamfétamine est indiquée dans le traitement du TDAH chez les enfants de 6 à 18 ans non-répondeurs au méthylphénidate (traitement de deuxième ligne)[11]. Elle n’était pas officiellement pas indiquée dans le traitement du TDAH au-delà de 18 ans au début de sa commercialisation dans ce pays, bien que l’usage de psychostimulants chez les adultes atteints de TDAH y existait (possibilité laissée au médecin de faire une prescription off-label). En mars 2021, le Conseil Supérieur de la Santé de Belgique a recommandé l'usage du méthylphénidate et de la lisdexamfétamine en première intention chez l’adulte souffrant de TDAH, se basant sur deux directives étrangères : une émanant du National Institute for Health and Care Excellence (Royaume-Uni) (NICE NG87), ainsi que celle de la Zorgstandaard ADHD (Pays-Bas)[18]. En 2023, Takeda modifie le résumé des caractéristiques du produit de Elvanse ainsi que sa notice destinée aux patients belges afin d'y indiquer que la lisdexamfétamine est également indiquée dans le cadre d’une prise en charge globale du TDAH chez les adultes présentant des symptômes de TDAH préexistants dans l’enfance. Contrairement aux enfants, une réponse jugée cliniquement insuffisante à un traitement antérieur par méthylphénidate n'est pas mentionnée comme une condition préalable à la prescription de lisdexamfétamine, ce qui semble être en phase avec les recommandations du Conseil Supérieur de la Santé qui recommande son usage en première intention chez cette catégorie de patients.
Effets secondaires et interactions médicamenteuses
modifierInhibition et induction enzymatique in vitro et in vivo
modifierLe dimésylate de lisdexamphétamine n'a pas manifesté d'inhibition des isoformes du CYP450 CYP1A2, CYP2A6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 et CYP3A4 dans des microsomes hépatiques humains ni d'induction du CYP1A2, CYP2B6 ou CYP3A4/5 dans des cultures d'hépatocytes frais humains in vitro.
Une étude clinique in vivo avec le dimésylate de lisdexamphétamine (70 mg) n'a pas montré d'effet clinique notable sur la pharmacocinétique de médicaments qui sont métabolisés par le CYP1A2 (caféine), le CYP2D6 (dextrométhorphan), le CYP2C19 (oméprazole) et le CYP3A4 (midazolam).
Des études in vitro réalisées avec des microsomes hépatiques humains indiquent une inhibition mineure du CYP2D6, CYP1A2 et CYP3A4 par amphétamine, le métabolite actif de la lisdexamphétamine, ou par un ou plusieurs de ses métabolites.
In vitro, le dimésylate de lisdexamphétamine ne s'est révélé ni un substrat ni un inhibiteur de la P-glycoprotéine (P-Gp) et des interactions cliniques avec des médicaments qui sont transportés par la P-Gp sont donc improbables.
Substances dont le taux sanguin peut être influencé par Elvanse
modifierGuanfacine à libération prolongée : dans une étude d'interactions médicamenteuses, l'utilisation de guanfacine à libération prolongée combinée avec Elvanse a augmenté de 19 % la concentration plasmatique maximale de guanfacine, tandis que l'exposition (l'aire sous la courbe concentration-temps: ASC ou AUC) augmente de 7 %. Ces modifications mineures ne devraient pas être cliniquement significatives. Dans cette étude, aucune conséquence n'a été observée après l'administration simultanée de guanfacine à libération prolongée et d'Elvanse sur l'exposition à la dexamphétamine.
Venlafaxine à libération prolongée : dans une étude d'interactions médicamenteuses, l'utilisation de 225 mg de venlafaxine à libération prolongée, un substrat du CYP2D6, en combinaison avec 70 mg d'Elvanse, a entraîné une diminution de 9 % de la valeur de la Cmax et une diminution de 17 % de l'AUC pour le métabolite actif primaire, l'O-desméthylvenlafaxine, ainsi qu'une augmentation de 10 % de la Cmax et une augmentation de 13 % de l'AUC pour la venlafaxine. Elvanse (dextroamphétamine) peut agir comme un inhibiteur faible sur le CYP2D6. Compte tenu du fait que la venlafaxine et l'O-desméthylvenlafaxine sont équipotentes, leur effet combiné sur les paramètres pharmacocinétiques AUC et Cmax est pratiquement annulé. Ces faibles modifications ne devraient pas être cliniquement significatives. Dans cette étude, on n'a pas observé de conséquence sur l'exposition à la dexamphétamine après l'utilisation simultanée de venlafaxine à libération prolongée et d'Elvanse.
Substances et conditions qui modifient la valeur du pH urinaire et agissent sur l'élimination urinaire et la demi-vie de l'amphétamine
modifierL'acide ascorbique et d'autres principes actifs ainsi que d'autres conditions qui acidifient l'urine augmentent l'élimination urinaire et diminuent la demi-vie de l'amphétamine. Le bicarbonate de sodium et d'autres principes actifs et conditions qui alcalinisent l'urine diminuent l'élimination urinaire et augmentent la demi-vie de l'amphétamine.
Inhibiteurs de la monoamine oxydase (IMAO)
modifierElvanse ne doit pas être administré simultanément avec des antidépresseurs IMAO ou avant que 14 jours se soient écoulés à la suite de l'arrêt du traitement avec un IMAO car cela peut augmenter la libération de noradrénaline et d'autres monoamines.
Ceci peut entraîner des céphalées graves et d'autres signes d'une crise hypertensive. Peuvent également survenir toute une série d'effets neurologiques toxiques et une hyperpyrexie (hyperthermie) maligne avec parfois une issue fatale. (voir «Contre-indications»).
Médicaments sérotoninergiques
modifierUn syndrome sérotoninergique survient rarement en lien avec l'administration d'amphétamines, telles que Elvanse, lorsque le médicament est administré en concomitance avec des médicaments sérotoninergiques, y compris les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) et les inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN). Un syndrome sérotoninergique a été rapporté en lien avec un surdosage par les amphétamines, dont Elvanse (voir «Surdosage»).
Substances dont l'effet peut être diminué par les amphétamines
modifierAntihypertenseurs : les amphétamines peuvent diminuer l'effet de la guanéthidine et d'autres antihypertenseurs.
Substances dont l'effet peut être potentialisé par les amphétamines
modifierLes amphétamines potentialisent l'effet analgésique des analgésiques narcotiques.
Substances qui peuvent diminuer l'effet des amphétamines
modifierChlorpromazine : la chlorpromazine bloque les récepteurs de la dopamine et de la noradrénaline et inhibe ainsi l'effet stimulant central des amphétamines.
Halopéridol : l'halopéridol bloque les récepteurs de la dopamine et inhibe ainsi l'effet stimulant central des amphétamines.
Carbonate de lithium : les effets anorexigènes et stimulants des amphétamines peuvent être inhibés par le carbonate de lithium.
Interactions médicamenteuses/interactions avec les analyses de laboratoire
modifierLes amphétamines peuvent entraîner une augmentation considérable du taux de corticostéroïdes dans le plasma. Cette augmentation est maximale le soir. Les amphétamines peuvent perturber la détermination des stéroïdes urinaires. Le résumé des caractéristiques du produit (RCP) du dimésylate de lisdexamfétamine reprend dans un tableau tous les effets indésirables issus des études cliniques ainsi que les annonces spontanées[19],[20].
Par convention, les groupes de fréquence sont :
- très fréquent : ≥1⁄10 ;
- fréquent : ≥1⁄100 à <1⁄10 ;
- occasionnel : ≥1⁄1000 à <1⁄100 ;
- rare : ≥1⁄10000 à <1⁄1000 ;
- très rare : <1⁄10000 ;
- fréquence inconnue : ne peut être estimée sur la base des données disponibles.
Systèmes et classes d'organes sont établis selon la classification MedDRA.
| Système/classe d'organes | Effets indésirables | Enfants (6 à 12 ans) |
Adolescents (13 à 17 ans) |
Adultes |
|---|---|---|---|---|
| Affections du système immunitaire | Réaction anaphylactique | Fréquence non connue | Fréquence non connue | Fréquence non connue |
| Hypersensibilité | Occasionnel | Fréquence non connue | Occasionnel | |
| Troubles du métabolisme et de la nutrition | Diminution de l'appétit | Très fréquent | Très fréquent | Très fréquent |
| Anorexie | Fréquent | Fréquent | Fréquent | |
| Troubles psychiatriques | Insomnie[Note 1] | Très fréquent | Très fréquent | Très fréquent |
| Excitation | Occasionnel | Occasionnel | Fréquent | |
| Angoisse | Occasionnel | Occasionnel | Fréquent | |
| Logorrhée | Occasionnel | Occasionnel | Occasionnel | |
| Diminution de la libido | Sans objet | Non rapporté | Fréquent | |
| Dépression | Occasionnel | Occasionnel | Occasionnel | |
| Tic | Fréquent | Occasionnel | Occasionnel | |
| Labilité émotive | Fréquent | Fréquent | Occasionnel | |
| Dysphorie | Occasionnel | Fréquence non connue | Occasionnel | |
| Euphorie | Fréquence non connue | Occasionnel | Occasionnel | |
| Hyperactivité psychomotrice | Fréquent | Occasionnel | Fréquent | |
| Dermatillo-manie | Occasionnel | Occasionnel | Occasionnel | |
| Épisodes psychotiques | Fréquence non connue | Fréquence non connue | Fréquence non connue | |
| Manie | Occasionnel | Fréquence non connue | Occasionnel | |
| Hallucinations | Occasionnel | Occasionnel | Fréquence non connue | |
| Agressivité | Fréquent | Occasionnel | Fréquence non connue | |
| Affections du système nerveux | Céphalées | Très fréquent | Très fréquent | Très fréquent |
| Vertiges | Fréquent | Fréquent | Fréquent | |
| Agitation | Occasionnel | Occasionnel | Fréquent | |
| Tremblement | Occasionnel | Fréquent | Fréquent | |
| Somnolence | Fréquent | Occasionnel | Occasionnel | |
| Crise convulsive | Fréquence non connue | Fréquence non connue | Fréquence non connue | |
| Dyskinésie | Fréquence non connue | Fréquence non connue | Occasionnel | |
| Affections oculaires | Vision trouble | Occasionnel | Fréquence non connue | Occasionnel |
| Mydriase | Fréquent | Occasionnel | Fréquence non connue | |
| Troubles cardiaques | Tachycardie | Occasionnel | Fréquent | Fréquent |
| Palpitation | Occasionnel | Fréquent | Fréquent | |
| Cardiomyopathie | Fréquence non connue | Fréquence non connue | Fréquence non connue | |
| Organe respiratoire (affections respiratoires, thoraciques et médiastinales) | Dyspnée | Occasionnel | Fréquent | Fréquent |
| Troubles gastro-intestinaux | Sécheresse buccale | Fréquence non connue | Fréquence non connue | Fréquence non connue |
| Diarrhée | Fréquent | Fréquent | Fréquent | |
| Douleurs épigastriques | Très fréquent | Fréquent | Fréquent | |
| Nausées | Fréquent | Fréquent | Fréquent | |
| Vomissements | Fréquent | Fréquent | Occasionnel | |
| Troubles hépatobiliaires | Hépatite à éosinophiles[Note 2] | Fréquence non connue | Fréquence non connue | Fréquence non connue |
| Affection de la peau et des tissus sous-cutanés | Hyperhidrose | Occasionnel | Fréquence non connue | Fréquent |
| Urticaire | Occasionnel | Occasionnel | Occasionnel | |
| Éruption | Fréquent | Occasionnel | Occasionnel | |
| Angio-œdème[Note 3] | Fréquence non connue | Fréquence non connue | Fréquence non connue | |
| Syndrome de Stevens-Johnson[Note 4] | Fréquence non connue | Fréquence non connue | Fréquence non connue | |
| Troubles généraux et anomalies au site d'administration | Irritabilité | Fréquent | Fréquent | Fréquent |
| Fatigue | Fréquent | Fréquent | Fréquent | |
| Nervosité | Occasionnel | Occasionnel | Fréquent | |
| Pyrexie (fièvre) | Fréquent | Occasionnel | Occasionnel | |
| Investigations | Augmentation de la pression artérielle | Occasionnel | Fréquent | Fréquent |
| Perte de poids[Note 5] | Très fréquent | Très fréquent | Fréquent | |
| Troubles des organes de reproduction et des seins | Dysfonction érectile | Sans objet | Occasionnel | Fréquent |
Notes et références
modifierNotes
modifier- Insomnie : comporte insomnie, troubles de l'endormissement et de la continuité du sommeil
- Hépatite à éosinophiles : aucun cas n'a été rapporté dans les études cliniques
- Angio-œdème : aucun cas n'a été rapporté dans les études cliniques
- Syndrome de Stevens-Johnson : aucun cas n'a été rapporté dans les études cliniques
- Perte de poids : Dans une étude contrôlée de 4 semaines avec Elvanse chez des enfants âgés de 6 à 12 ans, la perte de poids mesurée entre la valeur initiale pré-thérapeutique et la dernière évaluation était en moyenne 0,4 0,9 ou 1,1 kg chez des patients qui avaient reçu 30 mg, 50 mg ou 70 mg d'Elvanse. En revanche, chez des patients sous placebo, une prise de poids moyenne de 0,5 kg a été relevée. Des doses plus importantes ont été liées lors de 4 semaines de traitement à des pertes de poids plus importantes. Des examens de suivi étroit du poids chez des enfants âgés de 6 à 12 ans traités par Elvanse pendant une période de 12 mois montrent que les enfants constamment médicamentés (c'est-à-dire avec 7 jours de traitement par semaine tous les jours de l'année) présentaient un ralentissement du taux de croissance de leur poids corporel (ajusté en fonction de l'âge et du sexe) avec une modification moyenne en pour cent de -13,4 sur une année par rapport à la valeur initiale pré-thérapeutique. Le pourcentage moyen avant le début du traitement (n=271) et après 12 mois (n=146) était de 60,9 ou 47,2.
Dans une étude contrôlée de 4 semaines avec Elvanse menée chez des adolescents âgés de 13 à 17 ans, la perte du poids entre la valeur initiale pré-thérapeutique et la dernière évaluation était en moyenne de 1,2 1,9 ou 2,3 kg chez ceux qui recevaient 30 mg, 50 mg ou 70 mg d'Elvanse. En revanche, chez les patients sous placebo, une prise de poids moyenne moyenne de 0,9 kg a été relevée. Des examens de suivi étroit du poids chez des adolescents âgés de 13 à 17 ans traités par Elvanse pendant une période de 12 mois montrent que les adolescents constamment médicamentés (c'est-à-dire avec 7 jours de traitement par semaine tous les jours de l'année) présentaient un ralentissement du taux de croissance de leur poids corporel (ajusté en fonction de l'âge et du sexe) avec une modification moyenne en pour cent de -6,5 sur une année par rapport à la valeur initiale pré-thérapeutique. Le pourcentage moyen avant le début du traitement (n=265) et après 12 mois (n=156) était de 66,0 ou 61,5.
Références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « FDA approves first and only stimulant prodrug VYVANSE as a novel ADHD treatment », sur EurekAlert! (consulté le )
- « Shire secures successor to Adderall XR as US FDA approves Vyvanse: ano », sur www.thepharmaletter.com (consulté le )
- (en) « Shire takeover makes New River founder a billionaire », sur the Guardian, (consulté le )
- (en) « Modest launch seen so far for Shire drug Vyvanse », Reuters, (lire en ligne, consulté le )
- (en) « FDA Approves Vyvanse (lisdexamfetamine dimesylate), the First and Only Once-Daily Prodrug Stimulant to Treat ADHD in Adults », sur Drugs.com (consulté le )
- (en) « VYVANSE® — New ADHD Treatment Option — Now Available In Canada », sur www.takeda.com (consulté le )
- (en) « Analysis: Shire readies Europe for first dose of amphetamine », Reuters, (lire en ligne, consulté le )
- (en) « Positive Response From European Regulatory Procedure Supports Approval Of Elvanse® (Lisdexamfetamine Dimesylate) For ADHD », sur www.takeda.com (consulté le )
- Swissmedic, Rapport d'activités 2014, https://www.swissmedic.ch/dam/swissmedic/fr/dokumente/stab/gesch%C3%A4ftsbericht/geschaeftsbericht2014.pdf.download.pdf/rapport_d_activite2014.pdf
- « La lisdexamfétamine, une nouvelle option thérapeutique chez les enfants et les adolescents atteints de TDAH », Folia Pharmacotherapeutica CBIP, (lire en ligne)
- (en) Sriparna Roy et Sriparna Roy, « Generic drugmakers start shipping copies of Takeda's ADHD drug Vyvanse », Reuters, (lire en ligne, consulté le )
- « Médicaments du TDAH et de la narcolepsie », sur Centre Belge d'Information Pharmacothérapeutique (consulté le )
- (en) Popovic B, Bhattacharya P, Sivaswamy L, « Lisdexamfetamine: a prodrug for the treatment of attention-deficit/hyperactivity disorder », Am J Health Syst Pharm, vol. 66, no 22, , p. 2005-12. (PMID 19890083, DOI 10.2146/ajhp080353)
- (en) Steer C, Froelich J, Soutullo CA, Johnson M, Shaw M, « Lisdexamfetamine dimesylate: a new therapeutic option for attention-deficit hyperactivity disorder », CNS Drugs, vol. 26, no 8, , p. 691-705. (PMID 22762726, DOI 10.2165/11634340-000000000-00000)
- (en) Coghill DR, Caballero B, Sorooshian S, Civil R, « A systematic review of the safety of lisdexamfetamine dimesylate », CNS Drugs, vol. 28, no 6, , p. 497-511. (PMID 24788672, PMCID PMC4057639, DOI 10.1007/s40263-014-0166-2, lire en ligne [PDF])
- (en) « FDA expands uses of Vyvanse to treat binge-eating disorder », sur www.fda.gov, (consulté le )
- Conseil Supérieur de la Santé (Belgique), Prise en charge médicamenteuse et non médicamenteuse du TDA/H. Bruxelles: CSS; 2021. Avis n° 9547, p. 2.
- « Information professionnelle pour Elvanse® », sur ch.oddb.org/fr/ Ywesee, (consulté le )
- « Information professionnelle du Compendium Suisse des Médicaments® : Elvanse® », sur www.compendium.ch, (consulté le )
Voir aussi
modifierArticles connexes
modifierLiens externes
modifier- Page spécifique dans la base de données sur les produits pharmaceutiques (Canada)
- Compendium suisse des médicaments : spécialités contenant Lisdexamfétamine