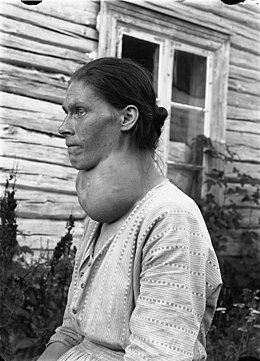
Goitre
Le goitre, ou goître, est une hypertrophie globale ou augmentation de volume, souvent visible, de la glande thyroïde. Cette augmentation peut être normale et transitoire dans des circonstances particulières telles que l'adolescence ou la grossesse.
| Médicament | L-thyroxine, méthimazole, propylthiouracile, thyroglobulin (d), triiodothyronine et L-thyroxine |
|---|---|
| Spécialité | Endocrinologie et médecine nucléaire |
| CISP-2 | T81 |
|---|---|
| CIM-10 | E01-E07, P72 |
| CIM-9 | 240-242 |
| DiseasesDB | 5332 |
| MedlinePlus | 001178 |
| eMedicine | 120034 |
| MeSH | D006042 |
Le goitre endémique est extrêmement fréquent dans le monde (près de 15,8 % de la population mondiale en 2004 est porteuse d'un goitre palpable), il est lié à un déficit en iode touchant près de 2,2 milliards de personnes.
Dans les pays avec supplémentation iodée, le goitre persiste sous forme sporadique. Il est souvent familial mais aussi d'origine acquise ou environnementale. Il est près de quatre fois plus fréquent chez la femme que chez l'homme.
La plupart des goitres sont bénins, et la présence d'un goitre à lui seul ne préjuge pas d'un trouble hormonal de la thyroïde, mais ils sont à surveiller selon leurs caractéristiques et leur évolution.
Les traitements vont de l'abstention thérapeutique (simple surveillance) jusqu'aux traitements radicaux par chirurgie ou iode radioactif.
Étymologie
modifierLe terme goitre apparaît en français en 1552, et celui de goitreux en 1411. Ils ont pour origine le terme latin populaire guttur signifiant gorge, qui devient en ancien français goitron vers 1120. En dialecte lyonnais, vers 1530, le terme gouistre prend le sens de goitre[1],[2].
En latin classique, le terme struma désignait tout gonflement inflammatoire du cou (le plus probablement scrofule), mais il fut utilisé par la suite, en latin médical historique, pour désigner la glande thyroïde[3]. Il reste encore présent, mais de façon désuète, sous la forme strumite pour désigner l'inflammation de la thyroïde (synonyme de thyroïdite, ou de thyroïdite avec goitre), et strumectomie pour l'ablation d'un goitre[4].
Définitions
modifierLe goitre représente une hypertrophie (augmentation de volume) hyperplasique (par augmentation du nombre de cellules) de la glande thyroïde. Dans un sens général, il signifie que le volume de la thyroïde est plus grand que la normale[5].
Le goitre peut être dû à diverses causes, physiologiques et pathologiques. Un goitre physiologique peut survenir, de façon transitoire, lors de variations hormonales normales (adolescence, grossesse...)[5].
Le goitre ne s'accompagne pas forcément d'un trouble de la fonction thyroïdienne, laquelle peut être normale (goitre avec euthyroïdie), insuffisante (hypothyroïdie) ou exagérée (hyperthyroïdie)[6].
Un goitre non toxique est un goitre avec fonctionnement normal de la thyroïde, sans être d'origine inflammatoire ou tumorale. Un goitre toxique est un goitre avec hyperthyroïdie, par exemple celui de la maladie de Basedow[5].
Un goitre peut être simple diffus ou homogène concernant l'ensemble de la thyroïde. Spontanément, il peut évoluer vers un goitre hétérogène avec des zones localisées structurelles ou fonctionnelles diverses : goitre nodulaire (zone unique), multinodulaire (plusieurs zones), hétéromultinodulaire (de causes ou de fonctions différentes)[7].
Le goitre simple ou hyperplasique diffus est dit endémique quand il représente une part notable d'une population (lié le plus souvent à une carence iodée), et sporadique quand il se limite à quelques individus (trouble hormonal d'origine congénitale ou acquise)[6].
Le goitre se développe le plus souvent vers l'avant, à cause de la faiblesse des muscles de la face antérieure du cou : il est dit goitre cervical. Plus rarement, il peut se développer vers le bas, vers et dans la cage thoracique, il est alors dit goitre plongeant puis goitre substernal , rétrosternal, thoracique ou endothoracique[5],[8].
Le goitre cervical historique ou « monstrueux », celui qui se développait jusqu'à descendre devant la poitrine, est dit goitre pendulaire ou en sonnaille[9].
Le terme goitreux s'applique à ceux qui sont atteints d'un goitre, mais surtout à ceux qui sont atteints d'un goitre endémique par carence iodée[9].
Épidémiologie
modifierÀ l'échelle mondiale, le goitre endémique par carence iodée est le plus fréquent, ce déficit touche près de 2,2 milliards de personne. Selon les zones géographiques, cette carence peut être mineure avec une incidence goitreuse de 5 à 20 %, modérée (20 à 30 %) ou majeure (plus de 30 %)[5]. En 2004, l'OMS estime la prévalence des goitres palpables à 15,8 % de la population mondiale[10].
Dans les pays avec supplémentation iodée, il existe une augmentation de l'incidence des nodules thyroïdiens (goitre nodulaire). Cette augmentation est interprétée de deux façons[5] :
- utilisation plus fréquente de l'imagerie, susceptible de détecter les plus petits nodules ;
- causes génétiques ou acquises, comme l'obésité, la résistance à l'insuline, le syndrome métabolique, des facteurs goitrigènes (voir section infra).
Chez les populations avec apport iodé suffisant, la prévalence du goitre multinodulaire est estimée à 4 %, et en France à 4,75 % (selon une étude SU.VI.MAX publiée en 2002). La France est considérée comme une zone de carence minime, où l'apport iodé est globalement au-dessous de la normale[11].
Le goitre est environ 4 fois plus fréquent chez la femme que chez l'homme[5], de 1,2 à 6 selon les auteurs[6],[12]. Cette prévalence augmente avec l'âge : aux États-Unis, les nodules palpables sont présents chez 5 à 6 % des plus de 60 ans, mais à l'autopsie, toujours chez les plus de 60 ans, on retrouve des nodules non palpables chez plus de 50 % des sujets[12].
Il existe des facteurs génétiques (études de jumeaux montrant une prédisposition génétique de 70 à 80 %) mais pas de différences raciales ou ethniques[5].
Le bas statut socioéconomique est un facteur de risque du goitre non toxique, probablement lié à l'accès aux suppléments iodés[12].
Le goitre toxique diffus est la cause la plus fréquente d'hyperthyroïdie aux États-Unis qui touche une personne sur deux cent, le plus souvent entre 30 et 50 ans d'âge, et 7 à 10 femmes pour 1 homme, avec des facteurs familiaux[13].
Causes
modifierLe développement d'un goitre représente une réaction d'adaptation des cellules folliculaires de la thyroïde (cellules fonctionnelles hormonales) en réponse à des stimuli divers, principalement tout ce qui bloque la production hormonale (la thyroïde augmente de volume pour compenser). Différents facteurs peuvent s'intriquer[5].
Cependant, au début du XXIe siècle, en dépit de l'immunologie et de la génomique, il n'existe pas encore d'explication synthétique de la formation des goitres[14].
Carence iodée
modifierÀ l'échelle mondiale, c'est la cause la plus fréquente du goitre. L'iode est un oligo-élément, constituant obligatoire des hormones thyroïdiennes. Un déficit en iode est alors le résultat d'une carence alimentaire.
Cependant, même après la mise en place d'une supplémentation iodée, l'incidence du goitre ne chute pas à zéro, et cette persistance est rapportée à d'autres facteurs environnementaux ou génétiques[5].
Hormones et facteurs de croissance.
modifierUn goitre simple peut être la conséquence d'un hyperfonctionnement hypophysaire par production de thyréostimuline. De même, la production exagérée d'hormone de croissance peut retentir sur la thyroïde, mais le goitre de l'acromégalie est plutôt expliqué par un autre facteur de croissance, l'IGF-1[6].
D'autres facteurs de même type sont susceptibles d'être favorisant comme le facteur de croissance épidermique et le facteur de croissance des fibroblastes. Des cytokines pourraient intervenir lors de l'apparition de goitre au cours d'une thyroïdite.
Le rôle favorisant des œstrogènes est mal connu, mais il pourrait expliquer la prépondérance féminine des goitres[6].
Troubles inflammatoires et auto-immuns
modifierDes inflammation de la thyroïde (thyroïdites) ainsi que des maladies infiltrant la glande comme la sarcoïdose ou l'amylose, peuvent être à l'origine de goitres.
Des maladies auto-immunes de la thyroïde en provoquent également, comme la maladie de Basedow, la thyroïdite de Hashimoto. Par exemple, dans le cas du Basedow, il s'agit d'auto-anticorps dirigés contre les récepteurs de la TSH[5].
Facteurs génétiques
modifierLes facteurs génétiques individuels ou familiaux paraissent prédominants par rapport aux facteurs environnementaux. Un premier gène de susceptibilité au goitre a été identifié en 1997 sous le nom de MNG1 (MultinNodular Goiter 1) situé sur le chromosome 14 (14q31)[11].
Ces facteurs expliquent la survenue répétitive de goitres au sein de familles prédisposées, notamment par endogamie dans des communautés restreintes isolées[6].
La synthèse des hormones thyroïdiennes peut aussi se faire de façon imparfaite par suite d'un déficit enzymatique congénital. D'autres troubles sont des mutations de gènes de protéines servant de symport à l'iodure de sodium, ou de récepteur de la TSH[5].
Une mutation du gène de la pendrine serait responsable du syndrome de Pendred (goitre et surdité congénitale)[11].
Aliments et produits goitrigènes
modifierCe sont des facteurs qui favorisent l'apparition de goitre en diminuant la production d'hormone thyroïdienne. Ils peuvent être alimentaires et médicamenteux, ou d'origine environnementale. Cependant, ils n'ont pas été démontrés comme cause majeure de formation de goitre[5].
Les aliments réputés goitrogènes induisent une excrétion accrue (via l'urine) de l'iode ingéré[16] même au sein de population bénéficiant d'un apport en sel de table iodé[16]. Ces aliments sont riches en glucosinolates et glucosides cyanogénétiques qui sont transformés en thiocyanates dans l'organisme[6],[17] ou en contenant naturellement[18].
Ce sont par exemple les crucifères (le chou de Bruxelles, le chou, le chou-fleur, le brocoli, le chou frisé, les feuilles de moutarde, le rutabaga, le radis, le raifort, etc.), le manioc, la patate douce, les graines de soja, les arachides et le millet. Ils sont en fait rarement en cause dans les pays industrialisés, car l’alimentation est variée et enrichie en iode via le sel de table iodé[19].
Des médicaments peuvent inhiber la captation de l'iode, comme les sels de lithium ou l'amiodarone[5].
Des goitrigènes chimiques environnementaux d'origine industrielle (nitrates, perchlorates...) peuvent contaminer des aliments[20], et agir comme des perturbateurs endocriniens. Les pesticides sont également incriminés comme les organochlorés, les phtalates, les hydrocarbures aromatiques polycycycliques.
De même le tabac est un facteur de risque de goitre[21] en aggravant l'effet antithyroïdien des thiocyanates[17] associés à certaines formes de crétinisme[22].
Les rayonnements ionisants (exposition naturelle ou artificielle) favorisent les goitres nodulaires à risque cancéreux, surtout dans le jeune âge[5].
Diagnostic
modifierLe diagnostic de goitre est clinique, il s'effectue par l'inspection (goitre visible à l'œil nu), par la palpation (goitre de faible dimension), éventuellement par imagerie, notamment l'échographie cervicale.
Thyroïde normale
modifierLa thyroïde se situe à la région antérieure du cou, elle se compose de deux lobes réunis par un isthme transverse placé devant les premiers anneaux de la trachée. La thyroïde, en rapport avec les structures du larynx, monte et descend avec la déglutition.
La glande thyroïde normale mesure en moyenne 4 à 4,8 cm en plan sagittal, 1 à 1,8 cm en transverse et 0,8 à 1,6 cm en frontal[5] ; ou pour chaque lobe, 5 cm de hauteur, 3 cm de largeur et 2 cm d'épaisseur[6]. Son volume est de 7 à 10 ml, et sa masse de 10 à 20 gr[5].
Les dimensions de la thyroïde augmentent avec l'âge et la corpulence, elle est plus grande chez l'homme que chez la femme. Ces dimensions varient selon l'apport iodé (la taille augmente avec la carence pour capter plus d'iode disponible, et elle diminue avec l'apport iodé). Aussi, les dimensions « normales » de la thyroïde peuvent varier historiquement dans les études : non seulement avec le statut thyroïdien (état hormonal) des sujets, mais aussi selon les régions géographiques (zones de carence iodée) et selon l'époque (institution ou pas d'une supplémentation en iode)[23].
Jusqu'au milieu du XXe siècle, la plupart des auteurs considéraient que la limite supérieure de la masse de la thyroïde était de 35 g. Depuis la supplémentation en iode des pays développés, elle est de l'ordre de 20 g dans les pays occidentaux[23] (moins de 18 g chez la femme, et moins de 25 g chez l'homme adulte[6]).
Examen clinique
modifierUne première définition internationale du goitre (pour servir à des études épidémiologiques) a été proposée par l'OMS en 1960 : une glande thyroïde est considérée comme goitreuse lorsque chaque lobe latéral a un volume supérieur à la dernière phalange des pouces du sujet examiné[24]. En 1979, l'OMS recommande la palpation comme la méthode la plus fiable et la plus précise pour diagnostiquer le goitre endémique et estimer son importance[25].
Différentes classifications définissent différents grades de goitre (de 4 à 5 grades) par exemple :
- grade 0 : une thyroïde non palpable et non visible. C'est le cas normal ;
- grade 1 : goitre palpable mais non visible lorsque le cou est en position normale, même si l'hypertrophie de la thyroïde n'est pas visible. Les nodules thyroïdiens dans une thyroïde non hypertrophiée entrent dans cette catégorie ;
- grade 2 : un gonflement du cou qui est nettement visible lorsque le cou est en position normale et est cohérent avec une thyroïde hypertrophiée à la palpation du cou ;
- grade 3 : un gonflement du cou si important qu'il est visible à une distance de 30 mètres[3].
La classification simplifiée de l'OMS se fait en 3 grades et ne comporte que les grades 0, 1 et 2[24],[25].
Il peut exister des faux positifs : thyroïde palpable chez un sujet maigre, situation de la thyroïde un peu plus haute que la normale, long cou incurvé (ou « syndrome de Modigliani ») , et des faux négatifs (examen inattentif, cou court et épais, thyroïde bas-située). Il existe ainsi une variabilité des résultats dépendant des observateurs (plus ou moins expérimentés, ou selon les conditions du moment)[23].
L'OMS admet une marge d'erreur de 5 % dans l'évaluation des goitres (études épidémiologiques). Elle définit par convention le goitre endémique lorsqu'il est présent dans plus de 10 % de la population (ce qui indique un facteur environnemental), le seuil de 5 % (surtout chez les enfants d'âge scolaire) représentant un signal d'alerte de santé publique[25].
La confirmation du goitre peut se faire par imagerie. L'échographie cervicale visualise les lobes thyroïdiens et recherche des nodules, précisant leur taille et leur aspect liquidien (kyste) ou solide. Le scanner ou l'IRM est utile en cas de goitre plongeant avec signes compressifs[12].
Une scintigraphie thyroïdienne peut se révéler nécessaire pour étudier le fonctionnement de la glande. Une étude cytologique des nodules par cytoponction (aspiration à l'aide d'une aiguille fine) est parfois réalisée. Enfin, le dosage des hormones thyroïdiennes révèle une éventuelle augmentation ou une diminution de celles-ci.
Formes histologiques
modifierOutre la distinction entre goitre diffus homogène et goitre nodulaire, il existe une classification histologique des goitres (examen au microscope du tissu goitreux).
- Les goitres parenchymateux sont constitués de vésicules de petite taille, pauvres en colloïde (de thyroglobuline). Les goitres diffus de ce type sont plus fréquents chez l'enfant. Chez l'adulte, ces vésicules se regroupent en nodules sphériques de quelques mm à plusieurs cm de diamètre ; les plus gros nodules ont tendance à s'entourer d'une capsule fibreuse.
- Les goitres colloïdes sont constitués de vésicule dilatées, riches en colloïdes. Ces goitres sont plus mous que les précédents, lorsqu'ils sont nodulaires, les nodules ne sont pas encapsulés.
- Les goitres nodulaires hyperplasiques sont constitués de très nombreux petits nodules, de moins d'un cm de diamètre.
Les goitres diffus peuvent associer les deux premières variétés (goitre dit polymorphe). Beaucoup de goitres nodulaires associent plusieurs zones de type différent[6].
Évolution et complications
modifierLa plupart des goitres sont bénins. Spontanément, un goitre simple peut rester de petite taille. Il peut aussi se développer de façon lente et régulière et entraîner à terme des signes compressifs. Il peut aussi diminuer de volume comme dans certaines thyroïdites.
Les goitres diffus homogènes peuvent évoluer à la longue vers des goitres nodulaires ou multinodulaires, qui sont à surveiller plus étroitement (fonction thyroïdienne, risque de transformation maligne...)[11].
Compression
modifierOn recherche des signes de compression des organes de voisinage, c'est-à-dire :
- une gêne respiratoire, essoufflement voire étouffement (dyspnée par compression de la trachée entraînant une sténose trachéale avec trachéomalacie) ;
- une modification de la voix (dysphonie par compression du nerf récurrent) ;
- un syndrome de Claude Bernard-Horner (par compression du nerf sympathique cervical) ;
- un gonflement du cou (œdème par syndrome cave supérieur dû à la compression gênant le retour veineux dans la veine cave supérieure) ;
Plus rarement (structures plus éloignées)[6] :
- une gêne à la déglutition (dysphagie par compression de l'œsophage) ;
- exceptionnellement syncopes à répétition par compression et irritation du glomus carotidien.
Fonction hormonale
modifierUn goitre nodulaire peut devenir toxique en sécrétant des hormones thyroïdiennes de façon excessive, et entraîner alors une hyperthyroïdie. Un goitre très ancien, ou le goitre endémique, peuvent évoluer au contraire vers un déficit en hormones thyroïdiennes[6]. En l'absence de supplémentation iodée, le goitre endémique peut entrainer un crétinisme.
Inflammation
modifierLa thyroïdite est une inflammation de la thyroïde, mais l'ancien synonyme strumite est parfois utilisé pour désigner plus particulièrement l'inflammation d'un goitre. Cette inflammation peut être d'origine infectieuse, immunologique, chimique ou physique (rayonnement)[6].
Le goitre est douloureux, parfois compressif, dans un contexte fébrile avec syndrome biologique inflammatoire.
Hématocèle
modifierL'hématocèle est un saignement enkysté. Il est susceptible de se produire dans un goitre (hémorragie ou nécrose dans un nodule), avec apparition rapide d'un nodule douloureux qui grossit dans la journée. Le diagnostic est échographique, confirmé par la ponction qui soulage le patient[6].
Transformation maligne
modifierCette éventualité est relativement peu fréquente (environ 3 à 5 % des cas). Elle est envisagée en cas de modification récente d'un goitre ancien stabilisé : il peut s'agir du cancer anaplasique de la thyroïde survenant chez le sujet âgé, et du lymphome de la thyroïde qui peut compliquer une thyroïdite d'Hashimoto (sujet plus jeune)[6].
Traitement
modifierL'abstention thérapeutique, éventuellement associée à une simple surveillance régulière, est indiquée en cas de goitre peu volumineux, non évolutif, dépourvu de nodule suspect à l'échographie[11].
Le traitement est proposé en fonction de l'évolution et de la cause du goitre, son type et sa taille, de l'existence de comorbidité et du ressenti du patient (notamment le préjudice esthétique)[6] :
- apport d'iode exogène en cas de carence iodée, traitement qui fut possible après la découverte de l'iode par Bernard Courtois ;
- administration d'hormones thyroïdiennes en cas de synthèse déficiente de celles-ci ;
- antithyroidiens de synthèse, comme le carbimazole, en cas d'hyperthyroïdie et en préalable à un traitement plus radical[11],[13] ;
- thyroïdectomie ou ablation de la thyroïde, totale ou partielle, en cas de présence de signes de compression, de malignité, ou bien dans certains cas d'hyperthyroïdie. En cas de contre-indication chirurgicale, voire en alternative à la chirurgie, des équipes proposent un traitement par iode radioactif (Iode 131 dont la demi-vie est de 8,02 jours).
Plus discuté est le traitement au long cours par lévothyroxine pour prévenir l'évolution d'un goitre (par le biais d'un « freinage » hypophysaire). Parfois utilisé chez le sujet jeune en cas de goitre récent, il est contre-indiqué chez le sujet âgé[6]. Il n'est plus guère recommandé au niveau international à cause d'une efficacité limitée et des effets indésirables[5].
Quelle que soit l'option choisie, une surveillance régulière clinique (palpation) et échographique est recommandée[5] ; en France, les recommandations de l'échographie thyroïdienne sont élaborées par la HAS[26].
Histoire
modifierAntiquité et Moyen Âge
modifierLes Grecs anciens utilisaient le terme bronchocele pour désigner toutes les tuméfactions du cou. Vers 127 a.p. J.C, le satiriste romain Juvénal écrit « qui peut s'étonner d'un cou gonflé dans les Alpes ? » (Satires, XIII, 120-174), indiquant la connaissance du goitre endémique dans le monde romain[3].
Des médecins chinois de la dynastie des Tang (618-907) ont été les premiers à traiter avec succès des patients atteints de goitre en utilisant la glande thyroïde riche en iode d'animaux comme les moutons et les porcs – ils la faisaient prendre soit telle quelle, soit en pilule, soit en poudre, soit en poudre mêlée à du vin. On en trouve la description dans un livre de Zhen Quan (mort en 643), ainsi que dans plusieurs autres. Un livre chinois (La Pharmacopée du laboureur céleste) affirme que la sargasse riche en iode était utilisée au Ier siècle av. J.-C. pour traiter les patients atteints de goitre, mais ce livre a été écrit beaucoup plus tard.
Au XIIe siècle un médecin persan, Zayn al-Din al-Jurjani (en) a donné la première description de la maladie de Basedow après avoir remarqué l'association du goitre et de l'exophtalmie dans son Thesaurus du shah de Khwarazm, le plus important dictionnaire médical de son temps. Al-Jurjani a également établi une association entre le goitre et la palpitation[27].
Renaissance et époque classique
modifierParacelse (1493-1541) a été le premier à proposer une relation entre le goitre et certains minéraux (en particulier le plomb) dans l'eau de boisson, ainsi qu'entre le goitre et un retard mental. Cette dernière association est bien décrite par Felix Platter en 1562[3].
En Occident, la glande thyroïde en elle-même n'est clairement identifiée chez l'homme que vers la fin du XVIe siècle (Eustachi, 1552) et c'est d'Acquapendente qui montre qu'un goitre est un élargissement anormal de la thyroïde en 1619[3].
Le goitre endémique est particulièrement étudié au XVIIIe siècle. Il était commun dans les régions dont le sol était pauvre en iode (en particulier les zones montagneuses, comme les Alpes ou les Pyrénées). Dans les Midlands, en Angleterre, on connaissait la maladie sous le nom de « cou du Derbyshire ». Aux États-Unis, on trouvait des goitres dans les régions des Grands Lacs et du Midwest. Toutefois, le « crétinisme goitreux » reste rare en dehors de ces régions, et la plupart des médecins n'en voient jamais. Le terme goitre peut désigner toute tuméfaction du cou, et le terme crétinisme tout retard mental sans rapport avec un goitre ou la thyroïde.
À la fin du XVIIIe siècle, Fodéré définit et fixe les signes cliniques du crétinisme goitreux endémique selon le sens moderne, dans deux mémoires : Essai sur le goitre et le crétinage (1792) et Traité du goitre et du crétinisme (1799).
Période moderne
modifierL'iode a été découvert plus tard par Bernard Courtois en 1811, à partir de cendre d'algues. Jean-François Coindet, médecin suisse, publie les résultats de son traitement à l'iode, de 1817 à 1821.
La maladie a ensuite reçu le nom d'un médecin irlandais, Robert James Graves, qui a décrit en 1835 un cas de goitre avec exophtalmie. On parle plutôt en France de maladie de Basedow, d'après Carl Adolph von Basedow, un Allemand qui, de façon indépendante, a décrit le même syndrome en 1840 ; des rapports antérieurs sur cette maladie avaient également été publiés par les Italiens Giuseppe Flajani et Giuseppe Antonio Testa, respectivement en 1802 et 1810, et par le médecin anglais Caleb Hillier Parry, un ami d'Edward Jenner, à la fin du XVIIIe siècle.
En 1918, un médecin valaisan, Otto Bayard, est le premier à mélanger de l'iode au sel de cuisine. Son effet démontré sur la lutte contre le goitre, la Suisse entame une campagne nationale d'iodisation du sel, bientôt reprise par d'autres pays.
Aujourd'hui le goitre endémique a pratiquement disparu dans les pays riches, où le sel de table contient de l'iode, mais il se rencontre encore en Inde, en Asie centrale et en Afrique centrale.
Chirurgie du goitre
modifierAu IIe siècle, Galien suggère l'ablation chirurgicale du goitre, en soulignant le risque lié à la proximité avec les nerfs laryngés.
Au Xe siècle, le chirurgien arabe Albucasis décrit avec précision l'ablation du goitre en insistant sur sa difficulté à cause de la présence de nombreux vaisseaux sanguins[14].
À la fin du XVIIIe siècle, les chirurgiens discutent toujours de la faisabilité de cette opération, en particulier les risques hémorragiques (conditions de ligature des vaisseaux). Ce problème parait résolu par Pierre Joseph Desault en 1791, mais cette chirurgie reste marquée par une forte mortalité qui en limite l'utilisation.
À partir des années 1870, avec les progrès de l'anesthésie et de l'asepsie, les chirurgiens se montrent plus audacieux et expérimentateurs. Ils pratiquent plusieurs milliers de thyroïdectomies dans de bonnes conditions de sécurité opératoire. Mais ils constatent alors que les opérés réussis sombrent dans des conditions qui ressemblent au myxœdème et au crétinisme[14].
Cette chirurgie du goitre conduit à des recherches détaillées sur l'anatomie pathologique des goitres (formes histologiques), conjointement à la chimie physiologique de la thyroïde. Celle-ci devient le lieu d'accumulation de « l'iode animal », ainsi s'élaborent progressivement les concepts de sécrétion thyroïdienne et de production hormonale[14].
Notes et références
modifier- Alain Rey, Dictionnaire culturel en langue française, t. II, Le Robert, (ISBN 978-2-84902-177-4), p. 1379-1380.
- Albert Dauzat, Nouveau dictionnaire étymologique et historique, Larousse, , p. 347
- (en) C.T. Sawin, Goiter, Cambridge, Cambridge University Press, , 1176 p. (ISBN 0-521-33286-9), p. 750-756dans The Cambridge World History of Human Disease, K.F. Kiple (dir.).
- Garnier Delamare, Dictionnaire illustré des termes de médecine, Paris, Maloine, , 1094 p. (ISBN 978-2-224-03434-4), p. 890.
- Ahmet S. Can et Anis Rehman, « Goiter », dans StatPearls, StatPearls Publishing, (PMID 32965832, lire en ligne)
- Marc Klein, « Goitre et nodule thyroïdien », La Revue du Praticien, vol. 58, , p. 1249-1259.
- Marc Klein, « Classification et épidémiologie des tumeurs thyroïdiennes », La Revue du Praticien, vol. 46, no 19 « Tumeurs du corps thyroïde », , p. 2288-2295.
- Smain Nabil Mesli, Derbali Regagba, Anisse Tidjane et Fouad Bouallou, « Le goitre plongeant à Tlemcen dans l'ouest algérien: aspect clinique et thérapeutique de 1996-2014 », The Pan African Medical Journal, vol. 21, (ISSN 1937-8688, PMID 26405494, PMCID 4564399, DOI 10.11604/pamj.2015.21.58.6615, lire en ligne, consulté le )
- Garnier Delamare 2017, op. cit., p. 399.
- (en) WHO, « Iodine status worlwide », sur apps.who.int, , p. 14 et 23 du document.
- Jacques Leclere, « Goitres multinodulaires », La Revue du Praticien, vol. 55, no 2 « Pathologie de la thyroïde », , p. 167-173.
- Fadi M. Alkabban et Bhupendra C. Patel, « Nontoxic Goiter », dans StatPearls, StatPearls Publishing, (PMID 29489295, lire en ligne)
- Gauri Singh et Ricardo Correa, « Diffuse Toxic Goiter », dans StatPearls, StatPearls Publishing, (PMID 32491782, lire en ligne)
- Philippe Fragu, « Goitre », dans Dominique Lecourt (dir.), Dictionnaire de la pensée médicale, Paris, Quadrige / PUF, 2004, (ISBN 2-13-053960-2), p. 521-525
- « Barry (18..-19..) - Auteur », sur data.bnf.fr (consulté le ).
- (en) Heinisch M, Kumnig G, Asbock D, Mikosch P, Gallowitsch HJ, Kresnik E, Gomez I, Unterweger O & Lind P. « Goiter prevalence and urinary iodide excretion in a formerly iodine-deficient region after introduction of statutory lodization of common salt » Thyroid 2002 12 809–14.
- (en) V F H Brauer, H Below, A Kramer, D Führer et Paschke. « The role of thiocyanate in the etiology of goiter in an industrial metropolitan area » Eur J Endocrinol. 2006;154:229-235 DOI 10.1530/eje.1.02076
- (en) Weuffen W, Kramer A, Below H, Bohland H, Julich WD, Thurkow B & Burth U. « The thiocyanate ion as a physiologically significant active substance in living nature » Pharmazie 1990 45 16–29.
- Organisation mondiale de la santé, Demander à l’expert - La carence en iode peut-elle réellement provoquer des lésions cérébrales ?, OMS (www.who.int ; Consulté 30 avril 2010])
- (en) Tonacchera M, Pinchera A, Dimida A, Ferrarini E, Agretti P, Vitti P, Santini F, Crump K & Gibbs J. « Relative potencies and additivity of perchlorate, thiocyanate, nitrate and iodide on the inhibition of radioactive iodide uptake by the human sodium iodide symporter » Thyroid 2004;14:1012–9.
- (en) Zhonghua Liu Xing Bing Xue Za Zhi. 2007 Jan;28(1):53-6. « [Epidemiological study of the effects of smoking cigarette on thyroid gland] » [Article in Chinese] Gu XL & Col. Department of Endocrinology, 1st Affiliated Hospital, China Medical University, Shenyang 110001, China.
- (en) Laurberg P, Andersen S, Knudsen N, Ovesen L, Nohr SB & Bulow Pedersen I. « Thiocyanate in food and iodine in milk: from domestic animal feeding to improved understanding of cretinism » Thyroid 2002 12 897–902
- Kerry Siminoski, « Does This Patient Have a Goiter ? », Journal of the American Medical Association, vol. 273, no 10, , p. 813-817
- « who.int/vmnis/iodine/data/sour… »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?).
- (en) « Goitre as a determinant of the prevalence and severity of iodine deficiency disorders in populations », sur www.who.int (consulté le )
- « Pertinence de l’échographie thyroïdienne chez l’adulte - Note de cadrage », sur Haute Autorité de Santé (consulté le )
- (en) I. Nabipour, « Clinical Endocrinology in the Islamic Civilization in Iran », International Journal of Endocrinology and Metabolism, no 1, , p. 43-45. (lire en ligne)
Voir aussi
modifierArticles connexes
modifier- Thyroïde
- Nodule thyroïdien
- Goitre exophtalmique (Maladie de Basedow)
- Carence en iode
- Carence en iode en Chine
- Crétinisme
Articles
modifier- P. Langer, Histoire du goître (texte intégral) [PDF], Genève, 1962.
- Lucien Mayet, « Nouvelles recherches sur la répartition géographique du goitre et du crétinisme ». In: Bulletins et mémoires de la société d'anthropologie de Paris, V° Série, Tome 2, 1901, pp. 431–436.
- (en) F. Merke, « The History of Endemic Goitre and Cretinism in the Thirteenth to Fifteenth Centuries [ Abridged ] », Proceedings of the Royal Society of Medicine, vol. 53, no 12, , p. 995–1002 (ISSN 0035-9157, DOI 10.1177/003591576005301202, lire en ligne, consulté le )
- Gueorguiev Svetoslav, « Petite histoire de l'iode et du goitre » [PDF], Université de Limoges – Faculté de Médecine, 2010.