Disulfure de tungstène
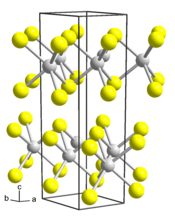
Le disulfure de tungstène, ou sulfure de tungstène(IV), est un composé chimique de formule WS2. Il se présente sous la forme d'une poudre gris-bleu tirant sur le noir ininflammable et très peu soluble dans l'eau cristallisant dans le système hexagonal avec le groupe d'espace P63mmc (no 194) et les paramètres a = 313,2 pm et c = 1 232,3 pm. On en connaît également une structure cristalline trigonale du groupe d'espace R3m (no 160) avec les paramètres a = 315,8 pm et c = 1 849 pm[7]. Il existe naturellement dans un minéral rare appelé tungsténite (en). On le retrouve dans certains catalyseurs d'hydrodésulfuration et d'hydrodénitrification (en).
| Disulfure de tungstène | |
| |
| __ W4+ __ S2− Structure cristalline du disulfure de tungstène |
|
| Identification | |
|---|---|
| Synonymes |
sulfure de tungstène(IV) |
| No CAS | |
| No ECHA | 100.032.027 |
| No CE | 235-243-3 |
| No RTECS | YO7716000 |
| PubChem | 82938 |
| ChEBI | 30521 |
| SMILES | |
| InChI | |
| Apparence | Poudre gris-bleu inodore pratiquement insoluble dans l'eau[1] |
| Propriétés chimiques | |
| Formule | WS2 |
| Masse molaire[2] | 247,97 ± 0,02 g/mol S 25,86 %, W 74,14 %, |
| Propriétés physiques | |
| T° fusion | 1 250 °C[1] |
| Masse volumique | 7,5 gcm/3[1] à 20 °C |
| Propriétés électroniques | |
| Largeur de bande interdite | Matériau massif : ~1,35 eV[3],[4] Monocouche : ~2,05 eV[5]. |
| Précautions | |
| SGH[1] | |
| H315, H319, H335, P261 et P305+P351+P338 |
|
| NFPA 704[6] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le WS2 adopte une structure lamellaire semblable à celle du disulfure de molybdène MoS2, avec les atomes des tungstène dans la sphère de coordination prismatique trigonale, à la place des atomes de molybdène, et peut former des nanotubes minéraux, découverts en 1992 en chauffant un échantillon mince de WS2[8].
Le disulfure de tungstène peut être obtenu directement en faisant réagir du tungstène avec du soufre :
Il peut également être obtenu en faisant réagir du trioxyde de tungstène WO3 avec du soufre[9] :
Notes et références
modifier- Entrée « Tungsten disulfide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 22 octobre 2021 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) K. K. Kam et B. A. Parkinson, « Detailed photocurrent spectroscopy of the semiconducting group VIB transition metal dichalcogenides », The Journal of Physical Chemistry, vol. 86, no 4, , p. 463-467 (DOI 10.1021/j100393a010, lire en ligne)
- (en) Joseph A. Baglio, Gary S. Calabrese, Emil Kamieniecki, Robert Kershaw, Clifford P. Kubiak, Antonio J. Ricco, Aaron Wold, Mark S. Wrighton et Glenn D. Zoski, « Characterization of n‐Type Semiconducting Tungsten Disulfide Photoanodes in Aqueous and Nonaqueous Electrolyte Solutions: Photo‐oxidation of Halides with High Efficiency », Journal of the Electrochemical Society, vol. 129, no 7, , p. 1461-1472 (DOI 10.1149/1.2124184, Bibcode 1982JElS..129.1461B, lire en ligne)
- (en) Humberto R. Gutiérrez, Nestor Perea-López, Ana Laura Elías, Ayse Berkdemir, Bei Wang, Ruitao Lv, Florentino López-Urías, Vincent H. Crespi, Humberto Terrones et Mauricio Terrones, « Extraordinary Room-Temperature Photoluminescence in Triangular WS2 Monolayers », Nano Letters, vol. 13, no 8, , p. 3447-3454 (PMID 23194096, DOI 10.1021/nl3026357, Bibcode 2013NanoL..13.3447G, arXiv 1208.1325, lire en ligne)
- « Fiche du composé Tungsten sulfide, 99.8% (metals basis) », sur Alfa Aesar (consulté le ).
- (en) « Tungstenite », sur handbookofmineralogy.org (consulté le ).
- (en) R. Tenne, L. Margulis, M. Genut et G. Hodes, « Polyhedral and cylindrical structures of tungsten disulphide », Nature, vol. 360, no 6403, , p. 444-446 (DOI 10.1038/360444a0, Bibcode 1992Natur.360..444T, lire en ligne)
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. 2, Ferdinand Enke, Stuttgart, 1978, p. 1574. (ISBN 3-432-87813-3)

