Délétion de la spermatogenèse
Le phénomène dit de « délétion de la spermatogenèse » décrit une dégradation générale (en quantité et qualité) de la production moyenne de spermatozoïdes, observée chez l'être humain depuis les années 1950 au moins, dans les pays riches (faute d'études et de données produites ou disponibles dans les pays en développement). Il peut être lié à une diminution du nombre total de spermatozoïdes par éjaculat, à une réduction du volume de l'éjaculat et/ou à une dégradation de la qualité des spermatozoïdes.
(dans les pays riches)
Cliquer sur le triangle bleu pour l'image suivante ou précédente
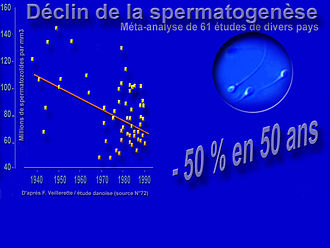
Après ajustement (âge et durée de l'abstinence sexuelle), sur ces 20 ans, chaque nouvelle génération (par année civile de naissance) a perdu 2,6 % des spermatozoïdes de la cohorte née l'année précédente, et le taux de spermatozoïdes mobiles a diminué de 0,3 % par an, et celui des spermatozoïdes de forme normale a diminué de 0,7 %/an.
Parallèlement, la proportion de spermatozoïdes normalement mobile chutait de 0,6 % /an et celle des spermatozoïdes normalement conformés diminuait de 0,5 % par an[1].

Ce phénomène présente d'importantes variations géographiques, en partie encore inexpliquées ; ainsi dans les années 1980, la Finlande semble épargnée au point qu'on parle d'exception finlandaise, alors que le Danemark qui n'en est séparé que par la Baltique, serait le pays d'Europe où les hommes ont perdu le plus de spermatozoïdes depuis le milieu du XXe siècle. La baisse de production de spermatozoïdes semble affecter autant les Danois en bonne santé apparente, que ceux qui consultent pour des difficultés à procréer, mais pas en Finlande[2] chez les hommes ayant un problème de fertilité.
Quand ce phénomène est associé à des malformations génitales susceptibles d'avoir été induites in utero par un dysfonctionnement du testicule de l'embryon, on parle de Syndrome de dysgénésie testiculaire. Chez l'enfant qu'il affecte, ce syndrome est associé à l'augmentation du risque de développer un cancer du testicule, dans la prime jeunesse ou à l'âge adulte.
L'ampleur, l'augmentation et les conséquences de ce phénomène, sur le plan de la fertilité humaine, fait envisager des causes environnementales anthropiques[3], encore discutées et ayant fait l'objet de controverses, parfois vives dans les années 1990.
Une exposition générale de la population (in utero pour l'embryon) à des produits chimiques reprotoxiques et plus précisément à des perturbateurs endocriniens est fortement soupçonnée.
Pour l'instant la baisse du nombre des spermatozoïdes affecte a priori peu la taille de la famille, mais deux questions graves sont posées en ce qui concerne le développement durable et la santé publique :
- un sperme de mauvaise qualité a-t-il des conséquences sur la santé du futur enfant et adulte qu'il engendrera ? et avec quelles conséquences globales à moyen et long terme pour l'humanité ?
- au rythme des 50 dernières années si l'on retient la tendance suggérée par les méta-analyses publiées (dont la méthodologie et/ou la représentativité sont – pour certaines études prises en compte – contestées par les représentants de l'industrie chimique), les mâles reproducteurs devraient ne plus pouvoir produire de spermatozoïdes vers 2070.
Phénomène émergent, et lente prise de conscience
modifierDès les années 1970, quelques spécialistes s'étonnent de différences géographiques et temporelles dans la qualité du liquide séminal, et plus particulièrement d'un nombre anormalement bas de spermatozoïdes, phénomène qui semble devenir plus fréquent.
Très vite, le professeur Niels E. Skakkebaek[4] met en évidence une corrélation statistiquement significative de ce déclin avec une fréquence accrue de malformations génitales et notamment du testicule chez le petit garçon ; autant de problèmes pouvant avoir comme cause commune une perturbation hormonale in utero. Il propose alors avec Richard Sharpe[5] de nommer cet ensemble de symptômes « syndrome TDS » (Testicular dysgenesis syndrome). Leur hypothèse explicative est celle d'une perturbation endocrinienne au moment de la formation des testicules du fœtus. C'est un moment-clé du développement où, via les hormones produites par les testicules naissants, est lancé le « programme de masculinisation » qui différenciera les organes masculin et féminin.
Historique
modifierEn 1972, trois chercheurs danois comparent les spermogrammes de 1000 patients examinés en 1972 avec ceux de 1077 hommes examinés 20 ans plus tôt (en 1952). En 20 ans, le volume moyen de l'éjaculat n'a pas changé, ni le nombre de spermatozoïdes immobiles, mais de 1952 à 1972 le nombre moyen de spermatozoïdes par ml de sperme a spectaculairement chuté chez les Danois observés, passant de 73,4 millions de spermatozoïdes par ml à 54,5. De plus ces spermatozoïdes sont moins mobiles et plus fréquemment malformés (alors qu'en 1952, 26 % des spermatozoïdes étaient mal formés, ce taux avait presque doublé en 20 ans, atteignant 44,8 % en 1972). L'étude concluait que cette dégradation du sperme pourrait expliquer la détérioration de la fécondité masculine observée par les médecins.
10 ans plus tard, dans les années 1980, de premiers « lanceurs d'alerte » (danois encore) attirent l'attention sur le fait que ce phénomène n'est pas propre au Danemark : tous les comptages de spermatozoïdes faits lors des années 1935 à 1980 révèlent un déclin marqué du nombre de spermatozoïdes ; partout dans le monde où des données sont suffisantes pour les outils statistiques sur plusieurs années ou décennies.
Les données extraites de plus d'une soixantaine d'études laissent envisager qu'au moins dans les pays occidentaux, existe un problème général de dégradation de la spermatogenèse. L'ampleur du phénomène, ses causes et sa traduction sur le plan de la fertilité masculine font cependant encore l'objet de controverses.
W.H. James, qui est aussi un spécialiste des anomalies de sex-ratio à la naissance, estime en 1980 qu'« il ne peut y avoir aucun doute raisonnable quant au fait que la moyenne du nombre de spermatozoïdes comptés par millilitre de sperme décline avec le temps, au moins depuis 1960 »[6], et ces alertes seront rapidement contestées par divers médecins qui ne croient pas à ces chiffres et/ou par des représentants de l'industrie chimique.
À la fin des années 1980, ce sont les écologues et écotoxicologues qui alertent l'opinion et les décideurs, car ils observent des pathologies similaires dans la faune sauvage. Cette fois, certaines causes sont identifiées et reproductibles (exposition à des œstrogènes ou « mimes chimiques » d'hormones féminines), y compris hors du monde des mammifères (oiseaux, reptiles, invertébrés).
Par exemple les alligators du lac Apopca étudiés par Lou Guillette[7] se sont féminisés et le restent leur vie durant, après une pollution du lac par un pesticide, et bien après que le lac a semblé épuré de cette pollution. Un taux de testostérone trop faible, y compris chez l'adulte alligator et une taille de pénis réduit de 25 % évoque le syndrome humain de TDS. Lou Guillette a pu reproduire en laboratoire les malformations (pénis et testicules atrophiés) en déposant sur la coquille de l'œuf d'alligator une simple goutte contenant de faibles doses de perturbateur endocrinien.
Dans les années 1990, le nombre de couples consultant pour des difficultés à avoir des enfants a régulièrement augmenté. Plusieurs articles (dont ceux de Luc Multigner et Bernard Jégou de l'INSERM en France) ont alerté l'opinion publique sur la délétion de la spermatogenèse. En 1992, une étude alerte sur la diminution depuis 1938 du nombre moyen de spermatozoïdes (de 113 x 106/ml en 1940 à 66 x 106/ml en 1990) mais aussi du volume séminal (passé de 3,40 ml à 2,75 ml, « indiquant une diminution encore plus prononcée de la production de sperme que celle exprimée par la diminution de la densité des spermatozoïdes ». Mais en 1995, en France, la plupart des experts se refusent encore à croire au phénomène ; ils pensent que des erreurs ou des biais de sélection entachent les études danoises et antérieures. À Paris Pierre Jouannet de l'INSERM doute aussi, mais il bénéficie au CECOS d'une cohorte ancienne, homogène et bien suivie de 1351 donneurs de sperme formant un groupe homogène. Il décide de comparer l'évolution de leurs spermogrammes sur les 20 années précédentes et constate que ces donneurs ont eux aussi perdu – en moyenne – 40 % de leurs spermatozoïdes en 20 ans (de 1973 à 1992), soit une régression moyenne de 2,1 %/an, le taux de spermatozoïdes chutant de 89×106 par ml de sperme en 1973 à 60×106 par ml en 1992[1].
Après ajustement prenant en compte l'âge et la durée de l'abstinence sexuelle, sur ces 20 ans, chaque nouvelle génération (par année civile de naissance) a perdu 2,6 % des spermatozoïdes de la cohorte née l'année précédente, et le taux de spermatozoïdes mobiles a diminué de 0,3 % par an, et celui des spermatozoïdes de forme normale a diminué de 0,7 %/an[1].
Dans le même temps, le pourcentage de spermatozoïdes normalement mobiles chutait de 0,6 % par an et celui des spermatozoïdes de forme normale diminuait de 0,5 % par an. Le constat est alarmant, mais on ne donne pas au chercheur les moyens de poursuivre son étude après 1995[1].
De 1995 à 1999, dans certains pays, la presse, et surtout la presse de vulgarisation scientifique évoque périodiquement le problème, avec notamment en 1996 un article de Bernard Jégou intitulé « Les hommes deviennent-ils moins fertiles ? » dans La Recherche[8]. L'hypothèse que des xéno-œstrogènes soient impliqués progresse[9], de même que la possibilité que la faune sauvage et domestique pourrait aussi être touchée[10]. Alors que les cancers et problèmes de thyroïde sont en progression, une étude en 1999 confirme que des composés organochlorés semblent perturber le système hormonal thyroïdien[11]. Ainsi apparaît l'idée qu'une même cause (perturbation endocrinienne) puisse avoir des effets différents selon la dose, le produit et le stade de développement au moment de l'exposition (fœtus, enfant, adulte…).
Dans les années 2000, alors que des perturbations endocriniennes sont observées chez diverses espèces de poissons (également exposés aux œstrogènes de la pilule peu dégradés par les stations d'épuration), certains chercheurs s'inquiètent pour l'Homme (toujours dans les pays riches, faute d'études ailleurs), notamment parce que le phénomène semble aussi toucher les jeunes, dont des donneurs de sperme, en apparente bonne santé[12].
Les perturbateurs endocriniens, certains plastifiants et certains pesticides sont de plus en plus fortement soupçonnés, mais les impacts des cocktails de polluants ou perturbateurs à faible dose sont peu étudiés, difficiles à étudier, et toujours controversés.
Les Danois confirment (en 2001) l'importance du facteur environnemental dans le TDS[13]. Les PCB sont notamment accusés de pouvoir contribuer au phénomène[14]. On note aussi que les dioxines ont un impact sur le sex-ratio[15].
On s'interroge encore sur d'éventuels biais statistiques ; les donneurs de sperme sont-ils notamment représentatifs de la population[16] ? Mais d'autres indicateurs (mesure de la distance ano-génitale) semblent confirmer l'implication de perturbateurs hormonaux (dont phtalates)[17].
En avril 2002, l'implication de certains pesticides se confirme. Un consultant (Ecorisk) travaillant pour le compte d'une entreprise fabriquant des pesticides (devenue depuis Syngenta) demande à un universitaire, le Pr B. Tyrone Hayes[18], d'observer et commenter les effets de l'exposition de tétards à de faibles doses d'Atrazine (doses comparables à ce qu'on trouve dans l'environnement ; l'Atrazine, volatile et très soluble dans l'eau étant dispersée par les eaux superficielles et les pluies). Hayes constate que les têtards mâles produisent des adultes anormaux, aux testicules dans lesquels on découvre des cellules ovariennes et même des œufs immatures, signe d'un grave dérèglement hormonal. C'est la première fois qu'une action de perturbation hormonale est démontrée pour un pesticide de manière si manifeste. L'étude[19] suscite une vive controverse (et Syngenta cesse de la financer), forçant l'EPA à réunir un groupe d'experts sur la question. Les universitaires s'y opposent aux experts de l'industrie chimique. Pour l'EPA, six études portant sur trois espèces apportent toutes des preuves suffisantes pour incriminer l'Atrazine dans le déclin des amphibiens, mais des chercheurs travaillant pour l'industrie chimique, dont Glen Van der Kraak[20], annoncent tirer d'autres conclusions des recherches disponibles, et ne pas voir de corrélation entre l'utilisation de pesticides et la régression des amphibiens[21].
Les années suivantes, d'autres études (dont certaines faisant état de testicules ou ovaires multiples) montrent que l'Atrazine et d'autres pesticides affectent la reproduction des amphibiens, qui commencent à régresser ou disparaître sur toute la planète ; 35 % des espèces sont menacées en 2008 selon l'UICN et l'Évaluation des écosystèmes pour le millénaire. Le crapaud doré a disparu en quelques années, alors qu'il vivait en pleine jungle. Les chercheurs ne disent pas que les pesticides sont la seule cause ou la cause systématique, mais pensent à un effet synergique de cocktails de polluants agissant à très faible dose et susceptible d'affecter la reproduction et l'immunité. L'Atrazine sera finalement interdite en Allemagne, puis peu à peu dans différents pays (mais parfois avec le droit de faire des stocks et de les utiliser). De nombreux autres pesticides et produits chimiques pourraient avoir des effets similaires, mais n'ont pas ou peu été étudiés depuis.
Une étude en 2005 confirme chez l'Homme une relation entre Hypospadias et problèmes hormonaux[22] et des chercheurs s'inquiètent de la fréquence de détection du Bisphénol A 4-nonylphenol dans les urines humaines[23], le Bisphénol ayant été désigné comme affectant les glandes mammaires de souris en 2001[24].
En 2008,
- la situation danoise ne s'est pas améliorée :
- près de 1 % des hommes danois (des jeunes pour la plupart) sont traités pour cancer du testicule ;
- 5 à 6 % des garçons ont des testicules anormalement petits ;
- près de 1 % des garçons danois présentent des anomalies du pénis à la naissance ;
- plus de 40 % des jeunes hommes ont un nombre anormalement bas de spermatozoïdes ;
- un jeune danois sur cinq n'a pas assez de spermatozoïdes de qualité pour avoir une fécondité normale.
- on trouve aux États-Unis des grenouilles mâles portant des œufs (28 %) dans des mares péri-urbaines[réf. nécessaire].
- la liste des substances suspectées d’être des PE (Perturbateurs Endocriniens) s'allonge, à partir d'une liste initiale de 564 composés suspects, dont 38 jugés prioritaires par la Commission Européenne (incluant des métaux et organométalliques, des composés bromés et des dérivés phénoliques).
Selon une étude (publiée en 2012 et ayant porté sur 701 jeunes danois testés de 2008 à 2010) un régime riche en graisse saturée augmente le risque de produire un faible nombre de spermatozoïdes, avec une relation de type dose-réponse[25],[26], mais aucun lien n'a été trouvé avec un régime riche en graisse non saturée[25]. Une corrélation de ce type semble exister en Espagne où la part de gras dans l'alimentation a beaucoup augmenté[26], et les études sur le rat de laboratoire montrent que les graisses insaturées ont un effet délétère sur le fonctionnement du testicule[26].
Selon Hagai Levine & al. (2017), pour 42 935 hommes suivis durant 40 ans (de 1973 à 2011), non sélectionnés par rapport à leur fécondité dans 50 pays riches et de culture occidentale (d'Amérique du Nord, d'Europe, d'Australie et Nouvelle-Zélande)[27] :
- la concentration en spermatozoïdes a chuté : -52,4% en 40 ans (environ -1,4%/an)[27] ;
- le compte du total des spermatozoïdes a chuté : -59,3% en 40 ans (environ -1,6%/an)[27] ;
... alors que ces paramètres semblent être restés stables dans les pays émergents[27].
Les auteurs estiment que les phtalates seraient en partie responsable de ce phénomène[27]. Le taux de cancers des cellules séminales augmente rapidement dans le monde (depuis les années 1970 au moins), mais avec un plateau observé dans de nombreux pays (de 2005 à 2010)[28],[29].
En 2020, on ne sait toujours pas clairement pourquoi. Une cause endocrinienne précoce (in utero ou lors de la production du spermatozoïde) est soupçonnée, car la perte de spermatozoïde est très souvent associée à un cryptorchidisme, un hypospadias ou un cancer du testicule[30]. En 2017, Alexandra Henrion-Caude notait aussi que le taux de spermatozoïdes varie chez les donneurs de sperme selon que le sperme est collecté par masturbation ou dans un préservatif lors d'un coït : de là, elle estime que des causes émotionnelles et sociopsychologiques telles que le niveau de dépression et d'anxiété (qui chez les hommes influencent clairement le taux de spermatozoïdes) peuvent aussi être en cause[31].
Un consensus existe sur le fait que des expositions environnementales aux PE causent des modifications épigénétiques du génome (modulations réversibles de l’expression génique, sans modification de la séquence ADN mais néanmoins transmissibles à la descendance sur uneou plusieurs plusieurs générations[32]. Après une exposition in utero ou de la cellule germinale ou du spermatozoïde dans le testicule du père, avant la fécondation, des PE peuvent donc affecter la fertilité des hommes et des femmes adultes, mais aussi celle de leurs enfants[32].
En 2022, une méta-analyse reprise dans un plan de lutte contre l’infertilité confirme une division par deux en 45 ans (passage de 101 millions de spermatozoïdes par ml de sperme en 1973, à 49 en 2022, alors que l'infertilité touche directement 3,3 millions de français – « un chiffre qui va croissant »[32].
Causes
modifierLe mécanisme et les causes de cette régression sont multi-factoriels, et environnementaux, au moins pour une partie.
La cause la plus souvent citée est une exposition in utero à des perturbateurs endocriniens (PE), qui peuvent être :
- des métaux lourds[33],[34] (cadmium[35],[36],[37], mercure[37], plomb[38],[39], molybdène[40] notamment…). A titre d'exemple, en avril 2014, la ville de Flint a distribué une eau publique contaminée par le plomb, ce qui a été suivi d'une chute de 12% du taux de fécondité et de la santé à la naissance (5,4 % de diminution du poids à la naissance), alors que les autres villes du Michigan ne subissaient pas ces variations)[41].
- des polluants organiques persistants (POP) ;
- des additifs de matières plastiques ou résines (phtalates, bisphénol A…) ;
- certains pesticides ou résidus ou métabolites de ces pesticides ;
- des résidus de détergents ou de tensio-actifs (de type non-ioniques comme les alkylphénols polyéthoxylates) ;
- des médicaments ou leurs résidus (pilule, glucocorticoïdes…) ;
- des phyto-œstrogènes ;
- la consommation de cannabis. Elle double le risque de cancer des testicules (y compris en usage thérapeutique)[42].
Ces tumeurs sont de type non-séminomateuses (plus résistantes à la radiothérapie, impliquant donc souvent une chimiothérapie)[42]. Les endocannabinoïdes du cannabis semblent interférer avec ceux produits par le corps humain, normalement en faible quantité et à l'occasion de certaines stimulations, dont lors de la fécondation, permettant l'activation des spermatozoïdes. L'« hyper activation » induite par la consommation de cannabis semble entraîner une infertilité[43],[44], mais aussi un développement anormal des cellules reproductrices, qui pourrait être à l'origine du cancer[42] ; - divers métabolites agissant comme perturbateur endocrinien : par exemple on trouve en aval des rejets d'usines de pâte à papier des taux élevés d'un androgène, l'androstènedione, qui provient en fait de la transformation (métabolisation) par des bactéries Mycobacterium smegmatis de stigmastérol, un phytostérol naturel massivement libéré lors du broyage et de la cuisson des fibres de bois. Cette hormone a notamment été trouvée aux États-Unis à très faible dose (0,14 nM[45]) dans l'eau de la Fenholloway River en aval d'une usine de pâte à papier, ainsi que de la progestérone (6,5 nM). Une dose bien plus importante de ces deux perturbateurs endocriniens a été mesurée dans les sédiments (2,4 nM d'androstènedione avec également 155 nM de progestérone). Or ces sédiments sont pour partie remis en suspension à chaque crue et de nombreux organismes s'y nourrissent dont les larves de chironomes dont les gambusies sont friandes. Ces produits expliquent la présence dans cette rivière d'une population de poissons (gambusies : Gambusia holbrooki) dont les femelles sont fortement masculinisées[46]. D'autres perturbateurs de ce type pourraient exister et n'avoir pas encore été détectés.
- Certains de ces produits, seuls ou combiné à divers polluants, peuvent être concentrés par la chaîne alimentaire. Un environnement pollué et le type d'alimentation peuvent donc intervenir[47].
- D'autres facteurs (alcool, tabac, certains modes de vie) pourraient également contribuer au problème.
- Enfin, des phénomènes émergents, tels que l'exposition croissante des individus à un éclairage artificiel pourraient aussi perturber le système hormonal, via une perturbation de la mélatonine, qui semble notamment pouvoir induire ou favoriser des cancers du sein (chez les femmes qui travaillent de nuit), mais aucune étude ne semble avoir recherché d'éventuelles corrélations avec les problèmes de spermatogenèse.
Des effets synergiques sont très probables mais difficiles à détecter car les organismes (humains et animaux) sont à la fois exposés à un très grand nombre de polluants, à des molécules féminisantes (type œstrogènes) et masculinisantes (androgènes), et à des leurres hormonaux et à leurs antagonistes, pour certains encore mal connus, voire non détectés.
Remarque : L'exposition au travail peut être conséquente pour certains produits et certains métiers[48].
Mécanisme explicatif ?
modifierTrois hormones jouent un rôle majeur pour le bon déroulement de la spermatogenèse et le bon fonctionnement des organes qu'elle implique :
- la testostérone ;
- la LH (hormone lutéinisante) ;
- la FSH (hormone folliculostimulante).
De nombreux chercheurs pensent que la production et les fonctions de ces hormones sont perturbées, in utero, par l'exposition à des Perturbateurs Endocriniens (PE) (source?)
En France
modifierEn 1995, les spermogrammes de 1351 donneurs de spermes du CECOS parisien (tous déjà père d'au moins un enfant au moment du don), montrent qu'en 20 ans (de 1973 à 1992) si le volume de sperme donné est resté stable, sa concentration moyenne en spermatozoïde a par contre fortement diminué (− 2,1 %/an, chutant de 89×106 par ml de sperme en 1973 à 60×106 par ml en 1992)[1].
Le pourcentage de spermatozoïdes normalement mobiles a aussi chuté (de 0,6 % par an), et celui des spermatozoïdes de forme normale a diminué (− 0,5 %/an)[1]. Après ajustement prenant en compte l'âge et la durée de l'abstinence sexuelle, sur ces 20 ans, chaque nouvelle génération (par année civile de naissance) a perdu 2,6 % des spermatozoïdes de la cohorte née l'année précédente, et le taux de spermatozoïdes mobiles a diminué de 0,3 % par an, et celui des spermatozoïdes de forme normale a diminué de 0,7 %/an[1].
La France a lancé en 2005 un programme national de recherche sur des perturbateurs endocriniens (PNRPE[49]) et a ouvert un volet « Atteintes de la reproduction » dans son Plan National Santé Environnement et son Plan Santé au Travail[50]. Le groupe ECRIN cherche à articuler les réflexions du privé (dont l'industrie) et du public (recherche en particulier)[51].
La ministre de la Santé a annoncé fin novembre 2009 prévoir la publication de recommandations aux femmes enceintes (comme au Danemark, ou aux États-Unis concernant les taux de mercure de certains aliments), mais une étude américaine publiée en 2008, ayant porté sur 511 femmes enceintes a montré que de telles mesures n'ont pas été efficaces concernant l'usage des pesticides (insecticides) dans la maison durant la grossesse. Et après l'interdiction des organophosphorés pour ce type d'usage aux États-Unis, les ménagères ont simplement changé de produits. De 2002 à 2006, au moins 85 % des femmes enceintes interrogées ont déclaré utiliser des pesticides, et du Diazinon et du chlorpyrifos ont été trouvés dans plus de 98 % des échantillons d'air des maisons (avant et après l'interdiction aux États-Unis) et 18 à 75 % des échantillons de l'air respiré par les futures mères contenaient au moins un pesticide de « remplacement »[52],[53].
En 2018, une étude de Santé publique France confirme « des résultats reflétant une altération globale de la santé reproductive masculine en France, cohérente avec la littérature internationale, probablement depuis les années 1970 pour la qualité du sperme », avec une baisse significative et continue de 32,2 % de la concentration spermatique entre 1989 et 2005 (= diminution annuelle d’environ 1,9 % par an)[32].
En 2021, la loi bioéthique promulguée le 2 août impose (article 4) la création d'un plan national pour lutter contre l’infertilité[32], et précise que « les mesures nationales et pluriannuelles d’organisation concernant la prévention et l’éducation du public, l’information sur la fertilité féminine et masculine, la formation des professionnels de santé et la coordination en matière de recherche et de protocolisation pour lutter contre toutes les causes d’infertilité, notamment comportementales et environnementales, sont définies par arrêté conjoint des ministres chargés de l’éducation nationale, de la santé, de la recherche et de l’écologie »[32]. Plusieurs des objectifs de ce plan concernent la délétion de la spermatogenèse, dont dans l'Axe 4 du plan, intitulé Mieux repérer et diagnostiquer les causes d’infertilité[32] :
- l'objectif 11 Améliorer l’efficacité des diagnostics génétiques, qui comprend deux mesures : mesure 11.1 : Intégrer les anomalies sévères de la spermatogénèse d’origine génétique dans les pré-indications retenues pour bénéficier du Plan France Médecine Génomique 2025 ; et la mesure 11.2 : Augmenter le nombre de structures susceptibles de réaliser les analyses génétiques initiales de l’infertilité[32] ;
- l'objectif 13 Mieux repérer et diagnostiquer l’infertilité masculine, qui comprend deux mesures : mesure 13.1 : Réaliser une consultation uro-andrologique chez tout homme ayant un facteur de risque d’infertilité ou une anomalie du spermogramme et la mesure 13.2 : Intégrer dans la prise en charge andrologique des hommes infertiles le dépistage des risques cardiovasculaires, sexuels et de cancer[32].
Controverses sur la dégradation de la spermatogenèse (ou son ampleur)
modifierMême les chercheurs qui ont découvert le phénomène disent avoir d'abord eu du mal à croire à son ampleur[54].
Les décideurs également, d'autant qu'alors l'on suspectait déjà des causes environnementales, certains représentants de grands groupes industriels de l'industrie chimique accusaient les médecins et chercheurs d'alarmisme ou d'« extravagance » et d'avoir ignoré des biais qui auraient faussé les évaluations de la fertilité[55]. Ainsi des chercheurs travaillant pour Dow Chemical Company (l'un des plus grands producteurs et utilisateurs de plastifiants de type phtalate) ont non seulement nié le phénomène, mais affirmé que d'autres modèles statistiques — selon eux plus judicieux — concluraient à une légère augmentation du nombre de spermatozoïdes. Ils accusent les méta-analyses ou les études de bases d'avoir été mal faites, et/ou de s'appuyer sur des données insuffisantes ou présentant des biais de sélection.
Selon ceux qui nient un recul général de la spermatogenèse dans les pays étudiés, on ne pouvait pas, à partir des 61 études analysées et comparées conclure à une perte moyenne de 50 % des spermatozoïdes sur les 50 dernières années. Leurs arguments sont que :
- Les données (spermogrammes) utilisées ne couvraient pas tous les pays, toutes les régions et/ou n'étaient pas assez représentatives de l'ensemble de la population, alors que des différences géographiques importantes semblent exister (le Danemark est très touché alors que plus au nord, la Finlande semble épargnée).
- Une partie des données seraient « défectueuses ».
- Une analyse tendancielle ne devrait pas être fondée sur des moyennes arithmétiques mais sur des médianes. Dans ce cas, selon les détracteurs, l'analyse tendancielle ne montrerait aucun changement significatif dans le temps. Critique encore retenue par D.J. Handelsman en 2001[56], qui estime par ailleurs que l'hypothèse d'un mauvais développement testiculaire et des cellules de Sertoli induit par une exposition prénatale à des œstrogènes a été « formellement démentie par les études des garçons nés de femmes exposées à de fortes doses orales de diéthylstilbestrol pendant la grossesse » (selon lui, ni la fécondité ni la production de sperme ont été négativement influencés par l'exposition à cet œstrogène, « bien que des malformations urogénitales mineures se soient produites » reconnaît-il). Handelsman, faute de registres épidémiologiques suffisants, doute aussi d'une augmentation des cas de cryptorchidie ou d'hypospadias, mais reconnaît « que les données de registres des cancers indiquent une augmentation progressive de cancer du testicule dans certains pays ».
- Les protocoles des études différaient trop selon le pays ou l'époque ou l'objectif de l'étude. Certaines données ainsi produites sont trop hétérogènes pour être comparées, par exemple, car certaines venaient de donneurs de sperme à priori en bonne santé et d'autres provenaient de patients consultants pour trouble de la fertilité.
- La « variabilité probable des méthodes de collecte » et en particulier la variabilité dans l'application d'une période d'abstinence précédant le recueil du sperme étudié (notamment dans la plus grande des études, qui apportait 29,7 % des sujets inclus dans une métanalyse).
- La relative rareté des données disponibles les 30 premières années de la période de 50 ans retenue pour l'analyse tendancielle.
- Le modèle linéaire classique est inapproprié pour analyser ces données, alors que – toujours selon les détracteurs de l'hypothèse d'une régression de la spermatogenèse — d'autres modèles statistiques (quadratic, spline fit, and stairstep models) auraient au contraire conclu à une augmentation du nombre de spermatozoïdes pour les 20 dernières années. Trois chercheurs de l'industrie chimique affirmaient que si on avait examiné les spermogrammes des 20 dernières années (78,7 % de toutes les études et 88,1 % du nombre total de sujets) avec d'autres modèles statistiques, il n'y aurait pas de diminution des spermatozoïdes, mais au contraire une augmentation.
- Les grands laboratoires n'ont pas observé de diminution du volume de liquide séminal[réf. nécessaire].
En 1995, sur ces bases, trois chercheurs de l'industrie chimique concluaient encore que les seules données statistiquement robustes sont celles des 20 dernières années de l'étude tendancielle, et qu'elles concluraient si elles étaient filtrées par n'importe quel modèle — sauf le modèle linéaire — à une spermatogenèse constante et même en légère hausse.
Une nouvelle méta-analyse (en 2017) conclue à une diminution moyenne de 1,4%/an du nombre de spermatozoïdes pour une même quantité de sperme, avec une baisse globale de 52,4 % de 1973 et 2011[27].
Controverse sur la gravité de la situation
modifierDe fortes différences géographiques (ou selon le métier) de santé reproductive masculine semblent maintenant bien établies.
De même chez la faune sauvage quand elle présente des problèmes a priori similaires. L'« exception finlandaise » interpelle toujours les chercheurs. Une nouvelle piste explicative est apparue en 2009, à la suite d'une étude du Pr Skakkebaek montrant que l'exposition des Finlandais et des Danois à certains perturbateurs endocriniens (dont des pesticides) est très différente (démontrée via l'analyse du taux de ces produits dans le lait des femmes allaitantes). Cette étude suggère en outre un lien entre certains produits chimiques présents dans le lait maternel et le cancer du testicule[57].
Il est impossible de vérifier une éventuelle évolution séculaire ou éventuellement multiséculaire de la fertilité masculine, d'abord par manque de spermogrammes (si l'on remonte avant 1940) et ensuite parce que les paramètres spermatiques des spermogrammes (concentration, mobilité, morphologie...) ne suffisent pas à évaluer la capacité fécondante du sperme.
Des phénomènes comme ceux induits par l'exposition in utero au distilbène sont transmissibles (aujourd'hui observés sur la troisième génération). Ceci invite à poser la question de l'éventuelle persistance du déclin de la spermatogenèse même si certains produits suspectés étaient interdits ou cessaient d'être utilisés. La réponse à cette question nécessite une meilleure compréhension des mécanismes en cause. Y a-t-il mutation induite de l'ADN ? Et si oui, est-elle reproductible de génération en génération, est-elle courante ? Est-elle dominante ou récessive ? Si au contraire il n'y a pas de mutation, mais une action directe de perturbateurs endocriniens, quelle est leur biodisponibilité et leur persistance dans l'environnement ?
Enfin, l'homme moyen produisant encore des milliards de spermatozoïdes au cours de sa vie, la question se pose de savoir si la fertilité d'un couple est réellement affectée par un nombre de spermatozoïde divisée par deux ou par trois.
Plusieurs chercheurs ont nié la validité des spermogrammes comme preuve suffisante d'une baisse de fertilité masculine, surtout dans un contexte où le contrôle de la natalité est devenu commun. Certains ont proposé un autre indicateur qu'ils jugent plus sensible et représentatif de la fertilité effective : le temps de gestation (le délai d'attente de la grossesse ou « délai nécessaire à concevoir » (DNC ; ou Time to pregnancy ou TTP pour les anglophones). C'est le nombre de mois de rapports sexuels non protégés avant la conception, mais cet indicateur, outre qu'il ne prend pas en compte le nombre et la date des rapports sexuels, peut aussi être critiqué par le fait que ce temps dépend autant de la fertilité de la femme que de celle de l'homme, et que dans le cas de couples peu fertiles du fait de l'homme, il peut être fortement raccourci par d'autres facteurs externes incluant un bien meilleur suivi médical, voire une relation « extra-conjugale » de la femme.
- Une étude[58] a comparé sur cette base la fécondité de couples anglais et finlandais. La Finlande a été choisie pour l'« exception finlandaise » caractérisée par un nombre de spermatozoïdes apparemment demeuré normal dans ce pays (le double de la moyenne des autres études), associé à un faible taux de cancer du testicule. L'étude a comparé 1891 grossesses en Finlande et 1201 au Royaume-Uni, concluant à une fécondité significativement meilleure en Finlande[58].
- D'autres données ont été obtenues pour 197 grossesses de Finlandaises exposées à des solvants organiques, et des valeurs de TTP ont été analysées pour 14 223 femmes d'une cohorte de 1958 suivie en Grande-Bretagne… Conclusion : même en tenant compte des différences méthodologiques entre les études, la fertilité est meilleure chez les femmes finlandaises que chez les femmes anglaises, ce qui suggère aussi que les numérations de spermatozoïdes, différentes dans les deux pays, ne sont pas un artefact induit par le « facteur humain » qui pourrait expliquer au moins une part des variations de numérations dans l'espace et dans le temps[58].
Les auteurs estiment qu'il n'y a pas de biais méthodologique dans ces études, mais ils jugent « peu probable » l'hypothèse d'une perturbation endocrinienne à ce point plus importante en Angleterre qu'en Finlande. Un moindre tabagisme féminin en Finlande est une hypothèse explicative qu'ils ont proposée, mais en reconnaissant qu'elle manquait de preuves convaincantes[58].
- Rien ne démontre cependant que la TTP soit un indicateur pertinent dans ce cas ; d'autant que les valeurs fiables de DNC (délai nécessaire à concevoir) ne sont pas non plus disponibles pour le passé avant les années 1940-50[59] et qu'elle dépend en outre de nombreux facteurs inconnus de l'enquêteur (nombre et dates des rapports sexuels en particulier).
- Une étude rétrospective chez des jumeaux danois nés de 1953 à 1976 n’a pas montré de tendance (sur ces 24 années) à la diminution de la probabilité de grossesse[60].
- Une autre étude n'a pas trouvé de lien entre sex ratio et TTP[61].
- Non seulement, le nombre de spermatozoïdes des Finlandais est plus élevé que celui des Danois (Jørgensen et al., 2002), mais l'incidence de la cryptorchidie et l'hypospadias est 3 à 4 fois plus élevé au Danemark qu'en Finlande[62],[63]. En outre les nouveau-nés mâles finlandais en bonne santé ont en moyenne des testicules plus volumineux que ceux des Danois, et des taux plus élevés d'inhibine B, un marqueur des cellules de Sertoli des testicules[64].
- En 2008, une étude a montré que les Finlandais émigrés au Danemark voient — dès la seconde génération — leur risque de développer un cancer des testicules augmenter, au même niveau que celui de la population du pays-hôte. Ceci laisse penser à un cancer induit in utero et faisant suite à des facteurs environnementaux plutôt que génétiques[65],[66].
Prospective
modifier- Si on retient les tendances dégagées de dizaines d'études utilisées par les Danois (tendances confirmées par des experts américains reconnus (dont la professeure Shanna Swan[67], interviewée dans le reportage d'Arte de novembre 2008) et reprises par François Veillerette dans son livre Pesticides, le piège se referme, le déclin correspondrait à une division par deux du nombre moyen de spermatozoïdes en 50 ans (dans les pays de ces études — et on ne sait pas quel était le nombre moyen de spermatozoïdes par millilitre de sperme à la préhistoire ou il y a 200 ans).
- Une extrapolation linéaire de la tendance dans l'avenir proche n'a pas de valeur scientifique sur le plan de la prédictibilité, mais c'est un outil de prospective indicatrice… Les prospectivistes en épidémiologie, au Canada, estiment aussi : « Il est assez probable que l'incidence du cancer des testicules continuera d'augmenter (« Nous ne savons pas pourquoi » précisent-ils) et que l'incidence du mésothéliome et de la mortalité qui y est associée ne cesseront de croître »[68].
Les auteurs de la dernière méta-analyse (mi-2017) notent que « les résultats ne changent que de façon minimale dans les analyses de sensibilité multiples », et qu'« il n'y a pas de support statistique pour l'utilisation d'un modèle non linéaire »[27], et pour les données produites après 1995, la pente de tendance prolonge celle de la période 1973-2011. Or, si à partir de la régression moyenne observée de 1940 à 1995, on « extrapole » la tendance, on atteindra le niveau zéro vers 2070 ! C'est-à-dire que, si la tendance se prolonge au rythme des 50 dernières années, les mâles des pays des études citées ne devraient plus être capables de produire aucun spermatozoïde en 2070…
Une étude parue dans la revue Nature (2021) alerte sur le fait que les taux inférieurs à 40 millions de spermatozoïdes par millilitre maintenant courants dans les pays riches sont ceux qui commencent à affecter négativement la probabilité de grossesse par cycle. Quand le déclin a commencé, seule une petite part était peu féconds, ce n'est plus le cas en 2011 : le taux moyen de 47 millions par millilitre, exposant une grande partie des hommes à ne plus pouvoir faire d'enfants normalement.
Pour les tenants du développement dit « durable », cette donnée est de première importance. La qualité du sperme humain (et de certaines espèces parapluie dans le cadre de l'approche One Health promue par l'Organisation mondiale de la santé) pourrait ainsi compter parmi les futurs bioindicateurs de santé publique, et plus largement de soutenabilité du développement : « la qualité du sperme peut être un indicateur global de santé publique. En effet aujourd’hui, trois larges études font le lien entre une mauvaise qualité du sperme et une augmentation de la mortalité et de la morbidité chez les hommes, toutes causes confondues » peut-on lire sans un rapport du ministère de la Santé de 2022[32].
Notes et références
modifier- (en) J Auger, J M Kunstmann, F Czyglik, P Jouannet, « Decline in semen quality among fertile men in Paris during the past 20 years », The New England journal of medicine, vol. 332, no 5, , p. 281-285 (ISSN 0028-4793, PMID 7816062, DOI 10.1056/NEJM199502023320501, lire en ligne, consulté le )
- Bostofte E, Serup J, Rebbe H. Has the fertility of Danish men declined through the years in terms of semen quality? A comparison of semen qualities between 1952 and 1972. Int J Fertil 1983;28:91-95. Medline
- (en) Pranitha Jenardhanan, Manivel Panneerselvam et Premendu P. Mathur, « Effect of environmental contaminants on spermatogenesis », Seminars in Cell & Developmental Biology, molecular Mechanisms in Spermatogenesis, vol. 59, , p. 126–140 (ISSN 1084-9521, DOI 10.1016/j.semcdb.2016.03.024, lire en ligne, consulté le )
- Spécialiste de la fertilité humaine, Directeur de recherches à l'hôpital universitaire de Copenhague (Danemark)
- Directeur du département Santé de la reproduction, Conseil de la recherche médicale, Édimbourg (Grande-Bretagne)
- (« There can be no reasonable doubt that these reported mean sperm counts show a decline with time of publication, at least since 1960 ») ; James WH. Secular trend in reported sperm counts (Andrologia 1980;12:381-388)
- Professeur émérite de zoologie, Directeur du programme GATOR au département de zoologie de l'université de Floride (États-Unis)
- Jégou B. Les hommes deviennent-ils moins fertiles ? La Recherche, 1996, 288: 60-65.
- (en) Toppari J, Larsen JC, Christiansen P, et al. Male reproductive health and environmental xenœstrogens. Environ. Health Perspect 1996, 104 (suppl 4) : 741-803
- (en) Jégou B, Auger J, Multigner L, et al. The saga of the sperm count decrease in humans and wild and farm animals. In : Gagnon C, ed. « The male gamete : from basic sciences to clinical applications. » Vienna, IL, États-Unis : Cache River Press 1999 : 445-54.
- (en) Cheek OA, Kow K, Chen J, McLachlan JA. Potential mechanisms of thyroid disruption in humans : interaction of organochlorine compounds with thyroid receptor, transthyretin and thyroid-binding globulin. Environ. Health Perspect 1999, 107 : 273-8
- (en) Andersen, A.G., Jensen, T.K., Carlsen, E. et al. (2000) High frequency of sub-optimal semen quality in an unselected population of young men. Hum. Reprod., 15, 366–372
- (en) Skakkebaek NE, Rajpert-De Meyts E, Main KM. Testicular dysgenesis syndrome : an increasingly common developmental disorder with environmental aspects. Hum Reprod 2001 ; 16 : 972-8.
- (en) Kester MHA, Bulduk S, Tibboel D, et al. Potent inhibition of œstrogen sulfotransferase by hydroxylated PCB metabolites : a novel pathway explaining the œstrogenic activity of PCBs. Endocrinology 2000 ; 141 : 1897-1900.
- (en) Mocarelli P, Gerthoux PM, Ferrari E, et al. Paternal concentrations of dioxin and sex ratio of offspring. The Lancet 2000 ; 355 : 1858-63
- (en) Eustache F, Auger J, Cabrol D, Jouannet P. Are volunteers delivering semen samples in fertility studies a biased population ? Hum Reprod 2004 ; 19 : 2831-7
- (en) Swan SH, Main KM, Liu F, et al. Decrease in anogenital distance among male infants with prenatal phthalate exposure. Environ Health Perspect 2005 ; 113 : 1056-61.
- B. Tyrone Hayes est professeur au département de biologie intégrative de l'université de Californie à Berkeley
- Étude publiée aux Proceedings of the National Academy of Science (octobre 2002) et dans la revue Nature (octobre 2002)
- Professeur à l'université de Guelph à Winnipeg, dans le Manitoba
- (en) New York Times (Article de Jennifer Lee, 2003 06 19, intitulé Popular Pesticide Faulted for Frogs' Sexual Abnormalities)
- (en) Boisen K, Chellakooty M, Schmidt I, et al. Hypospadias in a cohort of 1072 Danish newborn boys : prevalence and relationship to placental weight, anthropometrical measurements at birth, and reproductive hormone levels at 3 months of age. J Clin Endocrinol Metab 2005
- (en) Calafat AM, Kuklenyik Z, Reidy JA, et al. Urinary concentrations of bisphenol A and 4-nonylphenol in a human reference population. Environ Health Perspect 2005 ; 113 : 391-5
- (en) Markey CM, Luque EH, Munoz de Toro MM, et al. In utero exposure to bisphenol A alters the development and tissue organization of the mouse mammary gland. Biol Reprod 2001 ; 65 : 1215-23.
- Tina K Jensen a al. (2012) High dietary intake of saturated fat is associated with reduced semen quality among 701 young Danish men from the general population (résumé)
- Jorge E. Chavarro & al. (2014) Trans fatty acid intake is inversely related to total sperm count in young healthy men Hum. Reprod. (2014) 29 (3): 429-440, mis en ligne 2014-01-12
- (en) Hagai Levine, Niels Jørgensen, Anderson Martino-Andrade, Jaime Mendiola, Dan Weksler-Derri, Irina Mindlis, Rachel Pinotti et Shanna H. Swan, « Temporal trends in sperm count: a systematic review and meta-regression analysis », Human Reproduction Update, vol. 23, no 6, , p. 646–659 (ISSN 1355-4786 et 1460-2369, PMID 28981654, PMCID PMC6455044, DOI 10.1093/humupd/dmx022, lire en ligne, consulté le )
- (en) Charlotte Le Cornet, Joannie Lortet-Tieulent, David Forman et Rémi Béranger, « Testicular cancer incidence to rise by 25% by 2025 in Europe? Model-based predictions in 40 countries using population-based registry data », European Journal of Cancer, vol. 50, no 4, , p. 831–839 (DOI 10.1016/j.ejca.2013.11.035, lire en ligne, consulté le )
- (en) Ariana Znaor, Joannie Lortet-Tieulent, Ahmedin Jemal et Freddie Bray, « International Variations and Trends in Testicular Cancer Incidence and Mortality », European Urology, vol. 65, no 6, , p. 1095–1106 (DOI 10.1016/j.eururo.2013.11.004, lire en ligne, consulté le )
- (en) Niels E. Skakkebaek, Ewa Rajpert-De Meyts, Germaine M. Buck Louis et Jorma Toppari, « Male Reproductive Disorders and Fertility Trends: Influences of Environment and Genetic Susceptibility », Physiological Reviews, vol. 96, no 1, , p. 55–97 (ISSN 0031-9333 et 1522-1210, PMID 26582516, PMCID PMC4698396, DOI 10.1152/physrev.00017.2015, lire en ligne, consulté le )
- « Les pistes pour comprendre la baisse drastique de la qualité du sperme des occidentaux », sur Atlantico.fr (consulté le )
- Samir Hamamah et Salomé Berlioux, « Rapport sur les causes d'infertilité - Vers une stratégie nationale de lutte contre l'infertilité (Ministère de la santé ; DICOM) ; voir chap. 1.4.1.5 « De possibles effets transgénérationnels des perturbateurs endocriniens » p 32. », Ministère de la santé, février 2022 (mis en ligne 2023-05-11) (lire en ligne, consulté le )
- (en) Ping Li, Yuanfu Zhong, Xiaoming Jiang et Chonggang Wang, « Seminal Plasma Metals Concentration with Respect to Semen Quality », Biological Trace Element Research, vol. 148, no 1, , p. 1–6 (ISSN 1559-0720, DOI 10.1007/s12011-012-9335-7, lire en ligne, consulté le )
- (en) Alica Pizent, Blanka Tariba et Tanja Živković, « Reproductive Toxicity of Metals in Men », Arhiv za higijenu rada i toksikologiju, vol. 63, no Supplement 1, , p. 35–45 (ISSN 0004-1254 et 1848-6312, DOI 10.2478/10004-1254-63-2012-2151, lire en ligne, consulté le )
- C. Yan Cheng, Elissa W.P. Wong, Pearl P.Y. Lie et Michelle W.M. Li, « Environmental toxicants and male reproductive function », Spermatogenesis, vol. 1, no 1, , p. 2–13 (PMID 21866273, PMCID PMC3158642, DOI 10.4161/spmg.1.1.13971, lire en ligne, consulté le )
- (en) Sunil Kumar et Anupama Sharma, « Cadmium toxicity: effects on human reproduction and fertility », Reviews on Environmental Health, vol. 34, no 4, , p. 327–338 (ISSN 2191-0308, DOI 10.1515/reveh-2019-0016, lire en ligne, consulté le )
- (en) Elissa W. P. Wong et C. Yan Cheng, « Impacts of environmental toxicants on male reproductive dysfunction », Trends in Pharmacological Sciences, vol. 32, no 5, , p. 290–299 (ISSN 0165-6147, DOI 10.1016/j.tips.2011.01.001, lire en ligne, consulté le )
- Sunil Kumar, « Occupational and Environmental Exposure to Lead and Reproductive Health Impairment: An Overview », Indian Journal of Occupational and Environmental Medicine, vol. 22, no 3, , p. 128–137 (ISSN 0973-2284, PMID 30647514, PMCID 6309352, DOI 10.4103/ijoem.IJOEM_126_18, lire en ligne, consulté le )
- Julia J. Wirth et Renée S. Mijal, « Adverse Effects of Low Level Heavy Metal Exposure on Male Reproductive Function », Systems Biology in Reproductive Medicine, vol. 56, no 2, , p. 147–167 (ISSN 1939-6368, PMID 20377313, DOI 10.3109/19396360903582216, lire en ligne, consulté le )
- Xiao-Wei Zhai, Yu-Ling Zhang, Qiao Qi et Yu Bai, « Effects of molybdenum on sperm quality and testis oxidative stress », Systems Biology in Reproductive Medicine, vol. 59, no 5, , p. 251–255 (ISSN 1939-6368, PMID 23651332, DOI 10.3109/19396368.2013.791347, lire en ligne, consulté le )
- « The-Impact-of-the-Flint-Water-Crisis-on-Fertility », sur read.dukeupress.edu (consulté le )
- (en) John Charles A. Lacson MS et al. « Population-based case-control study of recreational drug use and testis cancer risk confirms an association between marijuana use and nonseminoma risk » ; en ligne 10 septembre 2012 ; DOI 10.1002/cncr.27554 (résumé; étude soutenue par le National Cancer Institute), citée par EurekAlert! : Marijuana use may increase risk of testicular cancer ; 2012-09-10
- Cannabis : la fertilité masculine serait perturbée sur le site non officiel du débat sur la drogue.
- Cannabis, surpoids : les ennemis de votre fertilité dans la section « Infertilité » de Doctissimo
- C'est-à-dire 0,14 nanomole par litre.
- (en) Ronald Jenkins et al. ; Toxicological sciences ; (ISSN 1096-6080), 2003, vol. 73 no 1, pages 53 à 59 , 35 références « Androstenedione and progesterone in the sediment of a river receiving paper mill effluent » [ Voir][Où ?]
- (en) Andrea Di Nisio et Carlo Foresta, « Water and soil pollution as determinant of water and food quality/contamination and its impact on male fertility », Reproductive Biology and Endocrinology, vol. 17, no 1, , p. 4 (ISSN 1477-7827, PMID 30611299, PMCID PMC6321708, DOI 10.1186/s12958-018-0449-4, lire en ligne, consulté le )
- Marie-Anne Mengeot, Laurent Vogel, Produire et reproduire : Quand le travail menace les générations futures Éd : ETUI-REHS, 84p, aout 2008
- [PDF] « PNRPE »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- [PDF] Volet contaminants du Plan Santé au travail
- « Écrin »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- New Pesticides, Old Problems Despite Warnings, Use during Pregnancy Persists
- Megan K. Williams et al., Changes in Pest Infestation Levels, Self-Reported Pesticide Use, and Permethrin Exposure during Pregnancy after the 2000–2001 U.S. Environmental Protection Agency Restriction of Organophosphates, Environmental Health Perspectives Volume 116, Number 12, décembre 2008 (Voir)
- Voir par exemple les témoignages filmés pour l'émission d'Arte « Les mâles en péril » (Théma de 52 min, réalisé par Sylvie Gilman et Thierry de Lestrade, diffusée 2008 11 25, suivi d'un débat)
- (en) Olsen GW, Bodner KM, Ramlow JM, Ross CE, Lipshultz LI. (Dow Chemical Company, Midland, Michigan) « Have sperm counts been reduced 50 percent in 50 years? A statistical model revisited » ; Fertil Steril. 1995 Apr;63(4):887-93
- (en) D.J Handelsman. (ANZAC Research Institute, University of Sydney, Concord Hospital, NSW, Australie) « Estrogens and falling sperm counts » ; Reprod. Fertil. Dev. 2001;13(4):317-24
- (en) K. Krysiak-Baltyn, J. Toppari, N. E. Skakkebaek, T. S. Jensen, H. E. Virtanen, K.-W. Schramm, H. Shen, T. Vartiainen, H. Kiviranta, O. Taboureau, S. Brunak et K.M. Main, Country-specific chemical signatures of persistent environmental compounds in breast milk ; International journal of andrology ; ISSN 0105-6263 ; DOI 10.1111/j.1365-2605.2009.00996.x
- (en) M. Joffe ; « Decreased fertility in Britain compared with Finland », The Lancet. 1996 08 31 ; 348(9027):616. Résumé
- (en) Slama R, Bouyer J, Remontet L, Spira A. « Epidemiology of male reproductive function : a field searching for tools. » Rev Epidemiol Sante Publ 2004 ; 52 : 221-42
- (en) Boisen K, Chellakooty M, Schmidt I, et al. « Hypospadias in a cohort of 1072 Danish newborn boys : prevalence and relationship to placental weight, anthropometrical measurements at birth, and reproductive hormone levels at 3 months of age. » J Clin Endocrinol Metab 2005 ;90 : 4041-6.
- (en) Joffe M, Bennett J, Best N, Jensen TK. « Sex ratio and time to pregnancy : analysis of four large European population surveys ». BMJ. 2007 03 10; 334(7592):524. Epub 2007 Feb 2
- (en) Boisen, K. A., Kaleva, M., Main, K. M., Virtanen, H. E., Haavisto, A.-M., Schmidt, I. M. et al. (2004) Difference in prevalence of congenital cryptorchidism in infants between two Nordic countries. Lancet 363, 1264–1269.
- (en) Boisen, K. A., Chellakooty, M., Schmidt, I. M., Kai, C. M., Damgaard, I. N., Suomi, A. M., Toppari, J., Skakkebæk, N. E. & Main, K. M. (2005) Hypospadias in a cohort of 1072 Danish newborn boys : prevalence and relationship to placental weight, anthropometrical measurements at birth, and reproductive hormone levels at 3 months of age. Journal of Clinical Endocrinology and Metabolism 90, 4041–4046.
- (en) Main, K. M., Toppari, J., Suomi, A.-M., Kaleva, M., Chellakooty, M., Schmidt, I. M. et al. (2006b) Larger testes and higher inhibin B levels in Finnish than in Danish newborn boys. Journal of Clinical Endocrinology and Metabolism 91, 2732–2737.
- (en) Hemminki, K. & Li, X. (2002) Cancer risks in Nordic immigrants and their offspring in Sweden. European Journal of Cancer 38, 2428–2434.
- (en) C. Myrup, T. Westergaard, T. Schnack, A. Oudin, C. Ritz, J. Wohlfahrt & M. Melbye (2008) Testicular cancer risk in first- and second-generation immigrants to Denmark. Journal of the National Cancer Institute 2008 Jan.2;100(1):41.-7.Epub.2007.Dec.25 . 100, 41–47.
- Professeure d’obstétrique, de gynécologie et de médecine environnementale, directeur du Centre d’épidémiologie reproductive. Université de Rochester (NY, États-Unis)
- Article « Le meilleur des mondes. La lutte contre le cancer et les promesses du nouveau millénaire » Maladies chroniques au Canada, par Anthony B. Miller, site de Santé Canada consulté : Version 2008 12 06
Voir aussi
modifierArticles connexes
modifierGonades
- Gamète, Gamétogénèse,
- Ovaire, Ovules,
- Ovogenèse,
- Spermatogonies,
- Cellules de Leydig,
- Cellules de Sertoli,
- Spermiogenèse,
- Spermatozoïde,
- Sperme,
- Spermogramme, Spermocytogramme,
- Compétition spermatique.
Système hormonal
- Système endocrinien,
- Hormone,
- Testostérone,
- Gonadostimulines,
- Hypophyse,
- Glande surrénale,
- Hormone lutéinisante ou LH (contrôle la sécrétion pulsatile de testostérone),
- Hormone folliculo-stimulante ou FSH,
- Perturbateur endocrinien,
- Fécondation assistée.
Malformations, anomalies
- Syndrome de dysgénésie testiculaire,
- Diphallia et triphallia,
- Hypospadias,
- Micropénis,
- Distance ano-génitale (indice chez le garçon d'exposition prénatale à des hormones féminisantes),
- Délétion de la spermatogenèse,
- Tératospermie,
- Azoospermie,
- Asthénospermie,
- Oligoasthénotératospermie ou oligospermie,
- Nécrospermie,
- Cryptozoospermie.
Cancers
Médecine, Recherche
- Santé reproductive, Santé-environnement,
- Fertilité,
- Reproduction (biologie), Procréation,
- Fécondation in vitro,
- Clonage,
- CECOS, Don de sperme, Banque du sperme.
Divers
Liens externes
modifierBibliographie
modifier- (en) D. Mortimer, C. L. R. Barratt, L. Bjorndahl et C. de Jager, « What should it take to describe a substance or product as 'sperm-safe' », Human Reproduction Update, vol. 19, no suppl 1, , i1–i45 (ISSN 1355-4786 et 1460-2369, DOI 10.1093/humupd/dmt008, lire en ligne, consulté le )
- (en) Hagai Levine, Niels Jørgensen, Anderson Martino-Andrade, Jaime Mendiola, Dan Weksler-Derri, Irina Mindlis, Rachel Pinotti et Shanna H. Swan, « Temporal trends in sperm count: a systematic review and meta-regression analysis », Human Reproduction Update, , p. 1–14 (DOI 10.1093/humupd/dmx022)
- Johnson, S. L., Dunleavy, J., Gemmell, N. J., & Nakagawa, S. (2015). Consistent age-dependent declines in human semen quality: a systematic review and meta-analysis. Ageing research reviews, 19, 22-33.
- Katsuhiko Itoh & al. (2019) Dephosphorylation of protamine 2 at serine 56 is crucial for murine sperm maturation in vivo |Sci. Signal. 26 Mar 2019:Vol. 12, Issue 574, eaao7232|DOI: 10.1126/scisignal.aao7232