Molécule d'eau
La molécule d’eau[b], de formule H2O, est le constituant essentiel de l’eau pure. Celle-ci contient également des ions résultant de l’autoprotolyse de l’eau selon l’équation d'équilibre : H2O H+ + OH− (ou 2 H2O H3O+ + OH−). L’eau pure n’est pas présente dans la nature et doit être obtenue par des processus physiques.
| Eau | ||
| ||
 | ||
| Géométrie de la molécule d’eau et représentation 3D. | ||
| Identification | ||
|---|---|---|
| No CAS | ||
| No CE | 231-791-2 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide transparent[a]. Bleu sur la tranche de la glace (ex. : glacier)[1] | |
| Propriétés chimiques | ||
| Formule | H2O [Isomères] |
|
| Masse molaire[4] | 18,015 3 ± 0,000 4 g/mol H 11,19 %, O 88,81 %, |
|
| Moment dipolaire | 1,854 6 ± 0,004 0 D[2] | |
| Diamètre moléculaire | 0,343 nm[3] | |
| Propriétés physiques | ||
| T° fusion | 0 °C[5] | |
| T° ébullition | 100 °C[5] | |
| Paramètre de solubilité δ | 47,9 MPa1/2 (25 °C)[6] | |
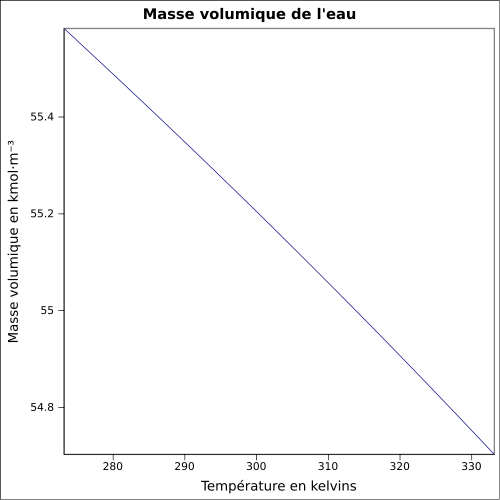
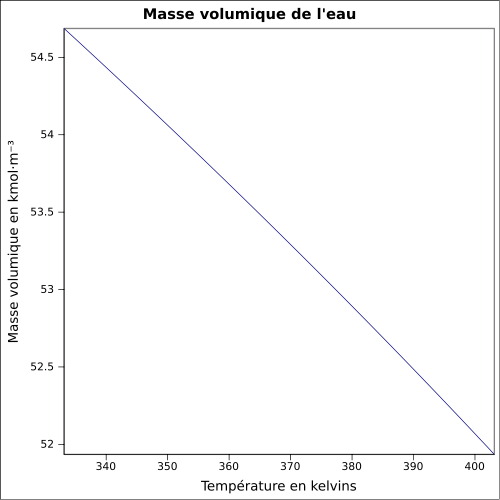
| Masse volumique | 1,000 0 g/cm3 (3,98 °C) 0,997 05 g/cm3 (25 °C)[5] |
|
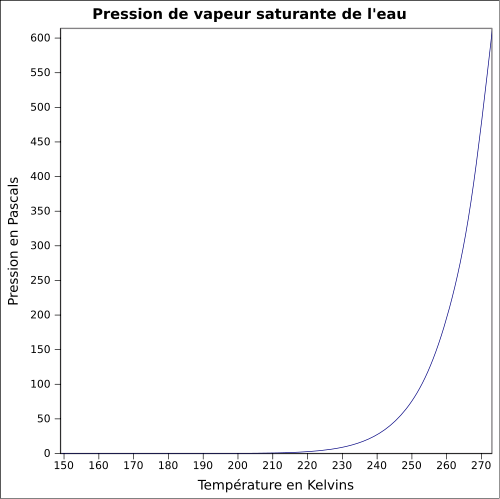
| Pression de vapeur saturante | 6,112 mbar (glace, 0 °C)[8] 12,4 mbar (10 °C) |
|
| Viscosité dynamique | 0,001 002 Pa s à 20 °C[réf. souhaitée] | |
| Point critique | 374,15 °C, 22,12 MPa, 0,063 l/mol[9] | |
| Point triple | 0,01 °C[10] ; 611,73 Pa |
|
| Conductivité thermique | 565 mW K−1 m−1[réf. souhaitée] | |
| Tension superficielle à 20 °C | 0,072 8 N/m[réf. souhaitée] | |
| Conductivité électrique | 5,5 × 10−6 S/m[réf. souhaitée] | |
| Thermochimie | ||
| ΔfH0gaz | −241,83 kJ·mol-1[11] | |
| ΔfH0liquide | −285,10 kJ·mol-1[11] | |
| ΔfusH° | 335 J·g-1[réf. souhaitée] | |
| ΔvapH° | 40,65 kJ mol−1 (1 atm, 99,97 °C) ; 43,98 kJ mol−1 (1 atm, 25 °C)[12] |
|
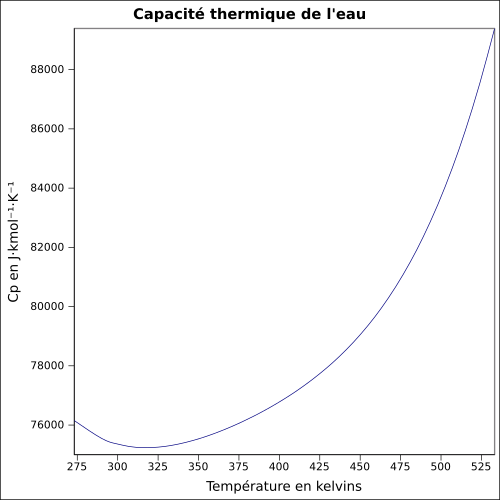
| Cp | 35,22 J mol−1 K−1 (gaz, 226,85 °C) 75,38 J mol−1 K−1 (liquide, 24,85 °C)[13] | |
| Cv | 3,724 J g−1 K−1 (gaz)[réf. souhaitée] | |
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 12,620 6 ± 0,002 0 eV (gaz)[15] | |
| Cristallographie | ||
| Système cristallin | hexagonal | |
| Classe cristalline ou groupe d’espace | (no 194) |
|
| Paramètres de maille | a = 4,521 2 Å c = 7,366 6 Å[réf. souhaitée] |
|
| Propriétés optiques | ||
| Indice de réfraction | 1,332 5[3] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
L’eau à pression ambiante (environ un bar) est gazeuse au-dessus de 100 °C, solide en dessous de 0 °C et liquide entre les deux[c] ; les autres composés proches ou apparentés (sulfure d’hydrogène, ammoniac et méthane) sont tous gazeux même à des températures bien plus basses.
Physique
modifierPropriétés générales
modifierL’état solide de l’eau est la glace ; l’état gazeux est la vapeur d'eau.
L’état de l’eau dépend des conditions de pression P et de température T. Il existe une situation unique (P,T) dans laquelle l’eau coexiste sous les trois formes solide, liquide, et gazeux ; cette situation est appelée « point triple de l’eau », elle a lieu à une température de 273,16 K (0,01 °C) et une pression de 611,2 Pa.
Les unités de température (degrés Celsius, kelvin) sont définies en prenant ce point triple de l’eau comme référence.
La vitesse du son dans l’eau est de 1 500 m/s dans les conditions normales de température et de pression.
La conductivité électrique de l'eau pure à 20 °C est très faible : 5,5 × 10−6 S/m. L'eau pure est donc considérée comme un isolant électrique[16].
La masse d’un litre d’eau à la température de 4 °C était la première définition du kilogramme. Par approximation, on prend pour masse volumique de l’eau dans les conditions normales la valeur de 1 000 kg/m3, une tonne par mètre cube ou encore un kilogramme par litre (1 kg/l).
La capacité thermique massique[d] de l’eau est de 4 186 J kg−1 K−1 dans les conditions normales de température et de pression. L’eau était utilisée comme étalon de chaleur dans d’anciens systèmes d’unités : la calorie (et la frigorie) quantifiait la chaleur à apporter pour augmenter d’un degré Celsius la température d’un gramme d’eau : soit 4,185 J.
L’eau est pratiquement considérée comme un fluide incompressible dans la plupart des applications. Son coefficient de compressibilité est de 4,5 × 10−10 Pa−1.
| Temp. (°C) |
Masse volumique (g/cm3) |
Capacité thermique massique (J g−1 K−1) |
Viscosité (µPa s) |
Pression de vapeur saturante (bar) |
Enthalpie de vaporisation (kJ/kg) |
Conductivité thermique (W m−1 K−1) |
|---|---|---|---|---|---|---|
| 0 | 0,999 84 | 4,217 6 | 1 793 | 0,006 11 | 2 500,5 | 0,569 |
| 10 | 0,999 70 | 4,192 1 | 1 307 | 0,012 28 | 2 467,9 | 0,587 |
| 20 | 0,998 21 | 4,181 8 | 1 002 | 0,023 38 | 2 453,4 | 0,604 |
| 30 | 0,995 65 | 4,178 4 | 797,7 | 0,042 45 | 2 429,6 | 0,618 |
| 40 | 0,992 22 | 4,178 5 | 653,2 | 0,073 82 | 2 405,9 | 0,632 |
| 50 | 0,988 03 | 4,180 6 | 547,0 | 0,123 46 | 2 309,9 | 0,643 |
| 60 | 0,983 20 | 4,184 3 | 466,5 | 0,199 36 | 2 357,7 | 0,654 |
| 70 | 0,977 78 | 4,189 5 | 404,0 | 0,311 81 | 2 333,1 | 0,662 |
| 80 | 0,971 82 | 4,196 3 | 354,4 | 0,473 79 | 2 308,2 | 0,670 |
| 90 | 0,965 35 | 4,205 0 | 314,5 | 0,701 23 | 2 282,7 | 0,676 |
| 100 | 0,958 40 | 4,215 9 | 281,8 | 1,013 25 | 2 256,6 | 0,681 |
| Altitude (m) | Pression (atm)[17] | Temp. (°C) |
|---|---|---|
| 0 | 1,00 | 100 |
| 4 806 (Mont Blanc) | 0,547 | 83,9 |
| 8 849 (Everest) | 0,311 | 70,2 |
| 19 200 | 0,063 | 36,8 |
À 20 000 m environ, l’eau entre en ébullition à la température du corps humain : c’est une barrière infranchissable pour l’humain sans dispositif de pressurisation (vêtement à pressurisation partielle, scaphandre, ou cabine pressurisée).
L'eau comme fluide thermodynamique
modifierL'eau est un fluide thermodynamique d'usage courant, efficace et économique[18].
- L'eau a une densité maximale de 1 000 kg/m3 (soit 1 kg/l à l'origine la définition du kilogramme) ; exactement 999,975 kg/m3 à 3,98 °C.
- L'eau a la capacité thermique à pression constante la plus élevée de tous les liquides (75,711 J mol−1 K−1 soit 4,202 6 kJ kg−1 K−1 à 20 °C). Les océans sont de bons accumulateurs de la chaleur.
- L'eau est stable en température jusqu'à une valeur élevée autorisant son usage comme fluide de travail dans les cycles thermodynamiques classiques.
- L'eau est stable sous rayonnement dont le rayonnement neutronique[e].
- L'eau a la tension superficielle la plus élevée de tous les liquides (72 mN/m à 20 °C) à l'exception du mercure ; dans l'air humide, la formation des gouttelettes est facilitée ; dans un tube capillaire, l'eau monte ainsi que la sève dans les arbres.
- L'eau a la chaleur latente d'évaporation la plus élevée de tous les liquides (44,22 kJ/mol soit 2 454,3 kJ/kg à 20 °C) ; donc l'effet réfrigérant de la transpiration est efficace.
- L'eau a une chaleur latente de fusion élevée (6,00 kJ/mol soit 333,0 kJ/kg).
- L'eau a une très faible conductivité thermique (0,604 W m−1 K−1 à 20 °C).
- L'eau et la glace ont une couleur bleutée sous forte épaisseur (car la molécule H20 absorbe davantage les longues longueurs d'onde - rouge - que les courtes - bleu).[non pertinent]
- L'eau est transparente à la lumière visible, ainsi les organismes aquatiques peuvent vivre car la lumière du soleil peut les atteindre ; elle est cependant opaque au rayonnement infrarouge absorbé par l'hydrogène, l'oxygène et leur liaison.
| Grandeur physique |
Commentaire | Corrélation |
|---|---|---|
| Masse volumique ρ |
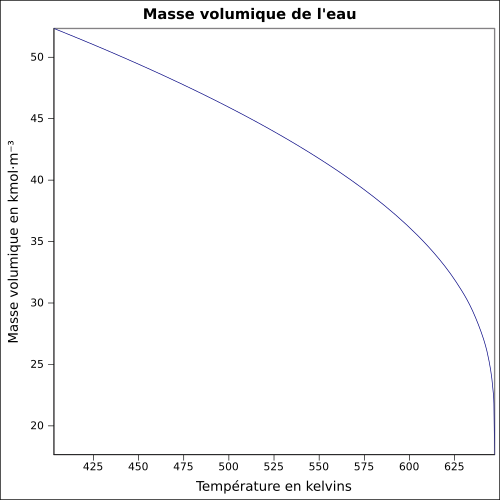
La masse volumique de l'eau diminue avec la température et augmente un peu avec la pression. Une modélisation linéaire donne de bons résultats, dès lors qu'on ne se trouve pas au voisinage de la saturation. | Boite déroulante et Infobox |
| Viscosité dynamique µ |
La viscosité dynamique de l'eau varie fortement dans la gamme de température 0 à 100 °C (plus d'un facteur 6). Toute modélisation ou essai doit tenir compte de ce phénomène comme les maquettes testées en analogie de Reynolds. | Boite déroulante |
| Conductivité thermique λ |
La conductivité thermique de l'eau augmente avec la température jusque vers 130 à 140 °C et diminue ensuite. Elle augmente avec la pression. Elle varie cependant assez peu et une interpolation linéaire sur des plages de température et pression d'une centaine de degrés Celsius et de bars donne des résultats corrects. | Boite déroulante |
| Capacité thermique à pression constante Cp |
La capacité thermique massique de l'eau est de 4 185 J kg−1 K−1, à pression normale[19]. Elle est largement constante aux basses températures et proche de 4,18 kJ kg−1 K−1, elle augmente régulièrement avec la température et baisse un peu avec la pression. Il est possible de modéliser correctement l'enthalpie de l'eau liquide de façon linéaire dans de larges plages de température et pression dès lors qu'on ne s'approche pas à moins de 10 °C des conditions de saturation. Cp augmente au voisinage de la saturation et prend une valeur très grande (théoriquement infinie) au point critique de l'eau. | Boite déroulante et Infobox |
| Pression de vapeur saturante psat |
La formule de Duperray fournit une bonne approximation dans la gamme de température entre 95 °C et 230 °C. Il est commode d'améliorer un peu cette formule, la boite déroulante donne une corrélation de ce type. | Boite déroulante et Infobox |
| Masse volumique de la vapeur ρsat |
Des conditions normales jusqu'à 140 °C - 3,6 bar, la masse volumique de la vapeur saturée n'est guère plus élevée que celle du gaz parfait (moins de 5 %). Au-delà de 10 bar et jusqu'à 60 bar, la relation simpliste empirique : ρsat = psat/2 donne un résultat par valeurs inférieures à mieux que 4 % (ρsat en kg/m3 et psat en bar). En dehors du voisinage du point critique, la vapeur surchauffée se comporte comme un gaz parfait triatomique dès une vingtaine de degrés Celsius de surchauffe. |
Boite déroulante |
| Enthalpie de la vapeur saturée hsat |
Dans une large gamme de pressions (de 5 à 85 bar), l'enthalpie de la vapeur saturée est constante au 1er ordre, soit environ 2 775 kJ/kg. | Boite déroulante |
Propriétés nucléaires L'eau légère présente une section efficace microscopique totale (2 ⋅ hydrogènes + 1 ⋅ oxygène) de 0,931 mb aux neutrons thermiques. L'eau est plus capturante que l'eau lourde car le tritium formé par capture d'un neutron par le deutérium est un nucléide instable tandis que le deutérium formé par capture d'un neutron par le protium est stable.
| Grandeur physique |
Corrélation | Commentaire |
|---|---|---|
| Capacité thermique à pression constante Cp |
avec Cp en kJ kg−1 K−1, t en °C et p en bars absolus ; applicable de 1 à 250 bar et de 0 à 370 °C. Test : à 100 °C et 10 bar, Cp = 4,205 kJ kg−1 K−1 ; à 304,5 °C et 155 bar, Cp = 5,620 kJ kg−1 K−1 (valeurs calculées). |
Non aisément intégrable. |
| Masse volumique de l'eau liquide ρ |
avec ρ en kg/m3, t en °C et p en bars absolus ; applicable de 1 à 250 bar et de 0 à 370 °C. Test : à 300 °C et 155 bar, ρ = 716,85 kg/m3 ; à 100 °C et 10 bar, ρ = 958,63 kg/m3, valeurs calculées. |
Rassemble les trois corrélations données dans l'Infobox. Le 1er terme représente la masse volumique à 221,2 bar ; le 2e est un correctif de pression. |
| Conductivité thermique de l'eau liquide λ |
avec λ en W m−1 K−1, t en °C et p en bars absolus ; applicable de 1 à 250 bar et de 0 à 370 °C. |
Le 1er terme donne la conductivité à 221,2 bar ; le 2e (noté « l ») est un correctif fonction de la pression. |
| Viscosité dynamique de l'eau liquide μ |
avec t en °C, p en bar et µ en 10−6 kg m−1 s−1 ; applicable de 0 à 370 °C et de 0 à 180 bar. Test : à 25 °C et 10 bar, µ = 888,1 × 10−6 kg m−1 s−1 ; à 300 °C et 150 bar, µ = 91,66 × 10−6 kg m−1 s−1 (valeurs calculées). |
1/µ évolue au 1er ordre linéairement avec la température. α est un correctif fonction de la pression. m améliore le résultat entre 0 °C et 20 °C où la viscosité varie fortement. |
| Pression de vapeur saturante psat |
avec tsat en °C et psat en bar ; applicable de 130 à 370 °C. |
Corrélation dérivée de la formule de Duperray, donne un résultat à moins de 1 %. |
| Pression de vapeur saturante psat |
avec tsat en °C et psat en Pa ; applicable de 0 à 374 °C. |
Corrélation dérivée de la formule de Dupré. Non aisément inversable. |
| Température de vapeur saturante tsat |
avec tsat en °C et psat en bar ; applicable de 0,125 à 221,2 bar. |
Corrélation pratique, non aisément inversable. |
| Masse volumique de la vapeur saturante ρsat |
avec ρsat en kg/m3 et p en bar ; applicable de 5 à 200 bar. Test : à 30 bar, ρsat = 15,03 kg/m3 ; à 60 bar, ρsat = 30,66 kg/m3 (valeurs calculées).
avec ρsat en kg/m3 et t en °C ; applicable de 100 à 360 °C. Test : à 233,84 °C, ρsat = 15,43 kg/m3 ; à 275,61 °C, ρsat = 31,45 kg/m3 (valeurs calculées). |
Rappelle la relation empirique simple ρsat = p/2 applicable entre 10 et 60 bar. |
| Enthalpie de la vapeur saturée hsat |
avec hsat en kJ/kg et tsat en °C ; applicable de 100 à 330 °C. |
| Cond. Temp. et Press. |
Masse volumiq. (kg/m3) |
Viscos. dynam. (10−3 kg m−1 s1) |
Conduc. therm. (W m−1 K−1) |
Capac. therm. à press. const. (kJ/kg) |
Press. de vap. satur. (bar) |
Enthalp. du liq. (kJ/kg) |
Enthalp. de la vap. (kJ/kg) |
Chaleur latente d'évap. (kJ/kg) |
Nb de Prandtl |
Commentaire |
|---|---|---|---|---|---|---|---|---|---|---|
| 0 °C 1 bar |
999,80 | 1,750 | 0,569 | 4,217 | 0,006 108 | −0,04 | 2 501,6 | 2 501,6 | 12,97 | |
| 0,01 °C 1 bar |
999,80 | 1,750 | 0,569 | 4,217 | 0,006 112 | 0,00 | 2 501,6 | 2 501,6 | 12,97 | Point triple de l'eau. |
| 4 °C 500 bar |
1 024,06 | 1,544 | 0,613 2 | 4,001 | s. o. | 65,4 | s. o. | s. o. | 10,074 | Le fond des océans. |
| 3,98 °C 1 bar |
999,975 | 1,570 9 | 0,576 16 | 4,214 1 | 0,008 117 9 | 16,716 | 2 508,86 | 2 492,15 | 11,49 | La densité maximale aux conditions ordinaires. |
| 20 °C 1 bar |
998,30 | 1,000 | 0,604 | 4,203 | 0,023 37 | 84,0 | 2 538,2 | 2 454,3 | 6,959 | Eau à température et pression ordinaires. |
| 50 °C 1 bar |
988,04 | 0,544 | 0,643 | 4,181 | 0,123 35 | 209,3 | 2 592,2 | 2 382,9 | 3,537 | |
| 100 °C 1 bar |
958,13 | 0,279 | 0,681 | 4,210 | 1,013 3 | 419,06 | 2 676,0 | 2 256,9 | 1,725 | L'eau bout à 100 °C sous une atmosphère. |
| 200 °C 75 bar |
869,19 | 0,135 5 | 0,670 | 4,463 | 15,549 | 854,85 | 2 790,9 | 1 938,6 | 0,903 | |
| 229,5 °C 72 bar |
832,18 | 0,117 7 | 0,644 | 4,648 | 27,72 | 988,89 | 2 801,9 | 1 830,3 | 0,849 | Eau alimentaire des GV d'un REP. |
| 270 °C 155 bar |
781,49 | 0,102 | 0,607 | 4,956 5 | 70,218 | 1 182,7 | 2 789,9 | 1 604,6 | 0,833 | |
| 286 °C 155 bar |
753,65 | 0,096 34 | 0,644 | 5,191 | 70,218 | 1 263,7 | 2 773,2 | 1 504,6 | 0,777 | Eau à l'entrée du cœur d'un REP. |
| 300 °C 155 bar |
726,69 | 0,080 4 | 0,559 | 5,483 | 85,927 | 1 337,8 | 2 751,0 | 1 406,0 | 0,789 | |
| 304,5 °C 155 bar |
716,66 | 0,090 29 | 0,551 3 | 5,626 | 91,509 | 1 363,0 | 2 742,15 | 1 371,6 | 0,921 | Eau dans le cœur d'un REP. |
| 323 °C 155 bar |
671,11 | 0,083 419 | 0,510 16 | 6,431 7 | 117,44 | 1 472,78 | 2 694,5 | 1 238,34 | 1,052 | Eau à la sortie du cœur d'un REP. |
| 330 °C 155 bar |
651,17 | 0,080 57 | 0,491 | 7,147 | 128,63 | 1 517,9 | 2 670,2 | 1 143,6 | 1,173 | |
| 344,76 °C 155 bar |
594,036 | 0,073 258 | 0,449 05 | s. o. | 128,63 | 1 630,75 | 2 600,3 | 969,55 | s. o. | Eau dans le pressuriseur d'un REP. |
| 374,15 °C 221,20 bar |
315,5 | 0,045 | 0,238 | ∞ | 221,20 | 2 107,4 | 2 107,4 | 0,0 | ∞ | Point critique de l'eau. |
Propriétés liées à la vie terrestre
modifierCertaines des caractéristiques de l’eau font d’elle une molécule remarquable, aux particularités qui ont permis à la vie sur Terre de se développer. Ces caractéristiques, surtout liées à sa nature dipolaire, sont explicitées dans les chapitres qui suivent.
- Dans les phases condensées (solide, liquide) de l’eau, ses molécules ont une forte cohésion entre elles de par les liaisons hydrogène, ce qui fait que ses phases condensées sont « difficiles » à évaporer ; l'eau a une température d’ébullition particulièrement élevée pour une molécule de cette masse molaire. Cela permet à une importante phase liquide d’exister aux températures connues sur Terre, phase liquide indispensable à la vie telle que nous la connaissons.
- De même, ses propriétés de solvant « doux » permettent à un très grand nombre de réactions biochimiques de se produire.
- Le fait que la densité de l’eau soit plus grande à l’état liquide que solide, propriété rare partagée qu'avec quelques autres substances (voir chapitre suivant), a une conséquence remarquable : la glace flotte sur l’eau liquide. De surcroît, le fait que la densité de l’eau douce soit maximale à 4 °C fait que la température au fond d’un lac ne descend pas en dessous de 4 °C (sauf cas extrêmes). Cela permet à la vie aquatique de survivre aux périodes glacées, car l’eau reste liquide sous son manteau de glace isolant (pour la plupart des espèces chimiques, la densité à l’état liquide est plus faible qu’à l’état solide).
- Par ailleurs, sa tension superficielle particulièrement élevée permet le phénomène de capillarité (qui permet, entre autres, à la sève des végétaux de monter) et à de nombreux êtres vivants de se déplacer sur la surface de l’eau.
Formes
modifierL’eau peut prendre différentes formes :
- la phase liquide est simplement appelée eau, ou eau liquide s’il y a un risque d’ambiguïté ;
- la phase gazeuse est appelée vapeur d'eau, ou simplement vapeur ;
- au-dessus d’une certaine température Tc ou d'une certaine pression Pc, dites « critiques » (Tc = 647,3 K et Pc = 22,120 MPa), il n'y a plus de transition de phase entre les états liquide et gazeux, et l'on passe continûment de l'un à l'autre en faisant varier la température T ou la pression P. Quand T et P dépassent Tc et Pc on dit que l’eau est dans un état supercritique, on parle d’eau supercritique ;
- à l’état solide, l’eau est appelée glace, mais il en existe plusieurs polymorphes qui diffèrent par leur structure cristalline : glace Ih (la glace ordinaire), glace VI, glace VII, glace IX, glace XII, etc. (formes de haute pression). Il existe également plusieurs types de glace amorphe.
- plusieurs études ont suggéré l’existence, à l’interface eau-glace, d’une zone d’exclusion où l’eau serait dans un état intermédiaire, analogue aux cristaux liquides et repérable par une bande d'absorption particulière dans le proche ultraviolet[20]. Il semble toutefois probable qu’il ne s’agisse que d’un phénomène optique lié à la dynamique de flux d'ions associés à la transition de phase[21].
L'explication physique du fait que l’eau solide soit moins dense que l’eau liquide vient de la structure cristalline de la glace, connue sous le nom de glace Ih (« h » pour hexagonale). L’eau, comme quelques (rares) matériaux, comme le silicium, le gallium, le germanium, l’antimoine, le bismuth, et le plutonium, se dilatent en passant de la forme liquide au solide ; la plupart des autres matériaux se contractent à la solidification.
Il faut toutefois noter que toutes les formes de glace ne sont pas moins denses que l’eau liquide. Par exemple la glace HDA et la glace VHDA sont toutes les deux plus denses que l’eau liquide pure. Dans ce cas, la raison pour laquelle la forme commune de la glace est moins dense est un peu moins intuitive, elle dépend fortement des propriétés intrinsèques peu communes des liaisons hydrogène.
Indice de réfraction
modifier| Longueur d’onde λ (nm) |
T = 10 °C | T = 20 °C | T = 30 °C |
|---|---|---|---|
| 706,5 | 1,330 7 | 1,330 0 | 1,329 0 |
| 589,3 | 1,333 7 | 1,333 0 | 1,331 9 |
| 501,6 | 1,337 1 | 1,336 4 | 1,335 3 |
| 404,7 | 1,343 5 | 1,342 7 | 1,341 7 |
Tous les milieux transparents sont dispersifs, ce qui signifie que la vitesse de la lumière change avec sa longueur d'onde λ. Plus précisément, dans la partie visible du spectre électromagnétique (approximativement 400 à 700 nm) l’indice de réfraction est généralement une fonction décroissante de la longueur d’onde : la lumière bleue est plus déviée que le rouge. En outre, le taux de changement de l’indice de réfraction augmente lorsque la longueur d’onde diminue. L’indice de réfraction augmente habituellement avec la densité du milieu.
L’eau présente toutes ces caractéristiques.
Le tableau précédent montre les résultats de quelques mesures[22] de l’indice de réfraction de l’eau par rapport à de l’air sec de même température T que l’eau et à la pression de une atmosphère (760 mmHg ou 1 013 hPa).
Pour convertir les valeurs sous forme de tableaux relatifs à l’indice du vide, il faut ajouter 4 à la quatrième position décimale. Notons que l’indice de réfraction augmente lorsque la température de l’eau diminue. Ces résultats sont conformes aux attentes, puisque la densité de l’eau liquide augmente lorsqu’elle se refroidit. Cependant, si les mesures sont faites à de plus basses températures l’indice ne montre pas d’extremum à 4 °C, bien que la densité de l’eau y soit maximale.
L’indice de réfraction est également une fonction de la pression de l’eau, mais la dépendance est faible en raison de l’incompressibilité relative de l’eau (comme tous les liquides). En fait, sur les gammes normales des températures (0 à 30 °C), l’augmentation approximative de l’indice de réfraction est de 0,000 016 quand la pression de l’eau augmente d’une atmosphère.
Les facteurs les plus significatifs affectant l’indice de réfraction sont la longueur d’onde de la lumière et la salinité de l’eau. Néanmoins, l’indice de réfraction excède de moins de 1 % la gamme indiquée des valeurs de ces variables[23].
Propriétés quantiques
modifierUn nouvel « état quantique » de l’eau a été observé alors que des chercheurs ont introduit des molécules d’eau dans un nanotube de carbone de 1,6 nm de diamètre et l'ont exposée à une diffusion de neutrons. Les protons des atomes d’hydrogène et d’oxygène possèdent alors une énergie supérieure à celle de l’eau libre, en raison d’un état quantique singulier. Ceci pourrait expliquer le caractère exceptionnellement conducteur de l’eau au travers des « canaux » qui traversent les membranes cellulaires biologiques[24].
Chimie
modifierNature dipolaire
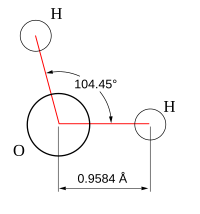
modifierUne propriété très importante de l’eau est sa nature polaire. La molécule d’eau forme un angle de 104,45° au niveau de l’atome d’oxygène entre les deux liaisons avec les atomes d’hydrogène. Puisque l’oxygène a une électronégativité plus forte que l’hydrogène, l’atome d’oxygène a une charge partielle négative δ−, alors que les atomes d’hydrogène ont une charge partielle positive δ+. Une molécule avec une telle différence de charge est appelée un dipôle (molécule polaire). Ainsi, l’eau a un moment dipolaire de 1,83 debye. Cette polarité fait que les molécules d’eau s’attirent les unes les autres, le côté positif de l’une attirant le côté négatif d’une autre. Un tel lien électrique entre deux molécules s’appelle une liaison hydrogène.
Cette polarisation permet aussi à la molécule d’eau de dissoudre les corps ioniques, en particulier les sels, en entourant chaque ion d’une coque de molécules d’eau par un phénomène de solvatation.
Cette force d’attraction, relativement faible par rapport aux liaisons covalentes de la molécule elle-même, explique certaines propriétés comme le point d'ébullition élevé (quantité d’énergie calorifique nécessaire pour briser les liaisons hydrogène), ainsi qu’une capacité thermique élevée.
À cause des liaisons hydrogène également, la densité de l’eau liquide est supérieure à la densité de la glace.
Autoprotolyse
modifierL’eau se dissocie naturellement en ion oxonium H3O+ (aussi appelé hydronium) et ion hydroxyde OH− : 2 H2O = H3O+ + OH−.
La réaction est dite d’autodissociation ou d’autoprotolyse.
Dans cette réaction, l’eau joue à la fois le rôle d’acide et de base : comme acide, elle perd un proton H+ et devient l’ion hydroxyde OH− ; comme base elle gagne un proton H+ et devient l’ion oxonium H3O+. On dit donc que c’est une espèce amphotère ou un ampholyte.
La constante d'équilibre de cette réaction est très faible (10−14 à 25 °C) ; le nombre d’ions oxonium et hydroxyde formés est donc très minoritaire devant le nombre de molécules d’eau.
Du fait de l’équilibre, à une température donnée, le produit des concentrations de ces ions est constant, égal à la constante de dissociation. À 25 °C, il vaut : [H3O+]·[OH−] = 10−14.
Dans l’eau pure, les ions H3O+ et OH− sont issus uniquement de l’autoprotolyse de l’eau, ils sont donc présents en concentrations égales, donc : [H3O+] = [OH−] = 10−7 mol/l (à 25 °C).
Le pH étant défini à partir de la concentration en ions oxonium (pH = −log10 [H3O+]), à 25 °C, le pH de l’eau pure vaut donc 7, il est dit neutre.
Cet équilibre acide/base est d’une importance capitale en chimie inorganique comme en chimie organique.
Comme solvant
modifierGrâce à sa polarité, l’eau est un excellent solvant. Quand un composé ionique ou polaire pénètre dans l’eau, il est entouré de molécules d’eau. La relative petite taille de ces molécules d’eau fait que plusieurs d’entre elles entourent la molécule de soluté. Les dipôles négatifs de l’eau attirent les régions positivement chargées du soluté, et vice versa pour les dipôles positifs. L’eau fait un excellent écran aux interactions électriques (la permittivité électrique εe de l’eau vaut 78,5 à 25 °C), il dissocie donc facilement les ions.
En général, les substances ioniques et polaires comme les acides, alcools, et sels se dissolvent facilement dans l’eau, et les substances non polaires comme les huiles et les graisses se dissolvent difficilement. Ces substances non polaires restent ensemble dans l’eau car il est énergétiquement plus facile pour les molécules d’eau de former des liaisons hydrogène entre elles que de s’engager dans des interactions de van der Waals avec les molécules non polaires.
Un exemple de soluté ionique est le sel de cuisine alias chlorure de sodium, NaCl, qui se sépare en cations Na+ et anions Cl−, chacun entouré de molécules d’eau. Les ions sont alors facilement transportés loin de leur matrice cristalline. Un exemple de soluté non ionique est le sucre de table. Les dipôles des molécules d’eau forment des liaisons hydrogène avec les régions dipolaires de la molécule de sucre.
Cette faculté de solvant de l’eau est vitale en biologie, parce que certaines réactions biochimiques n’ont lieu qu’en solution (par exemple, réactions dans le cytoplasme ou le sang).
C’est pourquoi, pour le moment, l’eau liquide est considérée comme indispensable à la vie et est activement recherchée sur les divers astres du système solaire, notamment sur Mars et Europe, une lune de Jupiter.
Tension superficielle
modifierLes liaisons hydrogène confèrent à l’eau une grande tension superficielle et une grande cohésion. Cela se voit quand de petites quantités d’eau sont posées sur une surface non poreuse et que l’eau reste ensemble sous forme de gouttes. Cette propriété qui se manifeste par la capillarité est utile dans le transport vertical de l’eau chez les végétaux (sève) et nuisible avec la remontée capillaire d’humidité dans les murs de maisons à partir du sol.
Conductivité
modifierL’eau pure est un mauvais conducteur d’électricité[16]. Mais puisque l’eau est un bon solvant, elle contient souvent une grande quantité de solutés dissous, le plus souvent des ions. Si l’eau contient de telles impuretés, elle peut conduire l’électricité plus facilement. Le stator des très gros alternateurs est refroidi par circulation d’eau désionisée dans les conducteurs creux de l’enroulement. Malgré les différences de potentiel de plusieurs dizaines de milliers de volts entre le circuit de refroidissement et les conducteurs électriques, il n’y a pas de problèmes de fuite de courant. Voir conductivité électrique (mesure).
La pureté de l’eau peut être mesurée par sa résistance à un courant électrique.
Décomposition (thermolyse et électrolyse)
modifierLa première décomposition de l’eau fut faite par Lavoisier, en faisant passer de la vapeur d'eau sur du fer chauffé au rouge (thermolyse)[25]. Ce faisant, il établit que l’eau n’était pas un élément mais un corps chimique composé de plusieurs éléments.
La thermolyse (décomposition thermique) de l'eau pure produit du dioxygène et du dihydrogène : 2 H2O → 2 H2 + O2.
Elle requiert une température très élevée, de l'ordre de 2 000 °C, et n'est totale que vers 5 000 °C[26].
Il est plus aisé de décomposer l’eau par électrolyse. Sous l’effet d’une tension appliquée entre deux électrodes plongées dans de l’eau, l’eau peut être décomposée en dihydrogène et dioxygène. Les molécules d’eau se dissocient naturellement en ions H3O+ et OH−, qui sont attirés par la cathode et l’anode respectivement, mais comme cette dissociation est faible, dans la pratique on a recours à des catalyseurs comme l’acide sulfurique ou l’hydroxyde de sodium. À l’anode, quatre ions OH− se combinent pour former des molécules de dioxygène O2, deux molécules d’eau, et libérer quatre électrons. Les molécules de dioxygène ainsi produites s’échappent sous forme de bulles de gaz vers la surface, où elles peuvent être collectées. Dans le même temps, à la cathode, il y a une libération de deux molécules de dihydrogène H2 avec utilisation de quatre électrons.
4OH− → O2 + 2H2O + 4e−
4H3O+ + 4e− → 2H2 + 4H2O
Production d'eau pure
modifierL’eau pure est un excellent solvant et absorbe facilement les gaz qui entrent à son contact. Par conséquent, l’eau pure est pratiquement introuvable. Les laboratoires d’analyses ont néanmoins besoin de cette eau pure pour réaliser des analyses fiables. Ils vont donc faire appel, au cours du temps, à des techniques de purification de plus en plus sophistiquées.
Après l’eau distillée, bidistillée, déminéralisée, déionisée, la technique progresse vers une eau de plus en plus pure, donc coûteuse à produire et de plus en plus instable.
Notes et références
modifierNotes
modifier- L'eau est en réalité bleue, mais tellement transparente que cette couleur n'est généralement visible qu'à partir d'une certaine épaisseur ou profondeur. Pour plus de détails, voir l'article « Couleur de l'eau ».
- On peut également la nommer monoxyde de dihydrogène, hydroxyde d’hydrogène, acide hydroxyque, hydroxyde d’hydronium, ou acide hydrique, ou bien génériquement oxyde d’hydrogène, mais de tels noms ne sont généralement utilisés que de façon ironique : voir canular du monoxyde de dihydrogène.
- En raison des retards à la nucléation on peut rencontrer de l'eau liquide en dessous de 0 °C (en surfusion) ou au-dessus de 100 °C, comme de la vapeur d'eau en dessous de 100 °C, mais seulement de façon transitoire (en équilibre métastable).
- Anciennement chaleur massique ou chaleur spécifique.
- En réacteur à eau pressurisée, on observe une radiolyse au passage de l'eau dans le cœur du réacteur ; on limite l'effet corrosif de l'oxygène naissant en fonctionnant avec un excès d'hydrogène dissous dans l'eau.
Références
modifier- (en) Pourquoi l’eau est-elle bleue ?, sur dartmouth.edu.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 9-50.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Water » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 8 mars 2010 (JavaScript nécessaire).
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294.
- (en) T. E. Daubert et R. P. Danner, Physical And Thermodynamic Properties Of Pure Chemicals, Pennsylvania, Taylor & Francis, , 736 p. (ISBN 1-56032-270-5).
- (en) Philip E. Ciddor, « Refractive index of air: new equations for the visible and near infrared », Applied Optics, vol. 35, no 9, , p. 1566-1573 (DOI 10.1364/AO.35.001566).
- (en) Claudio A. Faúndez et José O. Valderrama, « Activity Coefficient Models to Describe Vapor-Liquid Equilibrium in Ternary Hydro-Alcoholic Solutions », Chinese Journal of Chemical Engineering, vol. 17, no 2, , p. 259-267 (DOI 10.1016/S1004-9541(08)60203-7).
- Procès-verbaux du Comité international des poids et mesures, 78e session, 1989, p. T1-T21 (et p. T23-T42, version anglaise).
- (en) Irvin Glassman et Richard A. Yetter, Combustion, Elsevier, , 4e éd., 773 p. (ISBN 978-0-12-088573-2), p. 6.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 90e éd., 2804 p. (ISBN 9781420090840, présentation en ligne).
- (en) « Water », sur NIST/WebBook.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- « Conducteurs et isolants électriques », sur Maxicours (consulté le ).
- De combien la pression diminue-t-elle avec l’altitude ?, sur exergie.free.fr.
- « Properties of Water and Steam in SI-Units », 1969, prepared by Ernst Schmidt, Springer, Verlag Berlin Heidelberg New York, R. Oldenburg München.
- Pierre Rapin et Patrick Jacquard, « Aide-mémoire formulaire du froid », 14e éd., Dunod, 2010, p. 9.
- (en) E. So, « Exclusion Zone As Intermediate Between Ice And Water », WIT Transactions on Ecology and the Environment, vol. 153, , p. 3-11 (DOI 10.2495/WS110011).
- (en) Peter D. Spencer, James D. Riches et Elizabeth D. Williams, « Exclusion zone water is associated with material that exhibits proton diffusion but not birefringent properties », Fluid Phase Equilibria, vol. 466, , p. 103-109 (DOI 10.1016/j.fluid.2018.03.020).
- L. W. Tilton et J. K. Taylor, stand national de bureau de recherche de J., 20, 419 (RP1085), 1938.
- E. Dorsey, « Propriétés d’Eau-Substance ordinaire », Reinhold Publishing Corporation, 1940.
- La Recherche, no 451, avril 2011.
- Jean C. Baudet, Histoire de la chimie, De Boeck Supérieur, (ISBN 978-2-8073-0692-9, lire en ligne), p. 113.
- (en) Xing L. Yan et Ryutaro Hino 2, Nuclear Hydrogen Production Handbook, CRC Press (no 6), , 939 p., p. 41.
Voir aussi
modifierBibliographie
modifier- (en) Chang Q. Sun, Yongli Huang, Xi Zhang, Zengsheng Ma et Biao Wang, « The physics behind water irregularity », Physics Reports, vol. 998, , p. 1-68 (DOI 10.1016/j.physrep.2022.11.001 )
- (en) John L. Finney, « The structure of water: A historical perspective », The Journal of Chemical Physics, vol. 160, no 6, , article no 060901 (DOI 10.1063/5.0182665 )
Articles connexes
modifierLiens externes
modifier- (en) Water phase diagrams