Cannabigérol
Le cannabigérol (CBG) est un cannabinoïde naturel, constituant mineur du cannabis. Alors qu'il n'est pas lui-même psychoactif, son précurseur l'acide cannabigérolique peut servir à synthétiser les deux principaux constituants psychoactifs de la plante, le tétrahydrocannabinol (THC) et le cannabidiol (CBD).
| Cannabigerol | ||
| ||
 | ||
| Identification | ||
|---|---|---|
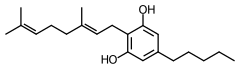
| Nom UICPA | 2-[(2E)-3,7-Diméthylocta-2,6-diényl]-5-pentyl-benzène-1,3-diol | |
| No CAS | ||
| No ECHA | 100.346.098 | |
| PubChem | 5315659[1] | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C21H32O2 [Isomères] |
|
| Masse molaire[2] | 316,477 6 ± 0,019 6 g/mol C 79,7 %, H 10,19 %, O 10,11 %, |
|
| Précautions | ||
| SGH | ||
[1] |
||
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Les effets du cannabigérol sur la santé ne sont pas encore complètement élucidés. Son étude pharmacodynamique est complexe, car il agit avec différentes intensités sur plusieurs récepteurs membranaires. Son comportement dans l'organisme n'est que marginalement lié à son affinité relativement faible pour les récepteurs cannabinoïdes. Il n'est pas certain que ses effets thérapeutiques contrebalancent ses effets indésirables.
Chimie
modifierPropriétés
modifierLe cannabigérol est une molécule constituée d'un noyau résorcine et de deux longues chaînes carbonées[3]. Ces chaînes confèrent à la molécule un caractère très lipophile (et hydrophobe) : son log P (coefficient de partage) est calculé, selon les modèles, entre 7,0 et 7,5[1],[4],[5].
Synthèse
modifierLa biosynthèse du CBG commence par la réaction de condensation d'un groupe hexanoyl porté par une coenzyme A avec trois groupes malonyl-CoA, réaction catalysée par une tétracétide synthase. Le produit de réaction obtenu est ensuite cyclisé en acide olivétolique grâce à une cyclase. L'acide olivétolique subit alors une réaction de type prénylation : l'ajout, catalysé par une enzyme de type prényltransférase aromatique, d'un précurseur isoprénoïde à 10 carbones (le pyrophosphate de géranyle) sur le cycle aromatique, entre les fonctions phénol. L'acide cannabigérolique (CBGA) résultant est ensuite décarboxylé en cannabigérol[6].
De nombreux autres composés cannabinoïdes naturels dans le chanvre sont, comme le cannabigérol, synthétisés à partir de l'acide cannabigérolique[7].
Extraction
modifierLe CBG est extrait du chanvre, comme la plupart des autres cannabinoïdes, par l'usage de solvants (eau, huile, éthanol, propane, diméthyléther, CO2 supercritique...). Cette extraction peut être optimisée par l'usage d'ultra-sons ou de micro-ondes, et rendue plus sélective en jouant finement sur la température[8].
Pharmacologie
modifierContrairement à d'autres substances issues du cannabis, le cannabigérol ne possède aucun effet psychoactif[9],[7],[10],[3]. Il a plutôt été noté comme réduisant les effets psychoactifs du THC[9]. En revanche, il a une action analgésique[10],[11],[12].
Pharmacodynamique
modifierDes études ont révélé que le CBG agit comme un agoniste hautement puissant des récepteurs α2-adrénergiques et modérément comme antagoniste des récepteurs 5HT1A[13].
L'étude pharmacodynamique du CBG s'avère complexe[7],[9],[10]. Il se lie assez faiblement avec les récepteurs cannabinoïdes, où il agit comme agoniste partiel[7],[9],[10],[14]. Inversement, c'est un puissant agoniste des récepteur adrénergiques α2, antagoniste du récepteur de la sérotonine 5-HT1A, et antagoniste du récepteur transitoire du canal ionique TRPM8. Le cannabigérol a également d'autres actions diverses, qui peuvent contribuer à ses effets sur l'organisme[7],[9],[10],[3].
Pharmacocinétique
modifierLa pharmacocinétique du CBG a été étudiée chez l'animal, et dans une moindre mesure chez l'Homme. Le CBG est métabolisé par le foie sous l'action de la protéine CYP2J2, une enzyme qui fait partie du cytochrome P450. Il suit en cela le comportement d'autres cannabinoïdes et endocannabinoïdes[9],[14].
Effets sur le corps
modifierModèle murin
modifierDe nombreux essais pré-cliniques ont étudié les effets du CBG, in vitro ou sur les souris. Ils ont notamment montré que le CBG réduisait la pression intra-oculaire, et avait une action antioxydante, anti-inflammatoire, anti-tumorale, antibactérienne, et antifongique, ainsi que des propriétés anxiolytiques, neuromodulatrices, et neuroprotectives[14],[11]. Une réduction de certains troubles urinaires[15], une augmentation de l'appétit et une inhibition de la testostérone ont également été relevés[16].
Études chez l'humain
modifierDans la mesure où le cannabigérol est bien plus vite éliminé que le THC (il est typiquement indétectable dans le sang en moins d'un quart d'heure et dans la salive en moins de 10 h, là où le THC reste mesurable jusqu'à 30 jours après le dernier joint), il a été proposé comme marqueur plus pertinent d'une consommation récente de cannabis[14].
L'innocuité de sa consommation a été mise en doute en raison de la forte activation des récepteurs adrénergiques par le CBG, qui peut causer un effet sédatif et potentiellement des effet secondaires cardiovasculaires indésirables tels qu'une fréquence cardiaque diminuée ou une hausse de la pression sanguine[7].
Histoire et société
modifierDécouverte
modifierLe cannabigérol a été isolé à partir du cannabis[3] en 1964 par Gaoni et Mechoulam. C'est l'un des plus de 120 cannabinoïdes identifiés dans ce genre[17],[18].
Source et production
modifierSi le CBG a été découvert dans le cannabis, on le retrouve également dans Helichrysum umbraculigerum, où il pourrait même être plus abondant[9].
Au cours de la croissance de cannabis sativa, l'essentiel de l'acide cannabigérolique (CBGA) est converti en d'autres cannabinoïdes, principalement le tétrahydrocannabinol (THC) et le cannabidiol (CBD), ne laissant qu'environ 1 % de CBGA pouvant se convertir directement en CBG résiduel dans la plante[19]. Cette proportion varie cependant avec le profil génétique de la plante, et certaines variétés peuvent conserver de plus grandes quantités de CBG et CBGA, tout en ayant peu de THC et CBD[3]. De telles variétés présentent un intérêt commercial, considérant que la législation de nombreux pays interdit la culture de plants riches en THC.
Une autre approche consiste à sélectionner des micro-organismes appropriés (comme certaines levures) et à les modifier génétiquement pour favoriser la production de CBG[20]. Cette technique permettrait d'obtenir le composé visé sans les contraintes liées à la culture du cannabis.
Statut légal
modifierLe cannabigérol n'étant pas psychoactif, il n'est pas concerné par la convention sur les substances psychotropes de 1971.
En France, il n'est, en 2024, pas inscrit sur la liste des substances classées comme stupéfiantes[21].
En Suisse, il est légal de produire du chanvre riche en CBG en guise de substitut de tabac, du moment que sa concentration en THC reste en dessous de 1,0 %[22].
Aux États-Unis, le CBG issu du cannabis est illégal en raison du Controlled Substances Act, alors que celui issu du chanvre est légal, du moment que ce dernier contient moins de 0,3 % de THC sur poids sec[23],[24].
Notes et références
modifier- (en) PubChem, « Cannabigerol », sur pubchem.ncbi.nlm.nih.gov (consulté le )
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Marjeta Zagožen, Andreja Čerenak et Samo Kreft, « Cannabigerol and cannabichromene in Cannabis sativa L. », Acta Pharmaceutica, vol. 71, no 3, , p. 355–364 (DOI 10.2478/acph-2021-0021, lire en ligne, consulté le )
- (en) « Cannabigerol », sur go.drugbank.com (consulté le )
- « Cannabigerol | C21H32O2 », sur www.chemspider.com (consulté le )
- Paula Morales, Patricia H. Reggio et Nadine Jagerovic, « An Overview on Medicinal Chemistry of Synthetic and Natural Derivatives of Cannabidiol », Frontiers in Pharmacology, vol. 8, , p. 422 (ISSN 1663-9812, PMID 28701957, PMCID 5487438, DOI 10.3389/fphar.2017.00422, lire en ligne, consulté le )
- (en) Rahul Nachnani, Wesley M. Raup-Konsavage et Kent E. Vrana, « The Pharmacological Case for Cannabigerol », Journal of Pharmacology and Experimental Therapeutics, vol. 376, no 2, , p. 204–212 (ISSN 0022-3565 et 1521-0103, PMID 33168643, DOI 10.1124/jpet.120.000340, lire en ligne, consulté le )
- (en) Andrew G. Mtewa, Tadele Mekuriya, Paul E. Alele et John O. Igoli, Cannabis and Khat in Drug Discovery: The Discovery Pipeline and the Endocannabinoid System, Elsevier, (ISBN 978-0-323-95928-5, lire en ligne)
- Fabrizio Calapai, Luigi Cardia, Emanuela Esposito et Ilaria Ammendolia, « Pharmacological Aspects and Biological Effects of Cannabigerol and Its Synthetic Derivatives », Evidence-based Complementary and Alternative Medicine : eCAM, vol. 2022, , p. 3336516 (ISSN 1741-427X, PMID 36397993, PMCID 9666035, DOI 10.1155/2022/3336516, lire en ligne, consulté le )
- Mohammad-Reza Ghovanloo, Sulayman D. Dib-Hajj, Samuel J. Goodchild et Peter C. Ruben, « Non-psychotropic phytocannabinoid interactions with voltage-gated sodium channels: An update on cannabidiol and cannabigerol », Frontiers in Physiology, vol. 13, , p. 1066455 (ISSN 1664-042X, PMID 36439273, PMCID 9691960, DOI 10.3389/fphys.2022.1066455, lire en ligne, consulté le )
- (en) Peter B. Sampson, « Phytocannabinoid Pharmacology: Medicinal Properties of Cannabis sativa Constituents Aside from the “Big Two” », Journal of Natural Products, vol. 84, no 1, , p. 142–160 (ISSN 0163-3864 et 1520-6025, DOI 10.1021/acs.jnatprod.0c00965, lire en ligne, consulté le )
- (en) Fred Evans, « Cannabinoids: The Separation of Central from Peripheral Effects on a Structural Basis », Planta Medica, vol. 57, no S 1, , S60–S67 (ISSN 0032-0943 et 1439-0221, DOI 10.1055/s-2006-960231, lire en ligne, consulté le )
- M. G. Cascio, L. A. Gauson, L. A. Stevenson et R. A. Ross, « Evidence that the plant cannabinoid cannabigerol is a highly potent alpha2-adrenoceptor agonist and moderately potent 5HT1A receptor antagonist », British Journal of Pharmacology, vol. 159, no 1, , p. 129–141 (ISSN 1476-5381, PMID 20002104, PMCID 2823359, DOI 10.1111/j.1476-5381.2009.00515.x, lire en ligne, consulté le )
- (en) Anna Jastrząb, Iwona Jarocka-Karpowicz et Elżbieta Skrzydlewska, « The Origin and Biomedical Relevance of Cannabigerol », International Journal of Molecular Sciences, vol. 23, no 14, , p. 7929 (ISSN 1422-0067, DOI 10.3390/ijms23147929, lire en ligne, consulté le )
- (en) Francesca Borrelli, Ines Fasolino, Barbara Romano et Raffaele Capasso, « Beneficial effect of the non-psychotropic plant cannabinoid cannabigerol on experimental inflammatory bowel disease », Biochemical Pharmacology, vol. 85, no 9, , p. 1306–1316 (ISSN 0006-2952, DOI 10.1016/j.bcp.2013.01.017, lire en ligne, consulté le )
- (en) A. Jakubovic, E. G. McGeer et P. L. McGeer, « Effects of cannabinoids on testosterone and protein synthesis in rat testis leydig cells in vitro », Molecular and Cellular Endocrinology, vol. 15, no 1, , p. 41–50 (ISSN 0303-7207, DOI 10.1016/0303-7207(79)90069-8, lire en ligne, consulté le )
- (en) Mahmoud A. ElSohly, Mohamed M. Radwan, Waseem Gul et Suman Chandra, « Phytochemistry of Cannabis sativa L. », dans Phytocannabinoids: Unraveling the Complex Chemistry and Pharmacology of Cannabis sativa, Springer International Publishing, , 1–36 p. (ISBN 978-3-319-45541-9, DOI 10.1007/978-3-319-45541-9_1, lire en ligne)
- (en) Sarah E. Turner, Claire M. Williams, Leslie Iversen et Benjamin J. Whalley, « Molecular Pharmacology of Phytocannabinoids », dans Phytocannabinoids: Unraveling the Complex Chemistry and Pharmacology of Cannabis sativa, Springer International Publishing, , 61–101 p. (ISBN 978-3-319-45541-9, DOI 10.1007/978-3-319-45541-9_3, lire en ligne)
- (en) Oier Aizpurua-Olaizola, Umut Soydaner, Ekin Öztürk et Daniele Schibano, « Evolution of the Cannabinoid and Terpene Content during the Growth of Cannabis sativa Plants from Different Chemotypes », Journal of Natural Products, vol. 79, no 2, , p. 324–331 (ISSN 0163-3864 et 1520-6025, DOI 10.1021/acs.jnatprod.5b00949, lire en ligne, consulté le )
- Eduardo Perez, Jose R. Fernandez, Corey Fitzgerald et Karl Rouzard, « In Vitro and Clinical Evaluation of Cannabigerol (CBG) Produced via Yeast Biosynthesis: A Cannabinoid with a Broad Range of Anti-Inflammatory and Skin Health-Boosting Properties », Molecules, vol. 27, no 2, , p. 491 (ISSN 1420-3049, PMID 35056807, PMCID 8778347, DOI 10.3390/molecules27020491, lire en ligne, consulté le )
- Arrêté du 22 février 1990 fixant la liste des substances classées comme stupéfiants (lire en ligne)
- « Häufig gestellte Fragen (FAQ) zu Tabakersatzprodukten mit THC-armem Hanf mit CBD »
- (en) Office of the Commissioner, « FDA Regulation of Cannabis and Cannabis-Derived Products, Including Cannabidiol (CBD) », FDA, (lire en ligne, consulté le )
- Code des États-Unis, « USC > Title 21 > Chapter 13 > Subchapter I > Part A > § 802. Definitions: (16)" »
Liens externes
modifier
- Ressources relatives à la santé :


