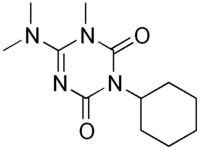
Hexazinone
L'hexazinone est un composé organique, de formule C12H20N4O2, utilisé comme herbicide à large spectre. C'est un solide incolore. Il présente une certaine solubilité dans l'eau, mais est très soluble dans la plupart des solvants organiques, à l'exception des alcanes. Cet herbicide, qui appartient à la classe de la triazine, est fabriqué par DuPont et vendu sous le nom commercial de « Velpar »[6].
| Hexazinone | |||
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 3-cyclohexyl-6-diméthylamino-1-méthyl-1,3,5-triazine-2,4-dione | ||
| Synonymes |
Velpar, Brushkiller, Gridball |
||
| No CAS | |||
| No ECHA | 100.051.869 | ||
| No CE | 257-074-4 | ||
| No RTECS | XY7850000 | ||
| PubChem | 39965 | ||
| ChEBI | 5705 | ||
| SMILES | |||
| InChI | |||
| Apparence | Cristaux incolores (blancs) sans odeur[1] | ||
| Propriétés chimiques | |||
| Formule | C12H20N4O2 [Isomères] |
||
| Masse molaire[2] | 252,312 8 ± 0,012 4 g/mol C 57,12 %, H 7,99 %, N 22,21 %, O 12,68 %, |
||
| pKa | 2,2 à 25 °C[1] | ||
| Propriétés physiques | |||
| T° fusion | 115-117 °C[1],[3] | ||
| Solubilité | en g/kg à 25 °C[1]: * chloroforme 3880 * méthanol 2650 * benzène 940 * diméthylformamide 836 * acétone 792 * toluène 386 * hexane 3 eau 33 g·l à 25 °C[1] |
||
| Masse volumique | 1,25 g·cm-3[1],[3] | ||
| Précautions | |||
| SGH[3],[4] | |||
| H302, H319, H410, P273, P305+P351+P338 et P501 |
|||
| Transport[3],[4] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 1690 mg/kg (rat, oral)[3],[5] 2258 mg/kg (caille, oral)[5] 860 mg/kg (cochon d'Inde, oral)[5] 5278 mg/kg (rat, dermique)[5] 5278 mg/kg (lapin, dermique)[3],[5] 530 mg/kg (rat, i.p.)[5] 2258 mg/kg (caille, i.p.)[5] |
||
| CL50 | > 7480 mg/m3/1H (rat,inhalation)[5] | ||
| LogP | 1,85 (octanol/eau)[5] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Son mode d'action est l'inhibition de la photosynthèse, ce qui en fait un herbicide non sélectif. Il est utilisé pour lutter contre les graminées et contre les plantes à feuilles larges et les plantes ligneuses. Aux États-Unis, son utilisation s'applique pour environ 33 % sur la luzerne, 31 % dans le secteur forestier, 29 % dans les zones industrielles, 4 % sur les parcours et les pâturages et moins de 2 % sur la canne à sucre[7]. Son usage est interdit en France depuis 2007[8].
En 1989, l'hexazinone a été délibérément utilisée dans un acte de vandalisme pour empoisonner le Treaty Oak (en), arbre historique situé à Austin au Texas[9]. Le coupable, Paul Cullen, a reçu neuf ans de prison pour cette ineptie.
L'hexazinone est un polluant omniprésent dans les eaux souterraines, en raison de sa solubilité dans l'eau.
Synthèse
modifierIl y a deux voies de synthèse de l'hexazinone qui ont le même nombre d'étapes, l'une[10] partant du chloroformiate de méthyle réagissant sur le cyanamide :
et l'autre, partant de la méthylthiourée qui réagit sur le bromure ou l'iodure de méthyle :
Notes et références
modifier- PubChem CID 39965
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « 3-Cyclohexyl-6-dimethylamino-1-methyl-1,2,3,4-tetrahydro-1,3,5-triazine-2,4-dione » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28/05/2016 (JavaScript nécessaire)
- Fiche Sigma-Aldrich du composé Hexazinone, consultée le 4/1/2012.
- (en) « Hexazinone », sur ChemIDplus.
- (en) Arnold P. Appleby, Franz Müller, Serge Carpy, « Weed Control », Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a28_165).
- (en) « hexazinone (Velpar) Herbicide Profile 9/88 », sur Pesticide Management Education Program (PMEP), université Cornell.
- « Intrant retiré: VELPAR S », sur e-phy, ministère de l’Agriculture, de l’Agroalimentaire et de la Forêt..
- (en) John Giedraitis, « Treating the Treaty Oak », Proceedings of the Fourth Urban Forestry Conference Saint Louis, Missouri, 15-19 octobre 1989 (consulté le ).
- Ullmann's Agrochemicals, 1re Ed., Viley, 2007, p 819. (ISBN 978-3-527-31604-5), (page 819 sur GoogleBook).
Voir aussi
modifierLiens externes
modifier- (en) Velpar herbicide, DuPont.