Azoture de lithium
composé chimique
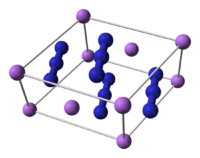
L'azoture de lithium est un composé chimique de formule LiN3. Il se présente comme un solide cristallisé toxique qui se décompose de manière explosive lorsqu'il est chauffé. Très hygroscopique et soluble dans l'eau, il cristallise dans le système monoclinique avec le groupe d'espace C2/m (no 12) et Z = 2[2].
| Azoture de lithium | |||
| |||
| __ Li+ __ N3− Structure cristalline de l'azoture de lithium |
|||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.039.237 | ||
| No CE | 243-177-1 | ||
| PubChem | 88163 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | LiN3 [Isomères] |
||
| Masse molaire[1] | 48,961 ± 0,003 g/mol Li 14,18 %, N 85,82 %, |
||
| Propriétés physiques | |||
| T° fusion | 115 à 298 °C[2] (décomposition) | ||
| Solubilité | soluble dans l'eau[2] | ||
| Masse volumique | 1,84 g·cm-3[2] | ||
| Précautions | |||
| SGH[3] | |||
| H311, P280, P301+P310+P330, P302+P352+P312 et P304+P340+P310 |
|||
| Transport[3] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
L'azoture de lithium peut être obtenu par métathèse en faisant réagir de l'azoture de sodium NaN3 avec du sulfate de lithium Li2SO4[4] :
La réaction fonctionne également avec le nitrate de lithium LiNO3 :
Il peut également être obtenu en faisant réagir de l'azoture de sodium avec du chlorure de lithium LiCl[4] :
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) Jean D'Ans, Ellen Lax, Taschenbuch für Chemiker und Physiker, Springer, 1997, p. 536 sqq. (ISBN 3-540-60035-3)
- Fiche Sigma-Aldrich du composé Lithium azide solution 20 wt. % in H2O, consultée le 1 novembre 2020.
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e édition révisée, vol. I, Ferdinand Enke, Stuttgart 1975, p. 457. (ISBN 3-432-02328-6)

