Atrophie corticale postérieure
L'atrophie corticale postérieure (ACP), également appelée syndrome de Benson[1],[2],[3], est un syndrome apparaissant presque toujours entre 50 et 65 ans, et annonçant dans plus de 90 % des cas une maladie neurodégénérative rare et évoluant vers une maladie d'Alzheimer[4]. Ce syndrome affecte principalement la région arrière du cerveau, connue pour traiter les informations visuelles[5].
C'est une forme de démence parfois considérée comme une variante atypique précoce de la maladie d'Alzheimer[6],[7]. Elle en serait la « variante visuelle » [5]. Elle est en effet caractérisée par un déclin progressif des fonctions visuelles et visuoperceptives ; avec des difficultés croissantes à lire, écrire, compter. Vient ensuite et progressivement une dégradation plus générale des fonctions sensorielles supérieures de base[8]. Contrairement à la forme habituelle de la maladie d'Alzheimer : les patients « jeunes » demeurent longtemps conscients de leurs déficits[4]. En outre, le diagnostic est souvent « porté tardivement, du fait du développement insidieux des symptômes et de leur méconnaissance de la part des ophtalmologistes et des neurologues ».
Le docteur Frank Benson a décrit pour la première fois ce syndrome en 1988[9], mais en 2020, ses causes, primaires notamment, sont encore inconnues ou très incomplètement comprises.
Épidémiologie
modifierL'ACP est un syndrome jugé relativement rare (référencée sur le site Orphanet, www.orpha.net comme maladie orpheline)[10]. Ce symptôme n'est retrouvé que chez environ 5 % des personnes atteintes de Présentation de la maladie d'Alzheimer, et chez 7 % des personnes atteintes de la maladie d'Alzheimer à début précoce[5].
La prévalence précise de l'ACP dans le monde est inconnue, par manque de connaissance du syndrome, par manque d'une définition et d'une terminologie précise et standard de la maladie, et enfin, à la suite de son imbrication dans la maladie d'Alzheimer[11].
Sa faible prévalence fait en outre que presque toutes les études sur l'atrophie corticale postérieure sont basées sur des panels ou échantillons de petite taille. Ces études portent portent de plus sur des points spécifiques de la maladie[5].
Terminologie
modifier- Atrophie corticale postérieure (Benson et al, 1988, Tang-Wai et al 2004)
- Atrophie bipariétale progressive (Mackenzie et al, 1996)
- Dysfonction corticale postérieure (Renner et al, 2004)
- Syndrome de Benson
- Forme visuelle de la Maladie d'Alzheimer (Nestor et al, 2003)
- Forme atypique de la Maladie d'Alzheimer (Galton et al, 2000)
- Apraxie progressive (Ceccaldi et al, 1995)
Classification, définition
modifierL'ACP a longtemps manqué de définition précise, tantôt considéré comme un terme clinique descriptif (syndrome), tantôt comme une étiquette de diagnostic de la maladie. Un consensus est d'abord apparu sur une définition du syndrome clinico-radiologique de base[11].
En 2017, à partir d'une revue détaillée de la littérature, d'une enquête quantitative sur la fréquence des symptômes et la conceptualisation de l'ACP, et à partir des travaux d'un groupe de travail multidisciplinaire international (réuni quatre fois), un cadre de classification à trois niveaux a été proposé pour ce syndrome ACP[11] :
- niveau 1 : principales caractéristiques cliniques, cognitives et en neuroimagerie
et critères d'exclusion du syndrome clinico-radiologique ; - niveau 2 (PCA-pur, PCA-plus) : il établit si, outre le syndrome PCA de base, des caractéristiques d'autre syndrome neurodégénératif sont également présentes ;
- niveau 3 (ACP attribuable à la maladie d'Alzheimer [PCA-AD], à la maladie à corps de Lewy [PCA-LBD], à la dégénérescence corticobasale [PCA-CBD], à la maladie à prions [PCA-prion]) ; ce niveau est celui de la détermination de la cause sous-jacente du syndrome de l'ACP. Elle se fait au moyen de biomarqueurs physiopathologiques disponibles.
Symptômes
modifierL'atrophie corticale postérieure affecte des personnes plus jeunes que ne le fait la maladie d'Alzheimer[11]. Les formes atypiques de la maladie d'Alzheimer dont dites visuelles, langagières ou associées à un dysfonctionnement exécutif, comportemental ou moteur.
L'atrophie corticale postérieure en est la « variante visuelle »[5]. Elle est caractérisée par un déclin progressif des fonctions visuelles, visuoperceptives, de littératie, de praxie, de numératie, et des fonctions sensorielles supérieures de base[8].
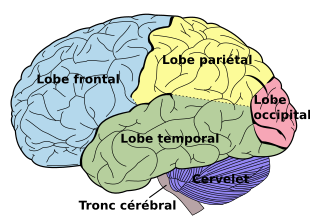
Le premier et principal signe de l'ACP est une altération de la vision : troubles visuo-spatiaux, visuo-cognitives (perturbations des capacités visuo-attentionnelles, visuo-perceptives) car la région postérieure du cerveau abrite le lobe occipital (fig.2), responsable du traitement visuel. L'atrophie est progressive.
Les premiers symptômes, généralement au milieu de la cinquantaine ou au début de la soixantaine, sont visuoperceptuels et inhabituels ; il s'agit d'une difficulté à lire, une vision floue, une sensibilité à la lumière, des problèmes de perception de la profondeur, une difficulté à percevoir ou comprendre plusieurs objets (ou noms) en même temps, et des difficultés de circulation dans l'espace, avec notamment « une diminution de la capacité d'interpréter, de localiser ou d'atteindre des objets sous guidage visuel »[11] ;
Les symptômes s'aggravent ou de nouveaux symptômes apparaissent avec la progression de la neurodégénérescence : apraxie, troubles croissant de la coordination des mouvements, alexie, agnosie visuelle, non reconnaissance d'objets, agraphie, acalculie, indistinction droite gauche, difficultés pour la conduite automobile et le stationnement, difficultés pour lire (et dessiner) une horloge à aiguilles, oublis de la fermeture de tiroirs ou de portes (de communication, four, réfrigérateur voire du domicile...). Plus rarement, on observe des hallucinations visuelles.
La mémoire épisodique et la perspicacité sont initialement relativement préservées[11], mais quand la destruction neuronale s'étend à d'autres régions corticales antérieures, un schéma plus diffus de dysfonctionnement cognitif apparait, avec des symptômes similaires à la maladie d'Alzheimer (perte de mémoire y compris).
L'anxiété et la dépression sont courants chez les patients atteints d'ACP, probablement induites par la prise de conscience des troubles et la difficulté puis l'impossibilité de les contourner.
Diagnostic
modifierEn janvier 2019, les facteurs à l'origine de l'atrophie corticale postérieure sont encore considérés comme inconnus. Et longtemps, il n'y a eu de critères de diagnostic largement acceptés ni partagés dans la communauté médicale (à titre d'exemple, Mendez en 2002 considère que la fluidité verbale est relativement préservée en cas d'ACP[12], mais ce n'est pas l'avis de Tang-Wai[13]).
Cette situation est due à la variété et à la complexité des symptômes, à des plaintes peu spécifiques formulées par les patients, à la relative rareté de cette maladie, à sa sous-reconnaissance, ainsi qu'au manque de biomarqueurs dédiés, et à un manque d'essais cliniques organisés[11], qui causent encore des difficultés persistantes et des retards dans le diagnostic de l'ACP[14],[15],[16],[17].
Au début des années 2000, des groupes de chercheurs ont proposé des critères diagnostiques pour ce syndrome[12],[13].
Divers critères d'inclusion détaillés pour des études individuelles ont aussi été proposés, par par exemple par Renner et al. (2004)[18], McMonagle et al. (2006)[19] et Kas et al.(2011)[20]).
En 2012, la première conférence internationale sur l'ACP[21] s'est tenue à Vancouver, au Canada. La poursuite des études cliniques, des recherches et des tests neuropsychologiques devrait aboutir à l'adoption de critères de diagnostic standardisés.
Diagnostic différentiel
modifierEn 2017, dans leur revue d'étude, Sebastian J. Crutch et al. rappellent que le profil cognitif de la personne victime d'une ACP est marqué par un contraste entre un dysfonctionnement de la partie arrière du cortex cérébral. On sait que les symptômes apparaissent chez des sujets plus jeunes que dans la maladie d'Alzheimer, et on constate aussi une « épargne relative » des autres domaines cognitifs [11].
L’ACP doit donc soigneusement être différentiée de :
- la dépression (les patients ACP sont souvent initialement diagnostiqués à tort comme anxieux ou déprimés. Certains médecins pensent que les patients souffrent de ces maux en raison de la prise de conscience des premiers symptômes, qu'ils tentent souvent de masquer ;
- la Maladie d'Alzheimer typique, qui engendre une amnésie et dégrade la mémoire épisodique. Des critères consensuels pour la maladie d'Alzheimer (typique et atypique) peuvent aider le clinicien et le chercheur[22],[23].
- l'aphasie progressive primaire à variante logopénique, qui est un autre syndrome neurodégénératif affectant, lui, principalement les capacités langagières. Il se manifestes d'abord par une difficulté croissante à trouver les mots dans le discours spontané (phénomène du ‘mot sur le bout de la langue’) en raison d'un blocage de l'accès au lexique mental (perte de mémoire de travail verbale) ; la compréhension est également dégradée pour les mots isolés (atteinte du système sémantique dans les pôles temporaux, souvent avec une latéralisation gauche / hémisphère dominant) et difficulté à répéter des phrases longues.
C'est l'aire de la jonction temporo-pariétale de l’hémisphère dominant qui est ici en cause, dans 60 à 90 % en lien avec une pathologie Alzheimer[24],[25] ; - la démence frontotemporale[11] ;
- le phénotype de la Maladie d'Alzheimer (MA) qui est tantôt appelé « variante frontale AD », « variante comportementale de la MA » ou « MA dysexécutive » (qui se traduit par des altérations des fonctions exécutives, du comportement et de la personnalité)[11].
- Une tumeur ou un cancer du cerveau[11] ;
- un trouble ophtalmologique (les déficiences visuelles précoces d'un patient ACP le conduisent souvent vers une consultation ophtalmologique, où aucune anomalie de l'œil ne sera détectée[26].)
En raison de l'absence de marqueurs biologiques spécifiques, et parce que, dans un premier temps, les personnes atteintes du syndrome de l'ACP peuvent être négatives pour les biomarqueurs physiopathologiques de la Maladie d'Alzheimer, des examens neuropsychologiques sont requis pour l'évaluation.
Une observation attentive du patient présentant les symptômes de l'ACP doit être priorisée, et des questions spécifiques doivent lui être posées[27], l'imagerie cérébrale (non pertinente dans certains cas) venant confirmer le diagnostic.
Pour les tests, des tâches cognitives brèves et détaillées doivent permettre de détecter les spécificités de ce syndrome. Cependant, « des tests précis de la mémoire antérograde, chez les personnes atteintes d’ACP nécessitent des tests qui évitent non seulement les exigences visuelles explicites (par exemple, la copie de la figure de Rey-Osterrieth), mais aussi les exigences visuelles plus implicites sur les processus à médiation visuelle tels que l’imagerie mentale (par exemple, l’apprentissage verbal par paires d’associés)[11] ».
L'imagerie cérébrale[28] participe également au diagnostic de l'ACP. Les images du cerveau des patients ACP sont issue de l'imagerie par résonance magnétique ou d'une scintigraphie PET cérébrale (= tomographie par émission de positons = Pet Scan, qui évalue l'activité de consommation de glucose des diverses zones du cerveau). Ces images sont souvent comparées aux images des patients atteints de la maladie d' Alzheimer (diagnostic différentiel). Les patients atteints par l'ACP étant plus jeunes, les images prises aux premiers stades de l'ACP seront différentes.
Physiopathologie
modifier- En vert : le Flux dorsal (aussi baptisé “Voie du où”) ; cette voie d'information, passant par le lobe pariétal, est associée à la perception spatiale (la perception de l'endroit où se trouve ce que nous regardons) ;
-en violet : le Flux ventral (ou “Voie du quoi”, est une voie d'information qui passe par le lobe temporal. Elle est associée à la reconnaissance des objets, c'est-à-dire à la détermination de la nature de ce que nous regardons1.traverse le lobe temporal.
Les deux flux proviennent du lobe occipital (bleu) situé en arrière.
L'ACP est provoquée par une accumulation anormale de plaques amyloïdes et d'enchevêtrements neurofibrillaires dans le cortex cérébral. Au fil du temps, cette accumulation entraîne une détérioration et un rétrécissement graduel (atrophie) de la partie postérieure du cerveau (fig.1), entraînant la perte progressive et irréversible de certaines fonctions mentales. L'origine de ces plaques est encore mal comprises.
Dérèglements physiologiques
modifierLorsque le « flux ventral » (le «quoi») du système visuel situé dans le lobe temporal (fig.1) est atteint les symptômes seront des déficits généraux de la vision et de la reconnaissance d'objet.
Les atteintes au « flux dorsal » (le «où / comment») situé dans le lobe pariétal (fig.1) entraînent des symptômes tels que des mouvements altérés en réponse à des stimuli visuels et l'apraxie.
Ce sont deux formes distinctes d'ACP, l'une dorsale et l'autre ventrale (fig.3) puis l'évolution s'oriente vers une ACP globale[29],[30].
Au stade précoce, les patients atteints d'ACP présenteront une atrophie cérébrale plus centrale dans le lobe postérieur droit et le gyrus occipital, tandis que les images cérébrales de la maladie d'Alzheimer révèleront une atrophie dans le cortex temporal médian. Cette variation dans les images aide au diagnostic précoce de l'ACP. Au fil des années, les images deviendront plus similaires. La majorité des patients atteints d'ACP déclarent plus tard une maladie d'Alzheimer en raison d'une atrophie cérébrale progressive et continue. L'imagerie cérébrale des patients atteints d'ACP montrent une perte de matière grise dans les cortex temporaux.
L'imagerie morphologique des structures corticales postérieures soulignent l'importance de l'atteinte des cortex visuels primaires et associatifs, cingulaires postérieurs, temporaux postérieurs et pariétaux, en comparaison avec des sujets sains du même âge. Une atteinte plus marquée de l'hémisphère droit est également rapportée.
Liens avec la maladie d'Alzheimer
modifierCertains médecins pensent que l'ACP est une variante de la maladie d'Alzheimer débutant par les déficits visuels.
D'autres optent pour une maladie à part entière, qui finit par dériver vers un Alzheimer[11].
Bien que les régions du cerveau atteintes soient différentes, parfois se chevauchant, elles impliquent dans les deux maladies une dégénérescence progressive des neurones. On observe une perte de neurones et de synapses ainsi que la présence d'enchevêtrements neurofibrillaires et de plaques amyloïdes. Les patients atteints d'ACP présentent davantage de lésions corticales et de pertes de substance grise (corps cellulaire) dans les régions postérieures, en particulier dans les lobes occipital, pariétal et temporal. Les patients atteints de la maladie d'Alzheimer sont davantage lésés dans le cortex préfrontal et l'hippocampe. L'ACP altère la mémoire de travail et la mémoire antérograde, tout en laissant la mémoire épisodique intacte. Les patients atteints de la maladie d'Alzheimer ont plutôt une mémoire épisodique endommagée. Les zones principales et premières de lésion corticale sont différentes selon la maladie. Avec le temps, l'atrophie neuronale des patients atteints d'ACP se propage dans d'autres régions et provoque alors des symptômes communs aux deux maladies.
L'ACP peut également être corrélée aux maladies à corps de Lewy, à la maladie de Creutzfeldt-Jakob, à la dégénérescence cortico-basale (DCB), au syndrome de Balint[31],[32] et au syndrome de Gerstmann.
Causes
modifierLe docteur Frank Benson a décrit pour la première fois ce syndrome en 1988[9] sans pouvoir à l'époque lui trouver de causes précises. Les causes primaires, ou les facteurs de risques de cette maladie sont toujours incertains ou inconnus. Selon l'ONG France Alzheimer et maladies apparentées, « Si cette maladie ne se transmet pas par les gènes, il existe pourtant quelques rares formes où l'hérédité est mise en cause »[4]. « La maladie d’Alzheimer rend compte d’environ 80 % des cas d’ACP », or selon l'Inserme, des causes environnementales à la maladie d'Alzheimer existent (exposition à certains pesticides par exemple)[33].
Impacts sur la qualité de vie, aides possibles
modifierLe diagnostic est presque toujours retardé.
En outre, selon B. Croisile et al. (2012) « en deçà de 60 ans, ces patients sont encore en activité professionnelle et ils n’accèdent pas aux aides financières ni aux structures d’hébergement réservées aux plus de 60 ans. Au titre de la mesure 19 du Plan Alzheimer, un Centre national de référence pour les formes jeunes de MA a été labellisé en mars 2009, il est coordonné par le centre mémoire de ressources et de recherche (CMRR) de Lille-Bailleul, et inclus les deux CMRR de Rouen et Île-de-France Pitié-Salpétrière. Ce centre multisites coordonne les études génétiques, épidémiologiques et médicosociales propres aux sujets atteints d'une MA avant l’âge de 60 ans »[34].
Traitement
modifierEn partenariat avec le médecin généraliste traitant, le patient atteint d'ACP sera suivi par un neurologue.
À ce jour (janvier 2019), aucun traitement pour stopper, inverser, guérir la PCA n'existe. Des médicaments utilisés pour la maladie d'Alzheimer sont parfois proposés aux patients ACP, tels que les inhibiteurs de la cholinestérase, le donépézil, la rivastigmine, la galantamine et la mémantine. Les antidépresseurs ont parfois des effets positifs. En décembre 2019, Samantha Budd Haeberlein, du laboratoire américain Biogen Inc., a présenté les résultats de deux essais de phase III. La molécule appelée aducanumab s'y est révélée efficace, après avoir été testée sur 1 350 patients. D'autres études sur les effets de cette molécule sont toujours en cours (mars 2020)[35].
Les patients peuvent être soulagés par des traitements non médicamenteux tels que des aides psychologiques, de l'ergothérapie, de l'orthophonie, l'assistance d'une équipe sensorielle afin de les aider à s'adapter aux symptômes de l'ACP. Les personnes atteintes de l'ACP et leurs soignants ont des besoins spécifiques, différents de la maladie d'Alzheimer de par les symptômes et leur précocité. Le maintien à domicile, possible jusqu'à certains stades de la maladie, reste éprouvant pour l'entourage. Des groupes de soutien spécialisés peuvent être utiles[36].
Dans le cadre du Plan National Maladies Rares[37] (PNMR), un centre de référence des démences rares[38], localisé à l'hôpital de la Salpêtrière travaille en collaboration avec 12 centres de compétence régionaux pour améliorer la prise en charge des patients et des familles sur toute la France.
Axes de recherches
modifierDes recherches[39] sont en cours sur les mutations des gènes[40] PGRN (progranuline)[41], PSEN1 (préséniline 1)[42], PSEN2, APP. Les mutations dans ces gènes aboutissent à la surproduction des peptides amyloïdes et de protéine tau.
En 2010 a été créé le programme IGAP (International Genomics Alzheimer Project)[43] regroupant 4 grands consortiums de chercheurs. Un autre axe de recherche s'oriente vers l'immunothérapie visant à détruire les agrégats pathologiques de protéines (peptide bêta-amyloïde).
Une équipe de chercheurs américains a publié une étude dans Science Advances du [44] dans laquelle ils pointent la bactérie Porphyromonas gingivalis, responsable de maladies chroniques des gencives. Celle-ci migrerait dans le cerveau et y provoquerait des inflammations cérébrales, des lésions neuronales et donc un déclin cognitif. L'entreprise pharmaceutique Cortexyme, basée à San Francisco, a trouvé les enzymes toxiques, les gingipaines (produites par Porphyromonas gingivalis) dans 96 % des 54 échantillons de cerveaux atteints par la maladie d'Alzheimer. De plus, ils ont trouvé les bactéries elles-mêmes dans trois cerveaux. Les chercheurs ont également trouvé la bactérie dans le liquide céphalo-rachidien de personnes vivantes atteintes de la maladie d'Alzheimer. Un bloqueur de la gingipaïne a été testé sur l'humain. Les participants atteints de la maladie d'Alzheimer ont vu leur état s'améliorer. Les chercheurs poursuivent leurs recherches, notamment en augmentant le nombre d'échantillons testés[45],[46]. En Australie, une équipe de Melbourne, a développé un vaccin contre la bactérie, en test depuis 2018.
Voir aussi
modifierArticles connexes
modifierBibliographie
modifier- Puvilland Lise-Marlène, thèse du 17 octobre 2014, Syndrome de Benson : du diagnostic précoce à la prise en charge, expérience lyonnaise et revue de la littérature[47].
- Oliver Sacks[48] L'œil de l'esprit Paris éditions Points 2014 (ISBN 978-2-7578-3784-9), L'homme qui prenait sa femme pour un chapeau Paris éditions Points, 2014 (ISBN 978-2-7578-4021-4).
- Domas[49] Le syndrome du petit pois éditions Boite À Bulles 2016 (ISBN 978-2-84953-250-8).
- Annie-Claude Nakau et Marie Bernard[50] J'y pense et puis j'oublie éditions Slatkine & Cie 2017 (ISBN 978-2-88944-027-6).
- Bernard Croisile[51] Alzheimer et les maladies apparentées éditions Larousse 2007 (ISBN 978-2-03-582297-0)
- Didier Maillet, Christine Moroni et Catherine Belin, revue Psychologie & neuropsychiatrie du vieillissement[52] Vol 7, No 3, septembre 2009, pages 193-203 (ISSN 1760-1703).
- Reeves Simon, mémoire présenté en vue de l'obtention du grade de maîtrise en psychologie (M.Sc.), Université de Montréal, Département de psychologie, Faculté des Arts et des Sciences, aout 2016[53].
Liens externes
modifier- description maladie sur Orphanet : https://www.orpha.net/consor/www/cgi-bin/OC_Exp.php?lng=FR&Expert=54247
- Article de Didier Maillet, Christine Moroni, Catherine Belin : http://www.jle.com/fr/revues/pnv/e-docs/latrophie_corticale_posterieure_282123/article.phtml
- Laboratoire de recherche sur les traitements : http://www.institut-biotherapies.fr/
- groupe d'aidants et de malades sur facebook (fermé) : https://www.facebook.com/groups/343857153792/
- PDF : Atrophie Corticale Postérieure François SELLAL CMRR de Strasbourg-Colmar Hôpitaux Civils de Colmar : http://lnfp.fr/img/uploads/2017/02/ACP_NPP3fevr_FSellal.pdf
- INSERM communiqué de presse sur Alzheimer : identification d'agrégats de protéines cibles potentielles pour soigner la maladie https://presse.inserm.fr/alzheimer-identification-dagregats-de-proteines-cibles-potentielles-pour-soigner-la-maladie/33410/
Notes et références
modifier- ref ORPHA:54247
- Psychologie & NeuroPsychiatrie du vieillissement vol 7 No 3 sept2009 <<L'atrophie corticale postérieure>> Didier Maillet, Christine Moroni, Catherine Belin UF mémoire et maladie neurodégénérative, Service de neurologie, CHU Avicenne, AP-HP, Bobigny, JE 2497 neuropsychologie et cognition auditive, UFR de psychologie, Université Nord de France, Lille
- (en)« Posterior Cortical Atrophy », UCSF Memory and Aging Center, University of California, San Francisco (consulté le ).
- « Le syndrome de l'atrophie corticale postérieure », sur francealzheimer.org (consulté le ).
- (en) Alexandre Bejanin et Nicolas Villain, « Posterior cortical atrophy: new insights into treatments and biomarkers for Alzheimer's disease », The Lancet Neurology, vol. 23, no 2, , p. 127–128 (DOI 10.1016/S1474-4422(23)00501-X, lire en ligne, consulté le ).
- (en) « Visual variant of Alzheimer's disease - EyeWiki », sur eyewiki.aao.org (consulté le ).
- Nestor PJ, Caine D, Fryer TD, Clarke J, Hodges JR, « The topography of metabolic deficits in posterior cortical atrophy (the visual variant of Alzheimer's disease) with FDG-PET », J Neurol Neurosurg Psychiatry, vol. 74, , p. 1521–1529 (PMCID 1738241, DOI 10.1136/jnnp.74.11.1521, lire en ligne).
- (en) Alexandre Bejanin et Nicolas Villain, « Posterior cortical atrophy: new insights into treatments and biomarkers for Alzheimer's disease », sur The Lancet Neurology, (DOI 10.1016/S1474-4422(23)00501-X, consulté le ), p. 127–128.
- Benson DF, Davis RJ, Snyder BD. Posterior cortical atrophy.Arch Neurol (1988) ; 45 : 789-93.
- « Posterior Cortical Atrophy », Encyclopedia of Neuroscience, Springer Berlin Heidelberg, , p. 3200–3200 (ISBN 978-3-540-23735-8, lire en ligne, consulté le ).
- (en) Sebastian J. Crutch, Jonathan M. Schott, Gil D. Rabinovici et Melissa Murray, « Consensus classification of posterior cortical atrophy », Alzheimer's & Dementia, vol. 13, no 8, , p. 870–884 (ISSN 1552-5260 et 1552-5279, PMID 28259709, PMCID PMC5788455, DOI 10.1016/j.jalz.2017.01.014, lire en ligne, consulté le ).
- Mario F. Mendez, Mehdi Ghajarania et Kent M. Perryman, « Posterior Cortical Atrophy: Clinical Characteristics and Differences Compared to Alzheimer's Disease », Dementia and Geriatric Cognitive Disorders, vol. 14, no 1, , p. 33–40 (ISSN 1420-8008 et 1421-9824, DOI 10.1159/000058331, lire en ligne, consulté le ).
- D. F. Tang-Wai, N. R. Graff-Radford, B. F. Boeve et D. W. Dickson, « Clinical, genetic, and neuropathologic characteristics of posterior cortical atrophy », Neurology, vol. 63, no 7, , p. 1168–1174 (ISSN 0028-3878 et 1526-632X, DOI 10.1212/01.wnl.0000140289.18472.15, lire en ligne, consulté le ).
- MD. Bernard Croisile et Alexis Brice, « Benson's syndrome or Posterior Cortical Atrophy », Orphanet Encyclopedia, (lire en ligne, consulté le ).
- Martin A. Goldstein, Iliyan Ivanov et Michael E. Silverman, « Posterior Cortical Atrophy: An Exemplar for Renovating Diagnostic Formulation in Neurosychiaty », Comprehensive Psychiatry, vol. 52, no 3, , p. 326–333 (DOI 10.1016/j.comppsych.2010.06.013, lire en ligne, consulté le ).
- Möller C, van der Flier WM, Versteeg A, Benedictus MR, Wattjes MP, Koedam EL, Scheltens P, Barkhof F, Vrenken H, « Quantitative Regional Validation of the Visual Rating Scale for Posterior Cortical Atrophy », European Radiology, vol. 24, no 2, , p. 397–404 (PMID 24092044, DOI 10.1007/s00330-013-3025-5, lire en ligne).
- Migliaccio R, Agosta F, Toba MN, Samri D, Corlier F, de Souza LC, Chupin M, Sharman M, Gorno-Tempini ML, Dubois B, Filippi M, Bartolomeo P, « Brain Networks in Posterior Cortical Atrophy: A Single Case Tractography Study and Literature Review », Cortex, vol. 48, no 10, , p. 1298–1309 (PMID 22099855, PMCID 4813795, DOI 10.1016/j.cortex.2011.10.002).
- J. A. Renner, J. M. Burns, C. E. Hou et D. W. McKeel, « Progressive posterior cortical dysfunction », Neurology, vol. 63, no 7, , p. 1175–1180 (ISSN 0028-3878 et 1526-632X, DOI 10.1212/01.wnl.0000140290.80962.bf, lire en ligne, consulté le ).
- Paul McMonagle, Fiona Deering, Yaniv Berliner et Andrew Kertesz, « The cognitive profile of posterior cortical atrophy », Neurology, vol. 66, no 3, , p. 331–338 (ISSN 0028-3878 et 1526-632X, DOI 10.1212/01.wnl.0000196477.78548.db, lire en ligne, consulté le ).
- A. Kas, L. C. de Souza, D. Samri et P. Bartolomeo, « Neural correlates of cognitive impairment in posterior cortical atrophy », Brain, vol. 134, no 5, , p. 1464–1478 (ISSN 0006-8950 et 1460-2156, DOI 10.1093/brain/awr055, lire en ligne, consulté le ).
- (en) « Researchers Join to Draw Posterior Cortical Atrophy Out of Shadows », sur alzforum.org (consulté le ).
- Guy M. McKhann, David S. Knopman, Howard Chertkow et Bradley T. Hyman, « The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging‐Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease », Alzheimer's & Dementia, vol. 7, no 3, , p. 263–269 (ISSN 1552-5260 et 1552-5279, DOI 10.1016/j.jalz.2011.03.005, lire en ligne, consulté le ).
- Bruno Dubois, Howard H Feldman, Claudia Jacova et Harald Hampel, « Advancing research diagnostic criteria for Alzheimer's disease: the IWG-2 criteria », The Lancet Neurology, vol. 13, no 6, , p. 614–629 (ISSN 1474-4422, DOI 10.1016/s1474-4422(14)70090-0, lire en ligne, consulté le ).
- Centre de Référence Démences Rares ou Précoces (2021) Aphasies Primaires Progressives ; Synthèse à destination du médecin traitant ; Extraite du Protocole Nationale de Diagnostic et de Soins (PNDS) ; Décembre 2021, PDF, 5p. url = https://www.has-sante.fr/upload/docs/application/pdf/2022-01/synthese_mg_aphasies_primaires_progressives.pdf
- Carole-Anne Marceau, Joalie Veilleux-Létourneau et Joël Macoir, « La variante logopénique de l’aphasie primaire progressive : état des connaissances et controverses cliniques: », Revue de neuropsychologie, vol. Volume 10, no 4, , p. 279–292 (ISSN 2101-6739, DOI 10.1684/nrp.2018.0477, lire en ligne, consulté le ).
- journal Français d'Ophtalmologie Volume 35, no 4 pages 308-311 (avril 2012)
- Croisile B (2008) Le syndrome de Benson (ou atrophie corticale postérieure) : quelles questions poser aux patients pour repérer ce syndrome rare et méconnu ? Neurologies ; 11 : 424-8.
- Thèse : Querbes, Olivier (2009). Mesure de l'épaisseur corticale en IRM : application au diagnostic précoce individuel de la maladie d'Alzheimer et à la notion de réserve cognitive (http://thesesups.ups-tlse.fr/1597/)
- Goenthals, Maartin; Patrick Santens (20 February 2001). "Posterior cortical atrophy. Two case reports and a review of the literature". Clinical Neurology and Neurosurgery. 103: 115–119. https://www.sciencedirect.com/science/article/pii/S0303846701001147?via%3Dihub.
- name="Borruat 2013">François-Xavier Borruat, « Posterior Cortical Atrophy: Review of the Recent Literature », Neuro-Ophthalmology, vol. 13, , p. 406 (PMID 24136454, DOI 10.1007/s11910-013-0406-8).
- « Syndrome de Balint », sur Futura (consulté le ).
- « Le syndrome de Bálint : la vision désorientée », sur cerveauetpsycho.fr, Pour la Science (consulté le ).
- Graziella Cara, « Publication de l’expertise collective Inserm - « Pesticides et effets sur la santé : Nouvelles données » », sur Salle de presse de l'Inserm, (consulté le ).
- B. Croisile, A. Tedesco, é. Bernard et S. Gavant, « Les pathologies démentielles avant 65ans. Expérience de la file active d’une consultation mémoire neurologique », Revue Neurologique, vol. 168, no 2, , p. 161–169 (DOI 10.1016/j.neurol.2011.09.003, lire en ligne, consulté le ).
- « Alzheimer : enfin un médicament porteur d'espoir ? », Les Échos, (lire en ligne, consulté le ).
- H. Videaud, F. Torny, L. Cartz-Piver et N. Deschamps-Vergara, « Prise en charge non médicamenteuse de l’atrophie corticale postérieure : expérience préliminaire d’un programme psychoéducatif », Revue Neurologique, vol. 168, no 11, , p. 861–867 (ISSN 0035-3787, DOI 10.1016/j.neurol.2011.10.013, lire en ligne, consulté le ).
- Plan National Maladies Rares [PDF].
- Cref-demarres.
- « Thérapie génique », sur institut-biotherapies.fr (consulté le ).
- Centre National de Référence pour les Malades Alzheimer Jeunes (CNRMAJ) Pr Didier Hannequin, neurologue, PU-PH service de Neurologie, coordonnateur du CNRMAJ http://www.alzheimer-genetique.fr/
- PGRN : UF Biochimie des maladies neurométaboliques / Département de Biochimie métabolique / CHU Paris-GH La Pitié Salpêtrière-Charles Foix - Hôpital Pitié-Salpêtrière / Dr Foudil LAMARI sous la direction du Dr Claude Jardel
- « PSEN1 », sur alzheimer-genetique.fr (consulté le ).
- Communiqué de presse de l'INSERM du 01 févr. 2011 https://presse.inserm.fr/lancement-de-la-premiere-collaboration-internationale-sur-la-genetique-de-la-maladie-dalzheimer/13765/
- (en) Stephen S. Dominy1, Casey Lynch1, Florian Ermini..., Porphyromonas gingivalis in Alzheimer's disease brains: Evidence for disease causation and treatment with small-molecule inhibitors, advances.sciencemag.org,
- « Avancée inouïe pour la médecine : l'origine de la maladie d'Alzheimer a peut-être été identifiée... - Handicap Info », sur Handicap Info, (consulté le ).
- Alzheimer : la piste des bactéries buccales se confirme, sciencesetavenir.fr, 30 janvier 2019
- .
- (1933-2015) Neurologue et écrivain britannique, professeur à l'université Columbia. Dans L'œil de l'esprit, Oliver Sacks présente un cas d'atrophie corticale postérieure.
Il aborde également l'ACP dans L'homme qui prenait sa femme pour un chapeau - auteur français de bande dessinée, né le 22 juin 1973. Un récit sur les personnes atteintes de maladies neurodégénératives et sur l'impact de celles-ci sur leur entourage
- L'auteure est elle-même atteinte du syndrome de Benson à 45 ans. Ouvrage rédigé en collaboration avec Marie Bernard
- neurologue et neuropsychologue français, exerçant aux Hospices civils de Lyon
- https://www.jle.com/fr/revues/pnv/sommaire.phtml?cle_parution=3189
- .