alpha-synucléine
L'α-synucléine est une protéine de la famille des synucléines (en) qui est abondante dans le cerveau humain[1]. On en trouve aussi de petites quantités dans le cœur, les muscles et d'autres tissus[1]. Dans le cerveau, l'α-synucléine se trouve essentiellement à l'extrémité des cellules nerveuses (neurones) dans des structures spécialisées appelées terminaisons présynaptiques[1].
| Alpha-synucléine | ||
| ||
| Caractéristiques générales | ||
|---|---|---|
| Homo sapiens | ||
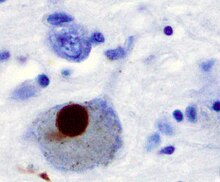
Alpha-synucléine et maladie de Parkinson
modifierIl a été démontré que l'α-synucléine interagit avec la protéine tau[2],[3].
La pathogénèse de la maladie de Parkinson (PD) pourrait être due à la transmission de cellule à cellule de fibrilles préformées (PFF) mal repliées d'α-synucléine (α-syn), mais le mécanisme expliquant comment les fibrilles α-syn se propage d'un neurone à l'autre est en 2016 encore inconnu[4]. Il a été montré en 2016 qu'un gène d'activation des lymphocytes-3 (LAG3) se lie à α-syn PFF avec une haute affinité (constante de dissociation = 77 nanomolaires), alors que le monomère α-syn présente une liaison minimale. La liaison de l'α-Syn-biotine mal repliée à la protéine LAG3 induit l'endocytose de α-syn PFF, permet une transmission interneurone et présente une toxicité neuronale[4].
In vivo, le manque de LAG3 retarde significativement la perte des neurones dopaminergiques induite par les fibrilles d'α-syn, ainsi que certains déficits biochimiques et comportementaux[4].
L'identification des LAG3 comme un récepteur d' α-syn PFF fournit une cible nouvelle pour le développement de thérapies visant à ralentir la progression de la MP (maladie de Parkinson) et d'autres formes connexes d'α-synucléinopathies[4].
Signification clinique
modifierLes agrégats d'α-synucléine forment des fibrilles insolubles que l'on retrouve dans les corps de Lewy caractéristiques de certaines pathologies telles que la maladie de Parkinson[5], la démence à corps de Lewy et l'atrophie multisystématisée[6],[7].
Ces troubles sont connus sous le nom de synucléinopathies.
Cibles thérapeutiques
modifierPlusieurs anticorps monoclonaux contre l'α-synucléine ont été développé mais l'efficacité est décevante comme traitement de la maladie de Parkinson[8].
Notes et références
modifier- « Genetics Home Reference: SNCA », U.S. National Library of Medicine, (consulté le )
- Jensen, PH; Hager H, Nielsen MS, Hojrup P, J Gliemann, Jakes R (septembre 1999 ). « Alpha-synucléine se lie à tau et stimule la protéine kinase A catalysée phosphorylation de tau de résidus sérine 262 et 356 ». J. Biol. Chem (ÉTATS-UNIS)
- BI Giasson, Lee VM, Trojanowski JQ (2003). « Interactions des protéines amyloïdogéniques » Neuromolecular Med.
- Mao X & al. (2016) « Pathological α-synuclein transmission initiated by binding lymphocyte-activation gene 3 » Science ; 30 septembre 2016 ; Vol. 353, n°6307, DOI: 10.1126/science.aah3374 (résumé)
- Communiqué de presse CNRS, « Deux formes différentes de Parkinson caractérisées », .
- Spillantini MG, Schmidt ML, Lee VM, Trojanowski JQ, Jakes R, Goedert M, « Alpha-synuclein in Lewy bodies. », Nature, vol. 388, no 6645, , p. 839–40 (PMID 9278044, DOI 10.1038/42166, lire en ligne)
- Mezey E, Dehejia A, Harta G, Papp MI, Polymeropoulos MH, Brownstein MJ, « Alpha synuclein in neurodegenerative disorders: murderer or accomplice? », Nat Med, vol. 4, no 7, , p. 755–7 (PMID 9662355, DOI 10.1038/nm0798-755, lire en ligne)
- Whone A, Monoclonal antibody therapy in Parkinson’s disease — The end?, N Engl J Med, 2022;387:466-467