Acétate de 3-méthylbutyle
L'acétate de 3-méthylbutyle, plus connu sous le nom d'acétate d'isoamyle, ou acétate d'isopentyle, est un ester, l'un des six isomères de l'acétate d'amyle. C'est un composé organique formé à partir d'alcool isoamylique et d'acide acétique. C'est un liquide incolore, qui est peu soluble dans l'eau mais beaucoup plus dans les solvants organiques. L’acétate d'isoamyle a une odeur forte (similaire à celles des jus de fruits) qui est également décrite comme semblable à l’arôme de banane ou de poire. L'huile de banane est un terme qui désigne souvent l'acétate d'isoamyle pur.
| Acétate d'isoamyle | |||

| |||
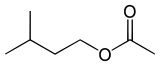 | |||
| Formule topologique de l'acétate d'isoamyle | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | acétate de 3-méthylbutyle | ||
| Nom systématique | éthanoate de 3-méthylbutyle | ||
| Synonymes |
acétate d'isoamyle |
||
| No ECHA | 100.004.240 | ||
| No CE | 204-662-3 | ||
| FEMA | 2055 | ||
| InChI | |||
| Apparence | liquide incolore, d'odeur caractéristique[1]. | ||
| Propriétés chimiques | |||
| Formule | C7H14O2 [Isomères] |
||
| Masse molaire[3] | 130,184 9 ± 0,007 2 g/mol C 64,58 %, H 10,84 %, O 24,58 %, |
||
| Moment dipolaire | 1,86 D[2] | ||
| Propriétés physiques | |||
| T° fusion | −79 °C[1] | ||
| T° ébullition | 142 °C[1] | ||
| Solubilité | dans l'eau à 20 °C : 2 g l−1[1] | ||
| Paramètre de solubilité δ | 16,6 J1/2 cm−3/2 (≤20 °C)[2] | ||
| Masse volumique | 0,87 g cm−3[1]
|
||
| T° d'auto-inflammation | 360 °C[1] | ||
| Point d’éclair | 25 °C (coupelle fermée)[1] | ||
| Limites d’explosivité dans l’air | 1,0 %vol (à 100 °C) -7,5[1] | ||
| Pression de vapeur saturante | à 20 °C : 0,53 kPa[1] | ||
| Viscosité dynamique | 0,888 mPa s à 20 °C[4]
|
||
| Thermochimie | |||
| Cp | |||
| Propriétés optiques | |||
| Indice de réfraction | : 1,3981[2] | ||
| Précautions | |||
| SGH[6] | |||
| H226 et EUH066 |
|||
| SIMDUT[7] | |||
 B2, |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Inhalation | vapeur irritante | ||
| Écotoxicologie | |||
| LogP | 2,13[1] | ||
| Seuil de l’odorat | bas : 0,003 4 ppm haut : 209 ppm[8] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Description
modifierL'acétate d'isoamyle est un ester de l’acide acétique et de l'alcool isoamylique se présentant sous la forme d'un liquide transparent incolore, à l'odeur de banane ou encore de bonbon « arlequin ». Il est présent dans les pommes mûres. Il est utilisé dans la fabrication de peintures, ou comme agent de saveur. C'est aussi la phéromone d'alarme de l'abeille.
Synthèse
modifier- L’acétate d'isoamyle est issu de la réaction catalysée d’un acide (estérification de Fischer) entre l'alcool isoamylique et l'acide acétique glacial comme indiqué dans l'équation de réaction ci-dessous. Typiquement, l'acide sulfurique est utilisé comme catalyseur. Alternativement, une résine échangeuse d'ions acide, ou l'acide para toluènesulfonique peut être utilisée comme catalyseur.
- La réaction est équilibrée, lente et athermique.
- Il peut être aussi synthétisé avec le chlorure d'éthanoyle (estérification à partir de dérivés d'acides carboxyliques On peut aussi utiliser l'anhydride acétique) :
Par contre, ici, la réaction est totale, rapide et exothermique.
Production par la levure
modifierDans la fermentation alcoolique d'un moût rosé ou lors de la macération carbonique, il est possible d'obtenir une production naturelle d'acétate d'isoamyle qui participe aux caractéristiques de fraîcheur aromatique des vins ainsi obtenus : leurs arômes sont alors dits fermentaires. Les arômes perçus peuvent être la banane, la fraise ou la framboise.
Propriétés physiques
modifier- Densité de vapeur (air=1) : 4,49
- Concentration à saturation : 5 000 ppm
- Coefficient de partage (eau/huile) : 0,0054
- Limite de détection olfactive : 0,025 ppm
- Facteur de conversion (ppm → mg/m3) : 5,325
- Taux d'évaporation (éther=1) : 12,2
Applications
modifierL’acétate d'isoamyle est utilisé pour conférer un arôme de bananes aux aliments. L’huile de poire se rapporte généralement à une solution d'acétate d'isoamyle dans de l'éthanol que l'on utilise comme un arôme artificiel. Il est également utilisé en tant que solvant pour des vernis et laques de nitrocellulose. En raison de son agréable odeur et de sa faible toxicité, l'acétate d'isoamyle est aussi utilisé pour tester l'efficacité des respirateurs ou des masques à gaz.
Toxicité
modifierIl n'existe que peu de documents sur les effets des acétates de pentyle chez l’homme[9]. Ce sont principalement des produits irritants pour les yeux et les voies respiratoires. Pas de données disponibles chez l’homme pour les effets génotoxiques, cancérogènes ou reprotoxiques.
Toxicologie professionnelle
modifierDes mesures de prévention[9] sont préconisées pour le stockage et la manipulation. À l'embauche, les atteintes oculaires ou broncho-pulmonaires chroniques seront identifiées. L'examen clinique pourra être complété par une épreuve fonctionnelle respiratoire de base en vue d'une comparaison avec les examens réalisés par la suite. Les porteurs de lentilles de contact utiliseront des verres correcteurs lors de travaux qui pourraient les exposer à des vapeurs ou des aérosols d'acides.
Références
modifier- ACETATE D'ISOAMYLE, Fiches internationales de sécurité chimique
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Hiannie Djojoputro et Suryadi Ismadji, « Density and Viscosity Correlation for Several Common Fragrance and Flavor Esters », Journal of Chemical & Engineering Data, vol. 50, no 2, , p. 727-731 (DOI 10.1021/je050001c)
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 2, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-858-6)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008)
- « Acétate d'isoamyle » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Isoamyl acetate », sur hazmap.nlm.nih.gov (consulté le )
- « Acétates de pentyle : Fiche toxicologique n° 175 », INRS, .
Voir aussi
modifierBibliographie
modifier- Peter Atkins, Le Parfum de la fraise, 2005, Éditions Dunod (ISBN 978-2-10-007596-6)








