Étherlipide
Un étherlipide[1], parfois appelé alcoxyglycéride[2], est un glycéride dans lequel une fonction alcool du glycérol, généralement l'hydroxyle du carbone en position 1, est combinée à un alcool gras par une liaison éther, contrairement aux lipides usuels, dans lesquels les groupes hydroxyle du glycérol sont combinés à un acide gras par une liaison ester.





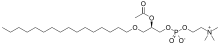
Les plasmalogènes sont des étherlipides caractérisés par au moins une liaison vinyle éther –CH=CH–O– sur le carbone 1 du glycérol.
Le facteur d'activation plaquettaire est un étherlipide caractérisé par un groupe acétyle en position 2 du glycérol.
La formation de la liaison éther chez les mammifères nécessite deux enzymes, la dihydroxyacétonephosphate acyltransférase (DHAPAT) et l'alkyldihydroxyacétonephosphate synthase (ADAPS), qui se trouvent dans les peroxysomes[3]. C'est la raison pour laquelle un dysfonctionnement des peroxysomes conduit souvent à une production insuffisante d'étherlipides.
Fonctions biologiques
modifierLes plasmalogènes et certains 1-O-alkyl-lipides sont des éléments ubiquitaires et parfois essentiels des membranes cellulaires chez les mammifères et les bactéries aérobies[4]. Par ailleurs, les étherlipides sont les principaux lipides polaires des membranes plasmiques des archées, et l'abondance des étherlipides dans leur membrane est l'un des traits distinctifs qui différencie les archées des bactéries parmi les procaryotes ; certaines archées possèdent par exemple des diphytanylglycérolipides (archéol) qui s'organisent en bicouche lipidique ou, chez les thermophiles, des tétraéthers macrocycliques bipolaires (caldarchéol, crénarchéol)[5] formant de longues molécules traversantes qui s'organisent en « monocouches » lipidiques, thermiquement plus stables que les bicouches.
Des différences dans le catabolisme des étherglycérophospholipides par phospholipases spécifiques pourraient être à l'origine du système de seconds messagers tels que les prostaglandines et l'acide arachidonique, qui sont d'importants messagers de signalisation cellulaire[6]. Les étherlipides peuvent également agir directement dans le cadre d'une signalisation lipidique, ce qui est par exemple le cas du facteur d'activation plaquettaire, qui intervient sur le fonctionnement des leucocytes dans le système immunitaire des mammifères[7].
Les plasmalogènes auraient également une fonction antioxydante due à leur double liaison énol, cible de nombreuses dérivés réactifs de l'oxygène. Leur présence s'est en effet révélée bénéfique contre le stress oxydant sur des cellules cultivées, et ces étherlipides pourraient de ce fait jouer un rôle dans le métabolisme des lipoprotéines dans le sérum sanguin[8].
Notes et références
modifier- Faculté de Médecine Pierre et Marie Curie « Partie II - Les lipides — Chapitre 10 - Lipides complexes — 10.17 - Etherlipide ».
- Dictionnaire de l'Académie de Médecine « alcoxyglycéride ».
- (en) Amiya K. Hajra, « Glycerolipid biosynthesis in peroxisomes (microbodies) », Progress in Lipid Research, vol. 34, no 4, , p. 343-364 (lire en ligne) DOI 10.1016/0163-7827(95)00013-5
- (en) Fritz Paltauf, « Ether lipids in biomembranes », Chemistry and Physics of Lipids, vol. 74, no 2, , p. 101-139 (lire en ligne) DOI 10.1016/0009-3084(94)90054-X
- (en) Yosuke KOGA, Hiroyuki MORII, « Recent Advances in Structural Research on Ether Lipids from Archaea Including Comparative and Physiological Aspects », Bioscience, Biotechnology, and Biochemistry, vol. 69, no 11, , p. 2019-2034 (lire en ligne) DOI 10.1271/bbb.69.2019
- (en) Arthur A. Spector et Mark A. Yorek, « Membrane lipid composition and cellular function », The Journal of Lipid Research, vol. 26, no 9, , p. 1015-1035 (lire en ligne)
- (en) C. A. Demopoulos, R. N. Pinckard et D. J. Hanahan, « Platelet-activating factor. Evidence for 1-O-alkyl-2-acetyl-sn-glyceryl-3-phosphorylcholine as the active component (a new class of lipid chemical mediators). », The Journal of Biological Chemistry, vol. 254, no 19, , p. 9355-9358 (lire en ligne)
- (en) Thorolf Brosche et Dieter Platt, « The biological significance of plasmalogens in defense against oxidative damage », Experimental Gerontology, vol. 33, no 5, , p. 363–369 (lire en ligne) DOI 10.1016/S0531-5565(98)00014-X