Utilisateur:Tulipe12/Brouillon
- → N'hésitez pas à publier sur le brouillon un texte inachevé et à le modifier autant que vous le souhaitez.
- → Pour enregistrer vos modifications au brouillon, il est nécessaire de cliquer sur le bouton bleu : « Publier les modifications ». Il n'y a pas d'enregistrement automatique.
Si votre but est de publier un nouvel article, votre brouillon doit respecter les points suivants :
- Respectez le droit d'auteur en créant un texte spécialement pour Wikipédia en français (pas de copier-coller venu d'ailleurs).
- Indiquez les éléments démontrant la notoriété du sujet (aide).
- Liez chaque fait présenté à une source de qualité (quelles sources – comment les insérer).
- Utilisez un ton neutre, qui ne soit ni orienté ni publicitaire (aide).
- Veillez également à structurer votre article, de manière à ce qu'il soit conforme aux autres pages de l'encyclopédie (structurer – mettre en page).
- → Si ces points sont respectés, pour transformer votre brouillon en article, utilisez le bouton « publier le brouillon » en haut à droite. Votre brouillon sera alors transféré dans l'espace encyclopédique.
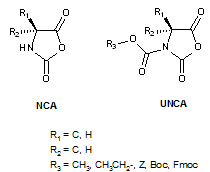
N-Carboxyanhydrides (NCAs) et N-uréthane-carboxyanhydrides (UNCAs)
Les N-Carboxyanhydrides d’α-aminoacides, connus également sous le nom d’anhydrides de Leuchs (ou 2,5-dioxo-1,3-oxazolidines) sont une classe de composés chimiques préparés à partir des acides aminés naturels ou synthétiques. Du fait de leur réactivité, ils sont en particulier utilisés comme unités de base activées ou activées et protégées, pour créer des liaisons peptidiques dans la préparation de polymères à base d’acides aminés ou la préparation de peptides[1]
Parmi les dérivés NCAs, la préparation des N-uréthane-carboxyanhydrides d’α-aminoacides (UNCAs) (N-Carboxyanhydrides N-protégés) a permis d’offrir une forme d’acides aminés activés et protégée, utilisable en synthèse peptidique ou dans des réactions de couplage.[2]
Les NCAs
modifierHistorique
modifierEn 1906, alors qu’il travaille au sein du groupe de Recherche d’Emil Fischer sur les synthèses peptidiques, le chimiste Allemand Hermann Leuchs, découvre, par hasard, les N-carboxyanhydrides, en voulant purifier des chlorures de N-ethoxycarbonyl ou de N-methoxycarbonyl d’aminoacides par distillation. Il est le premier à décrire, dans les années 1906-1908[3],[4] les synthèses et les propriétés des N-carboxyanhydrides d’α-aminoacides (NCAs), désormais connus sous le nom d’anhydrides de Leuchs.
En 1908, Leuchs et W. Geiger découvrent qu’un dérivé de NCA peut se polymériser par chauffage.[5]
En 1922, F. Fuchs synthétise un NCA par action du phosgène sur un aminoacide. Les travaux de Fuchs sont ensuite repris en 1950 par A. C. Farthing qui utilise également du phosgène pour préparer des NCAs.
Dans les années 1920, de nombreuses études sur la synthèse et la polymérisation de NCAs ont été développées. Aujourd’hui, la polymérisation des NCAs est devenue la technique la plus couramment utilisée pour les synthèses à grande échelle de polypeptides de haut poids moléculaire et de copolymères.1
Voies de synthèse
modifierIl existe différentes voies de synthèse des NCAs. Elles comprennent une à deux étapes chimiques et sont réalisées à partir de l'acide aminé. La synthèse de Leuchs et la synthèse de Fuchs-Farthing[6],[7] ont été les deux premières méthodes revendiquées et restent aujourd'hui les approches les plus intéressantes et générales pour la synthèse des NCAs à partir de leurs acides aminés. Une méthode récente, comportant davantage d’étapes consiste en la nitrosation du N-carbamoyle α-aminoacide et conduit au NCA via la cyclisation d'un intermédiaire isocyanate.[8],[9]
Méthode de Leuchs : Synthèse des NCAs par action de chlorure de thionyle :
Méthode de Fuchs-Farthing : Synthèse des NCAs par action directe de phosgène sur l’acide aminé :
Des voies de synthèse des NCAs, dérivées de la méthode de Fuchs-Farthing ont été décrites à partir de diphosgène[10] ou de triphosgène.[11] Plus récemment des procédés améliorés visant à produire à échelle industrielle des NCAs de très haute pureté ont été brevetés.[12],[13]
Des exemples récents montrent l'utilisation de diphényl carbonates[14] ou de di-terbutyl-tricarbonate[15] comme alternatives à l'utilisation du phosgène pour la synthèse des NCAs. Une méthode originale 7 faisant intervenir un composé N-[N’-nitroso-(R’)carbamoyl]aminoacide, a été brevetée.[16]
Propriétés des NCAs
modifierRing Opening Polymerization (ROP) des NCAs
Les poly α-aminoacides sont synthétisés via des réactions de polymérisation avec élimination de CO2 selon le mécanisme de Ring Opening Polymerization : [17],[18]
Le mécanisme de ROP est une méthode rapide[19] et efficace pour la synthèse des polypeptides. La polymérisation par ouverture de cycle des NCAs peut être initiée par différents initiateurs. Traditionnellement, les gammes d’initiateurs les plus importants pour la polymérisation des NCAs par ROP sont les composés nucléophiles, les bases comme les amines tertiaires, les ions hydroxyles et les alcoolates. Plus récemment, avec les différentes recherches effectuées dans ce domaine, de nouveaux initiateurs ont été mis au point, tels que des complexes métalliques de type acides de Lewis[20]
Deux types de mécanismes principaux de polymérisation des NCAs sont décrits :
Autres réactions des NCAs
modifier- Réaction avec des acides[23]
- Réaction avec des alcools en milieu acide[24]
- Réaction avec des magnésiens pour conduire à des amino-alcools
- Réaction avec des nucléophiles :
- N-acylation : synthèse des UNCAs1
- N-alkylation [27]
* Synthèse des UNCAs * Synthèse des N-Acyl NCAs [28]
Applications
modifier- La Copaxone® (Glatiramère acétate)[29], commercialisé par TEVA Pharmaceutical, pour le traitement de la Sclérose en plaques est un co-polymère (M = 23000) de plusieurs NCAs : H-Ala-NCA / H-Lys(TFA)-NCA / H-Glu(OBzl)-NCA / H-Tyr-NCA.
- Invirase® (Saquinavir) et Viracept® (Nelfinavir) commercialisés par Roche Pharma, pour le traitement du VIH[30] font intervenir le (S)- N-tert-butyl-1,2,3,4-tetrahydroisoquinoline-3-carboxyamide dans leurs synthèses.
- Les polymères à base de NCAs ont de nombreuses applications notamment de matériaux dans différents domaines :
- biomédical[31], « drug delivery » [32]
- optique, éléctronique : Langmuir−Blodgett film
- matériaux : oléogel, organogel, hydrogel, encapsulation…[33]
- DGL dendrimères…[34]: vectorisation in vivo de principes actifs.
Les UNCAs
modifierVoies de synthèse
modifierLes synthèses des UNCAs ont été étudiées au cours des travaux de R.H. Kricheldorf[35], puis de D.W. Fuller[36],[37] Les UNCAs font maintenant l'objet de développement depuis environ 20 ans. Ils offrent, en effet, une nouvelle alternative aux méthodes traditionnelles de couplage des acides aminés notamment grâce aux diverses formes d’activation de la fonction acide de l’acide aminé. Grâce à leur groupement N-protecteur de type tertiobutyloxycarbonyle (Boc), benzyloxycarbonyle (CBZ) ou fluorénylméthyloxycarbonyle (Fmoc), les UNCAs ont la capacité de réagir avec les nucléophiles de type amine d’acide aminé sans réaction de polymérisation concurrente constatée avec les NCAs.[38]
La synthèse des UNCAs est généralement réalisée par réaction du NCA avec un agent alkoxycarbonylé tel qu’un chloroformiate ou analogue, en présence d'une base organique appropriée[39] :
Propriétés
modifierSynthèse peptidique
La forme activée de l’acide en carboxyanhydride permet l’attaque d’un nucléophile sur cette fonction, tandis que la protection de l’amine sous forme d’uréthane confère à la structure une stabilité vis-à-vis de la polymérisation.
Avantages de la synthèse peptidique via des UNCAs :
- Couplage "doux avec les “Nuˉ”, les acides aminés, les amino-esters
- Pas de couplage dangereux avec des agents comme DCC, HOBT
- Le dioxyde de carbone est le seul sous produit (pas de DCU,…)
Différents types de réactions possibles à partir des UNCAs[40],[41], [42],[43],[44],[45],[46],[47],[48],[49],[50],[51]
Notes et références
modifier- Angew Chem Int Ed, 2006 (45), 5752-5784
- D.Fuller et al., Biopolymers (Peptide Science), 1996 (40), 183-205.
- H. Leuchs ,Ber. Dtsch. Chem. Ges. 1906 (39), 857-861.
- H.Leuchs, Ber. Dtsch. Chem. Ges., 1907 (40), 3235-3240.
- W. Geiger, Ber. Dtsch. Chem. Ges., 1908 (41), 1721-1726.
- P. L.Fuchs, Chem. Ber, 1922 (55), 2943.
- A.C. Farthing, A. C. J. Chem. Soc., 1950, 1317.
- H.Collet et al., Tetrahedron Letters, 2002, 1026–1032.
- A.C.Farthing, A. C. J. Chem. Soc., 1996 (37), 9043-9046.
- T.Ryoichi et al., J. Org. Chem. 1985 (50), 715-716.
- W.H. Daly et al., Tet. Lett., 1988 (46), 5859-5862.
- Isochem Patents : EP1201659, EP1201659, EP1415991
- Natco Pharma patent, WO2009027998
- Ukihiro Fujita, Takeshi Endo, Urao Nishida, Atsushi Sodo : US 2007/0015932.
- Hiroto Kudo, Takeshi Endoh, US Patent appl. 2002/0188095.
- Patent : WO 96/12729 by Commeyras A. et al., EP1201659, EP1201659, EP1415991.
- C.H. Bamfold, H. Block, J. Chem. Soc., 1961, 4989.
- C.H. Bamfold, H.Block, J. Chem. Soc., 1961, 4992.
- Takeshi Honda et al., Lab Chip, 2005 (5), 812–818.
- Jianjun Cheng, Timothy J.Deming, «Synthesis of Polypeptides by Ring-Opening Polymerization of α-Amino Acid N-Carboxyanhydrides”, Top. Curr. Chem., 2011, 173.
- Jianjun Cheng, Timothy J. Deming, «Synthesis of Polypeptides by Ring-Opening Polymerization of α-Amino Acid N-Carboxyanhydrides”, Springer-Verlag Berlin Heidelberg, 2011.
- Han JinDong et al., "The synthesis, deprotection and properties of poly(γ-benzyl-L-glutamate, Science Chine Chemistry, 2012.
- Organic Process Research & Development, 2005 (9), 757-763.
- Brevet Mitsui US 2002/0173664A1.
- Kenneth D. Kopple, J. Am. Chem. Soc., 1957 (3), 662-664.
- J.-A. Fehrentz et al., J. of Peptide Science, 1995 (1), 124-131.
- J. B. Halstrom et al.,Brevet US 4,267344 1981, Proteinkemisk Institut.
- L.C. Xavier et al.,Organic Syntheses, 1996 (74), 50-71.
- R. Kricheldorf, Angew. Chem. Int. Ed., 2006 (45) 5752-5784.
- Bellini et al, Brevet US 6,340,760 B1, 2002, Clariant LSM Italia S.p.A.
- T. J. Deming, Progress in Polymer Science, 2007 (23), 858-875.
- Ling-Ling Wang and al., Chinese Journal of Polymer Science, 2008 (26), 381-391.
- Gijs J.M. Habraken et al., Macromol. Rapid Commun., 2012 (33), 272-286.
- Laurent Boiteau,« Dendrimères greffés de lysine (DGL) : de l’arborescence « low-cost » aux bio-matériaux innovants»
- R.H.Kricheldorf, Makromol. Chem., 1977 (178),905.
- D.W.Fuller and al., US 5028693 (Priority 1989).
- J. Am. Chem. Soc 1990 (112), 7414.
- Gijs J. M. Habraken and al.,Polym. Chem., 2010 (1), 514-524.
- Fehrentz et al., Tetrahedron Lett., 1994 (35), 9031-9034.
- Schéma issu de la brochure de Senn Chemicals
- 2
- Martinez J. et al., : J. Lett. Peptide Sci. 1995 (2), 29.
- Martinez J. et al., : Tetrahedron Lett. 1994 (35), 569.
- Martinez J. et al. : Tetrahedron Lett. 1994 (35), 903.
- Martinez J. and al., : Tetrahedron Lett. 1994 (35), 1557.
- Martinez J. et al., : Peptide Sci. 1995 (1), 124.
- Martinez J. et al., : Tetrahedron Lett. 1996 (37), 8489.
- Leban JJ., Colson K.L. : J. Org. Chem. 1996 (61), 228.
- Martinez J. et al., : Tetrahedron Lett. 1996 (37), 1027.
- Martinez J. et al., : J. Lett. Peptide Sci. 1997 (4), 241.
- Audin, P., Pothion C., Fehrentz J-A., Paris J. : Fourth Forum on Peptides and Proteins, Montpellier, France.