Trichlorure de gallium
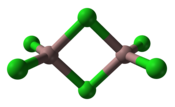
Le trichlorure de gallium est un composé chimique de formule GaCl3. Il s'agit d'un solide incolore et soluble dans pratiquement tous les solvants, y compris les alcanes, ce qui est inhabituel pour un halogénure de métal. C'est le précurseur principal de la plupart des composés du gallium et un réactif en synthèse organique[4]. Comme les autres halogénures de métaux du groupe III, il forme des dimères Ga2Cl6 dans lesquels deux atomes de chlore sont pontants et quatre sont terminaux. À l'état solide, des dimères s'arrangent de manière analogue à celle du bromure d'aluminium AlBr3 en formant des tétraèdres qui partagent leurs arêtes pour former une structure cristalline monoclinique du groupe d'espace C2/m (no 12) avec les paramètres a = 1 194,8 pm, b = 685,5 pm, c = 705,0 pm, β = 125,69°[5]. Ceci contraste avec le chlorure d'aluminium AlCl3, à la structure en feuillets[6]. Il est fortement hygroscopique[7] et réagit violemment avec l'eau. L'évaporation d'une solution aqueuse libère du chlorure d'hydrogène HCl.
| Trichlorure de gallium | |||
| |||
| __ Ga __ Cl Molécule de trichlorure de gallium |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | trichlorogallane | ||
| Nom systématique | chlorure de gallium(III) | ||
| Synonymes |
trichlorure de gallium |
||
| No CAS | |||
| No ECHA | 100.033.268 | ||
| No CE | 236-610-0 | ||
| No RTECS | LW9100000 | ||
| PubChem | 26010 | ||
| SMILES | |||
| InChI | |||
| Apparence | solide blanc inodore[1] | ||
| Propriétés chimiques | |||
| Formule | Cl3Ga |
||
| Masse molaire[2] | 176,082 ± 0,007 g/mol Cl 60,4 %, Ga 39,6 %, |
||
| Propriétés physiques | |||
| T° fusion | 78 °C[1] | ||
| T° ébullition | 201 °C[1] | ||
| Solubilité | réagit avec l'eau[1] | ||
| Masse volumique | 2,47 g/cm3[3] à 25 °C | ||
| Pression de vapeur saturante | 1 mmHg[1] à 48 °C | ||
| Précautions | |||
| SGH[1] | |||
| H314, EUH014, P280, P310, P301+P330+P331, P303+P361+P353 et P305+P351+P338 |
|||
| NFPA 704[1] | |||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Comme les autres halogénures d'aluminium, de gallium et d'indium, GaCl3 est un acide de Lewis fort. Il forme des adduits acide-base de Lewis stables avec des bases telles que des ions halogénure, des éthers, des amines ou des phosphines. Il réagit mieux que le chlorure d'aluminium avec les bases molles telles que les phosphines, tandis que les bases dures réagissent mieux avec le chlorure d'aluminium[6]. Il est possible de le sublimer sous vide en-dessous de son point de fusion afin de le purifier[7].
Synthèse
modifierLe trichlorure de gallium peut être obtenu directement à partir des corps simples[6] :
Il est également possible de traiter le gallium élémentaire dans un flux de chlorure d'hydrogène HCl[7] :
Une autre voie fait intervenir l'action du chlorure de thionyle SOCl2 sur l'oxyde de gallium(III) Ga2O3 à environ 200 °C[8] :
Applications
modifierLe trichlorure de gallium est utilisé en catalyse acide, comme les réactions de Friedel-Crafts, ainsi que dans les réactions de carbogallation (en) avec des composés ayant une liaison triple carbone≡carbone. C'est un précurseur de réactifs organogallium également utilisé comme catalyseur dans de nombreuses réactions organiques[4].
110 tonnes d'une solution aqueuse de trichlorure de gallium ont servi pour l'expérience GALLEX dans les années 1990 au laboratoire national du Gran Sasso, en Italie, pour détecter les neutrinos solaires. Cela consistait à mesurer la capture électronique du 71
32Ge formé par l'interaction d'un neutrino électronique avec un atome de gallium 71 en libérant un électron[9] :
Notes et références
modifier- « Fiche du composé Gallium(III) chloride, ultra dry, 99.999% (metals basis) », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Gallium(III) chloride, consultée le 4 janvier 2023.
FDS : (en) « Gallium(III) chloride » [PDF], sur sigmaaldrich.com, Sigma-Aldrich, (consulté le ) - (en) Masahiko Yamaguchi, Shigeki Matsunaga, Masakatsu Shibasaki, Bastien Michelet, Christophe Bour et Vincent Gandon, « Gallium Trichloride », Encyclopedia of Reagents for Organic Synthesis, , p. 1-8 (DOI 10.1002/047084289X.rn00118u.pub3, lire en ligne).
- (en) Sergey I. Troyanov, Thoralf Krahl et Erhard Kemnitz, « Crystal structures of GaX3 (X = Cl, Br, I) and AlI3 », Zeitschrift für Kristallographie - Crystalline Materials, vol. 219, no 2, , p. 88-92 (DOI 10.1524/zkri.219.2.88.26320, Bibcode 2004ZK....219...88T, lire en ligne).
- (de) A. F. Holleman, E. Wiberg et N. Wiberg, Lehrbuch der Anorganischen Chemie, 102e éd., Walter de Gruyter, Berlin, 2007, p. 1190-1192. (ISBN 978-3-11-017770-1)
- (en) W. C. Johnson et Caleb A. Haskew, « Gallium trichloride », Harold Simmons Booth, Inorganic Syntheses, vol. 1, McGraw-Hill, Inc., 1939, p. 26-27 (OCLC 86223179). (ISBN 978-0470132647)
- (en) Georg Brauer, « Gallium(III)-chlorid », Handbuch der Präparativen Anorganischen Chemie, Ferdinand Enke Verlag, Stuttgart, 1954, p. 635 sqq. (OCLC 2418542)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, 85e éd., CRC Press, 2004. (ISBN 978-0849304859)


