TAPS (tampon)
composé chimique
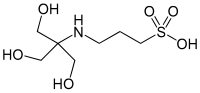
TAPS est le nom courant de l'acide [tris(hydroxyméthyl)méthylamino]propanesulfonique, un acide sulfonique couramment utilisé comme tampon. C'est un composé faisant partie des tampons de Good[2], décrit et nommé en 1972.
| TAPS | |
| |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.045.398 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C7H17NO6S [Isomères] |
| Masse molaire[1] | 243,278 ± 0,014 g/mol C 34,56 %, H 7,04 %, N 5,76 %, O 39,46 %, S 13,18 %, |
| pKa | 8,4 à 25 °C |
| Propriétés physiques | |
| Masse volumique | 1,189 61 g·cm-3 |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le TAPS se lie avec les cations divalents[3], notamment Co2+ et Ni2+. Il est utilisé pour réaliser des solutions tampon de pH compris entre 7,7 et 9,1, son pKa étant de 8,44 pour une solution de force ionique nulle à 25 °C[4].
Références
modifier- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) N.E. Good et S. Izawa, « [3] Hydrogen ion buffers », dans Methods in Enzymology, vol. 24, Elsevier, (ISBN 978-0-12-181887-6, DOI 10.1016/0076-6879(72)24054-x, lire en ligne), p. 53–68
- ↑ (en) Carina M. M. Machado, Paula Gameiro et Helena M. V. M. Soares, « Complexation of M–(buffer)x–(OH)ySystems Involving Divalent Ions (Cobalt or Nickel) and Zwitterionic Biological Buffers (AMPSO, DIPSO, TAPS and TAPSO) in Aqueous Solution », Journal of Solution Chemistry, vol. 37, no 5, , p. 603–617 (ISSN 1572-8927, DOI 10.1007/s10953-008-9265-3, lire en ligne, consulté le )
- ↑ Robert N. Goldberg, Nand Kishore et Rebecca M. Lennen, « Thermodynamic Quantities for the Ionization Reactions of Buffers », Journal of Physical and Chemical Reference Data, vol. 31, no 2, , p. 231–370 (ISSN 0047-2689, DOI 10.1063/1.1416902, lire en ligne, consulté le )