Sel de Reinecke
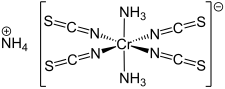
Le sel de Reinecke est un composé chimique de formule NH4[Cr(NCS)4(NH3)2], qui existe généralement sous forme d'hydrate[3]. Il s'agit d'un solide cristallisé rouge sombre, soluble dans l'eau bouillante, l'acétone et l'éthanol[4]. L'atome de chrome à l'état d'oxydation +3 est coordonné à six atomes d'azote dans une géométrie octaédrique. Les quatre anions isocyanate SCN− sont linéaires et alignés avec l'atome de chrome en position équatoriale, tandis que les deux ligands ammine NH3 sont trans l'un par rapport à l'autre, en position polaire.
| Sel de Reinecke | |
| |
| Structure du sel de Reinecke | |
| Identification | |
|---|---|
| No CAS | (hydrate) |
| No ECHA | 100.033.625 |
| No CE | 237-003-3 |
| PubChem | 44134924 |
| SMILES | |
| InChI | |
| Apparence | rouge foncé[1] |
| Propriétés chimiques | |
| Formule | C4H10CrN7S4 |
| Masse molaire[2] | 336,425 ± 0,026 g/mol C 14,28 %, H 3 %, Cr 15,46 %, N 29,14 %, S 38,13 %, |
| Propriétés physiques | |
| Masse volumique | 1,49 g/cm3[3] |
| Précautions | |
| SGH[1] | |
| H302+H312+H332, P280, P312, P301+P330+P331, P302+P352 et P304+P340 |
|
| NFPA 704[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le sel de Reinecke a été mentionné pour la première fois par le chimiste allemand Albert Reinecke en 1863[5]. Il est obtenu en traitant du thiocyanate d'ammonium NH4SCN fondu (point de fusion de l'ordre de 145 à 150 °C) avec du dichromate d'ammonium (NH4)2Cr2O7[6].
-
Sel de Reinecke.
Applications
modifierCe composé peut être utilisé pour précipiter des amines primaires et secondaires sous forme de sels d'ammonium[4]. Par exemple, les amines dérivées d'acides aminés tels que la proline et l'hydroxyproline forment des précipités cristallins avec le sel de Reinecke. Ce réactif est également utilisé en chimie analytique pour détecter les cations métalliques[7]. Par exemple, avec les cations de mercure(II), il se forme un précipité rouge clair peu soluble dit de « reineckate de mercure(II) » :
Les cations de cuivre(I) forment un précipité jaune peu soluble :
La détection par le sel de Reinecke est très sensible. Cette méthode peut également être utilisée pour la détermination quantitative par photométrie. Par exemple, la précipitation de mercure(II) en présence de thiourée donne un complexe soluble dans les cétones et peut être mesuré par photométrie entre 520 et 540 nm[8].
Notes et références
modifier- « Fiche du composé Ammonium diamminetetrathiocyanatochromate(III) monohydrate, ACS, 93.0% min », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) T. Saito, T. Takeuchi et R. Pepinsky, « The Crystal Structure of Ammonium Reineckate », Zeitschrift für Kristallographie - Crystalline Materials, vol. 106, nos 1-6, , p. 476-477 (DOI 10.1524/zkri.1954.106.16.476, S2CID 101134761, lire en ligne).
- (en) Tim Peppel, Christin Schmidt et Martin Köckerling, « Synthesis, Properties, and Structures of Salts with the Reineckate Anion, [CrIII(NCS)4(NH3)2]–, and Large Organic Cations », Zeischrift für anorganische und allgemeine Chemie, vol. 637, no 10, , p. 1314-1321 (DOI 10.1002/zaac.201100091, lire en ligne).
- (en) A. Reinecke, « Ueber Rhodanchromammonium-Verbindungen », Justus Liebigs Annalen der Chemie, vol. 126, no 1, , p. 113-118 (DOI 10.1002/jlac.18631260116, lire en ligne).
- (en) H. D. Dakin, « Reinecke Salt », Organic Syntheses, vol. 15, , p. 74 (DOI 10.15227/orgsyn.015.0074, lire en ligne).
- (de) Jander/Blasius Lehrbuch der analytischen und präparativen anorganischen Chemie, 5e éd., S. Hirzel, Stuttgart-Leipzig, 1965, p. 263, 272.
- (de) Bruno Lange et Zdenĕk J. Vejdĕlek, Photometrische Analyse, Verlag Chemie Weinheim, 1980, p. 222



