Sélénourée
La sélénourée est un composé chimique de formule Se=C(NH2)2, analogue sélénié de la thiourée S=C(NH2)2 et de l'urée O=C(NH2)2. Cette molécule présente l'un des rares exemples d'une double liaison stable C=Se. Elle est utilisée en synthèse organique pour produire des hétérocycles séléniés, mais a été sensiblement moins étudiée que ses analogues thio et oxo en raison de l'instabilité et de la toxicité des composés organoséléniés[3].
| Sélénourée | |||
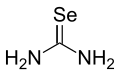 Structure de la sélénourée |
|||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.010.119 | ||
| No CE | 211-129-9 | ||
| No RTECS | YU1820000 | ||
| ChEBI | 36957 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | CH4N2Se [Isomères] |
||
| Masse molaire[1] | 123,02 ± 0,03 g/mol C 9,76 %, H 3,28 %, N 22,77 %, Se 64,18 %, |
||
| Propriétés physiques | |||
| T° fusion | 210 à 215 °C[2] | ||
| Précautions | |||
| SGH[2] | |||
| H301, H331, H373, H410, P261, P273, P311, P301+P310 et P501 |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Synthèse
modifierLa sélénourée a été synthétisée pour la première fois en 1884 par Auguste Verneuil en faisant réagir du séléniure d'hydrogène H2Se avec du cyanamide CN2H2 [4]:
- H2Se + N=CNH2 → SeC(NH2)2.
Bien que cette réaction ait pu être mise en œuvre à l'échelle industrielle, des procédés plus modernes conduisent à la synthèse de dérivés substitués de la sélénourée, qui peuvent être produits en utilisant des isosélénocyanates organiques et des amines secondaires :
- RN=C=Se + NHR’R’’ → Se=C(NRH)(NR’R’’)
On peut également utiliser des carboimides substitués comme suit[3]:
- RN=C=NR’ Se=C(NRH)(NR’H).
Applications
modifierLa sélénourée est utilisée abondamment pour former des hétérocycles. En effet, certains composés hétérocycliques organoséléniés possèdent entre autres des vertus anti-inflammatoires et antitumorales, et la sélénourée est considérée comme le meilleur point de départ pour la production de telles molécules[5].
La sélénourée forme également des complexes avec les métalloïdes et des métaux de transition. Cette faculté à agir efficacement comme ligand est attribuée à l'effet de donneur d'électron des groupes amino qui stabilise la liaison π Se–M. Seule cette liaison a été observée dans les complexes formés par la sélénourée, tandis que la thiourée et l'urée se lient aux atomes métalliques également par leurs atomes d'azote[6].
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Selenourea 98%, consultée le 20 mai 2013.
- (en) Mamoru Koketsu et Hideharu Ishihara, « Thiourea and Selenourea and Their Applications », Current Organic Synthesis, vol. 3, no 4, , p. 439-455 (lire en ligne) DOI 10.2174/157017906778699521
- (en) Håkon Hope, « A Note on the Synthesis of Selenourea », Acta Chemica Scandinavica 1947 - 1999, vol. 18, , p. 1800-1800 (lire en ligne) DOI 10.3891/acta.chem.scand.18-1800
- (en) Masayuki Ninomiya, Dinesh R. Garud et Mamoru Koketsu, « Selenium-Containing Heterocycles Using Selenoamides, Selenoureas, Selenazadienes, and Isoselenocyanates », Heterocycles, vol. 81, no 9, , p. 2027-2055 (lire en ligne) DOI 10.3987/REV-10-677
- (en) Peter G. Jones et Carsten Thöne, « Gold Complexes with Selenium Ligands, IV(1) Preparation, Crystal Structures and Reactions of Phosphine(selenourea)gold(I) Complexes », Chemische Berichte, vol. 124, no 12, , p. 2725–2729 (lire en ligne) DOI 10.1002/cber.19911241213



