Radical nitrate
Le trioxyde d'azote, ou radical nitrate est un oxyde d'azote de formule NO3. Comme NO et NO2, la molécule comporte un électron non lié, c'est donc un radical. Contrairement à NO et NO2, sa forte réactivité fait qu'il est instable, c'est un intermédiaire réactionnel important dans les réactions d'oxydations photochimiques qui sont à l'origine de la formation du smog dans les villes. Il est aussi observé en phase gazeuse, liquide ou solide comme une espèce à faible durée de vie[2].
| Radical nitrate | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | radical Nitrate | |
| No CAS | ||
| PubChem | 5360456 | |
| Propriétés chimiques | ||
| Formule | NO3 [Isomères] |
|
| Masse molaire[1] | 62,004 9 ± 0,001 1 g/mol N 22,59 %, O 77,41 %, |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Histoire
modifierL'existence du radical nitrate a été initialement proposée par Hautefeuille et Chappuis pour expliquer les spectres d'absorption de l'air soumis à des décharges électriques [3]. L'étude de ses propriétés physiques et chimiques a pris plus d'importance lorsque NO3 a été détecté dans les zones d'air polluées de la troposphère[4].
Structure et propriétés
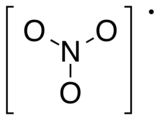
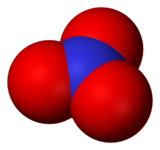
modifierLe radical nitrate comporte trois atomes d'oxygène liés de façon covalente à un atome d'azote. La molécule est de forme plane avec des angles entre les liaisons NO valant 120°, elle fait donc partie du groupe de symétrie D3h.
Le radical NO3• absorbe la lumière dans le spectre visible avec trois pics d'absorption à 590, 623 et 666 nm[5], ce radical a une couleur bleue. S'il est soumis à un rayonnement de longueur d'onde supérieure à 600 nm, on observe une fluorescence. Si le rayonnement absorbé est inférieur à 595 nm, le radical peut passer dans un état excité[2]. Dans l'atmosphère, il est rapidement dégradé par photolyse pour former une molécule de dioxyde d'azote et un radical O•[6].
- NO3• + hν → NO2 + O•
Sa durée de vie est de quelques secondes.
Synthèse
modifierLe radical NO3 peut être préparé par la réaction photochimique du dioxyde d'azote avec l'ozone :
- NO2 + O3 → NO3• + O2.
Cette réaction peut être aussi réalisée en phase solide ou en solution aqueuse en irradiant des gaz condensés, des nitrates ou de l'acide nitrique, etc.
NO3• est aussi un produit de la photolyse du pentoxyde de diazote N2O5, du nitrate de chlore ClONO2, de l'acide peroxynitrique HO2NO ou de ses sels. Par exemple :
- N2O5 → NO2 + NO3•
- 2 ClONO2 → Cl2 + 2 NO3•.
Importance en chimie atmosphérique
modifierComme indiqué précédemment, la principale source de radical nitrate dans l'atmosphère est la réaction photochimique de NO2 avec l'ozone O3. Ensuite, le radical nitrate peut à son tour réagir avec NO2 pour former du pentoxyde de diazote selon la réaction équilibrée[6] :
- NO3• + NO2 + M N2O5 + M.
Dans cette équation, M est le troisième corps, c'est-à-dire n'importe quelle molécule présente qui échange de l'énergie avec les réactifs ou les produits de réaction.
Le radical NO3• peut ensuite réagir avec les composés organiques volatils présents dans l'atmosphère, pour un hydrocarbure R-H :
- R-H + NO3• → R• + HNO3.
Le radical R• réagit ensuite avec le dioxygène pour former un radical peroxyde :
- R• + O2 → RO2•.
Ce radical réagit ensuite avec le monoxyde d'azote présent dans l'air :
- RO2• + NO → RO• + NO2.
Cette dernière réaction consomme le monoxyde d'azote, il n'est donc plus disponible pour détruire l'ozone, en conséquence la concentration en ozone augmente. Un mécanisme similaire existe avec le radical hydroxyle HO•, le radical NO3• est en général plus actif lorsque le soleil se couche car la baisse de luminosité réduit sa décomposition par photolyse.
Notes et références
modifier- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Nitrate radical » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) R. P. Wayne, I. Barnes, P. Biggs, J. P. Burrows, C. E. Canosa-Mas, J. Hjorth, G. Le Bras, G. K. Moortgat, D. Perner, G. Poulet et al., « The nitrate radical: Physics, chemistry, and the atmosphere », Atmospheric Environment. Part A. General Topics, vol. 25, no 1, , p. 1-203 (DOI 10.1016/0960-1686(91)90192-A).
- P. Hautefeuille et J. Chappuis, « De la recherche des composés gazeux et de l'étude de quelques-unes de leurs propriétés à l'aide du spectroscope », Comptes Rendus de l'Académie de Sciences de Paris, vol. 92, , p. 80-83.
- (en) U. Platt, D. Perner, A. M. Winer, G. W. Harris et J. N. Pitts, « Detection of NO3 in the polluted troposphere by differential optical-absorption », Geophysical Research Letters, vol. 7, , p. 89-92.
- (en) R. J. Yokelson, J. B. Burkholder, R. W Fox, R. K. Talukdar et A. V. Ravishankara, « Temperature dependance of the NO3 spectrum », Journal of Physical Chemistry, vol. 98, , p. 13144-13150.
- (en) R. Atkinson, « Atmospheric chemistry of VOCs and NOx », Atmospheric Environment, vol. 34, , p. 2063-2101.
