Réaction de Perkin
La réaction Perkin est une réaction organique qui consiste en la condensation aldolique d'un aldéhyde aromatique et un d'anhydride d'acide en présence d'un sel alcalin pour former un acide aromatique α,β-insaturé, un dérivé de l'acide cinnamique[1],[2].

Le sel d'acide sert de catalyseur, et on peut utiliser d'autres bases à la place[3].
La réaction est nommée d'après le chimiste anglais William Henry Perkin (1838-1907)[4],[5] qui l'utilisa notamment pour synthétiser l'acide cinnamique, en utilisant pour ça l'anhydride acétique et l'acétate de sodium, qui est le plus simple exemple du cas général (R=H) :
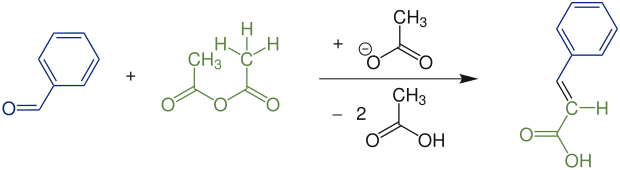
Mécanisme réactionnel
modifierPlusieurs mécanismes réactionnels ont été proposés, mais aucun ne fait l'unanimité. Dans le mécanisme présenté ci-dessous, la première étape est la formation de l'anion de l'anhydride d'acide, ce qui s'explique par le fait que la réaction se déroule dans une base et l'hydrogène α dans la liaison C-H est acide. Cet anion vient ensuite s'ajouter de manière nucléophile au carbone du groupe carbonyle de l'aldéhyde aromatique. L'adduit subit ensuite un cyclisation interne produisant un dérivé des trioxane. Ce dernier se réorganise en deux branches : une branche ester d'acétate, et une acide acétique. La branche acétate est ensuite éliminée en même temps qu'un des hydrogènes portés par le second carbone du groupe acétique, produisant un cinnamate. Ce dernier est enfin reprotoné en acide cinnamique.
Propriétés
modifierLa réaction de Perkin produit préférentiellement le diastéréoisomère (E), mais pas de façon exclusive.
Cette réaction fait partie des synthèses monotopes : l'aldéhyde, l'anhydride acide et la base sont mélangés dans un seul récipient et chauffés à 170-200 °C pendant plusieurs heures.
Le sel de sodium de l'acide carboxylique correspondant à l'anhydride est généralement utilisé comme base. Cependant, il a été constaté que les sels de césium améliorent parfois considérablement le rendement de la réaction et raccourcissent le temps de réaction nécessaire.
Applications
modifierUne application notable de la réaction de Perkin est la synthèse en laboratoire du resvératrol, un stilbénoïde phytoœstrogénique[6].
Variante
modifierUne variante de la réaction de Perkin est la synthèse d'Erlenmeyer (ou synthèse d'Erlenmeyer-Plöchl) pour la synthèse d'acides aminés et d'α-cétoacides.
Notes et références
modifier- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Perkin-Reaktion » (voir la liste des auteurs).
- Perkin, W. H., « On some hydrocarbons obtained from the homologues of cinnamic acid; and on anethol and its homologues », Journal of the Chemical Society, vol. 32, , p. 660–674 (DOI 10.1039/js8773200660, lire en ligne)
- Perkin, W. H., « On the artificial production of coumarin and formation of its homologues », Journal of the Chemical Society, vol. 21, , p. 53–61 (DOI 10.1039/js8682100053, lire en ligne)
- J. F. J. Dippy et R. M. Evans, « The nature of the catalyst in the Perkin condensation », J. Org. Chem., vol. 15, no 3, , p. 451–456 (DOI 10.1021/jo01149a001)
- W. H. Perkin, « XXIII.—On the hydride of aceto-salicyl », Journal of the Chemical Society, vol. 21, , p. 181–186 (DOI 10.1039/JS8682100181)
- W. H. Perkin, « XI.—On the formation of coumarin and of cinnamic and of other analogous acids from the aromatic aldehydes », 21, vol. 31, , p. 388–427 (DOI 10.1039/JS8773100388)
- Guy Solladié, Yacine Pasturel-Jacopé et Jean Maignan, « A re-investigation of resveratrol synthesis by Perkins reaction. Application to the synthesis of aryl cinnamic acids », Tetrahedron, vol. 59, no 18, , p. 3315–3321 (ISSN 0040-4020, DOI 10.1016/S0040-4020(03)00405-8)