Pyruvate carboxylase
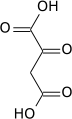
La pyruvate carboxylase est une ligase qui catalyse la carboxylation du pyruvate en oxaloacétate avec hydrolyse concomitante d'une molécule d'ATP en ADP + Pi :
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | Biotine ; Zn ou Mn |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Il s'agit d'une enzyme dont le groupement prosthétique est la biotine et qui requiert un cation Mg2+ ou Mn2+ comme cofacteur[1]. Cette réaction anaplérotique est très importante car elle régénère de l'oxaloacétate, intensivement consommé par le cycle de Krebs, afin de le rendre disponible également pour d'autres voies métaboliques. Elle participe ainsi à la régulation de la néoglucogenèse et de la lipogenèse ainsi que de la production d'insuline.
La pyruvate carboxylase est présente dans une très large variété d'eucaryotes et de procaryotes allant des animaux aux bactéries en passant par les plantes et les champignons. Chez les animaux, c'est une enzyme mitochondriale qu'on trouve dans le foie mais pas dans les muscles. L'enzyme isolée de la plupart des organismes est une protéine tétramérique à régulation allostérique par l'acétyl-CoA et l'aspartate.
Notes et références
modifier- (en) Sarawut JITRAPAKDEE, Martin ST MAURICE, Ivan RAYMENT, W. Wallace CLELAND, John C. WALLACE et Paul V. ATTWOOD, « Structure, mechanism and regulation of pyruvate carboxylase », Biochemical Journal, vol. 413, , p. 369-387 (lire en ligne) DOI 10.1042/BJ20080709