PMDTA
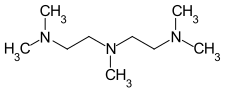
La pentaméthyldiéthylènetriamine, ou PMDTA, est un composé organique de formule chimique [(CH3)2NCH2CH2]2NCH3. Il s'agit d'un ligand tridenté basique, volumineux et flexible, utilisé en chimie des organolithiens. Il se présent sous la forme d'un liquide incolore, qui tire sur le jaune en présence d'impuretés.
| Pentaméthyl- diéthylènetriamine | |
| |
| Structure de la pentaméthyldiéthylènetriamine | |
| Identification | |
|---|---|
| Nom UICPA | N’-[2-(diméthylamino)éthyl]-N,N,N’-triméthyléthane-1,2-diamine |
| Synonymes |
PMDTA, |
| No CAS | |
| No ECHA | 100.019.275 |
| No CE | 221-201-1 |
| No RTECS | IE2100000 |
| PubChem | 18196 |
| ChEBI | 39475 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore à l'odeur aminée[1] |
| Propriétés chimiques | |
| Formule | C9H23N3 |
| Masse molaire[2] | 173,299 ± 0,009 4 g/mol C 62,38 %, H 13,38 %, N 24,25 %, |
| Propriétés physiques | |
| T° fusion | < −18 °C[1] |
| T° ébullition | 199 °C[1] |
| Miscibilité | avec l'eau à 20 °C[1] |
| Masse volumique | 0,829 g/cm3[1] à 25 °C |
| Point d’éclair | 77 °C[1] |
| Limites d’explosivité dans l’air | entre 1,1 et 5,7 % en volume[1] |
| Pression de vapeur saturante | 0,3 hPa[1] à 20 °C |
| Précautions | |
| SGH[1] | |
| H302, H311, H314, P280, P301+P312+P330, P303+P361+P353 et P305+P351+P338+P310 |
|
| NFPA 704[3] | |
| Transport[1] | |
| Écotoxicologie | |
| DL50 | 1 350 mg/kg[1] (souris, oral) |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Synthèse et propriétés
modifierLa PMDTA est préparée à partir de diéthylènetriamine HN(CH2CH2NH2)2 par la réaction d'Eschweiler-Clarke, qui fait intervenir du formaldéhyde HCHO et de l'acide formique HCOOH[4] :
- HN(CH2CH2NH2)2 + 5 HCHO + 5 HCOOH ⟶ [(CH3)2NCH2CH2]2NCH3 + 5 CO2 + 5 H2O.
Contrairement à la diéthylènetriamine, les trois amines du PMDTA sont tertiaires. Ces deux ligands forment des cycles de chélation à cinq atomes. Les groupes amino du PMDTA ont des propriétés donneuses σ moins marquées que ceux de la diéthylènetriamine dans les complexes de cuivre(II)[5]. Ces deux ligands peuvent former des complexes de coordination métalliques dans des arrangements où les trois centres azotés sont coplanaires ou cis deux à deux.
Chimie des organolithiens
modifierLe PMDTA est utilisé pour modifier la réactivité des organolithiens, qui se désagrègent en présence de bases de Lewis en augmentant leur réactivité[6]. La tétraméthyléthylènediamine (TMEDA), diamine tertiaire, est couramment utilisée dans ces applications ; elle se lie au lithium en tant que ligand bidenté. La PMDTA se comporte de manière analogue, mais comme elle est tridentée, il se lie plus fortement au lithium. Contrairement à la TMEDA, la PMDTA forme des complexes monomères avec des organolithiens. Les deux amines affectent la régiochimie de la métallation[6],[7]. Dans les adduits PMDTA/n-BuLi, les liaisons Li–C sont fortement polarisées, augmentant ainsi la basicité du groupe butyle[8].
L'effet de la PMDTA sur l'anilide de lithium en illustre le pouvoir complexant. Le complexe [{PhN(H)Li}3·2PMDTA] est trinucléaire et présente des centres Li+ approximativement colinéaires qui sont tri-, tétra- et pentacoordonnés. L'atome de lithium central tricoordonné n'est pas lié à la PMDTA. L'un des centres Li terminaux a une géométrie pseudo-tétraédrique dans une sphère de coordination N4. L'autre atome de lithium terminal est pentacoordonné et se lie à deux centres N anilino et à la PMDTA[9].
Complexe d'aluminium
modifierLa PMDTA forme souvent des complexes pentacoordonnés en raison de l'encombrement stérique des groupes méthyle. La PMDTA stabilise les cations inhabituels. Le premier dérivé cationique de l'hydrure d'aluminium [H2Al(PMDTA)]+[AlH4]− a été préparé en traitant H3AlNMe3 avec de la PMDTA[8].
Notes et références
modifier- Entrée « Bis(2-dimethylaminoethyl)(methyl)amine » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 4 novembre 2022 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé 1,1,4,7,7-Pentamethyldiethylenetriamine, 98% », sur Alfa Aesar (consulté le ).
- (de) A. Marxer et K. Miescher, « Über die stufenweise Quaternisierung von aliphatischen Polyaminen. Neue Verbindungen mit ganglienblockierender Wirkung », Helvetica Chimica Acta, vol. 34, no 3, , p. 924-931 (DOI 10.1002/hlca.19510340327, lire en ligne).
- (en) Robert J. Angelici et Juanita W. Allison, « Stability constants for amino acid coordination by substituted diethylenetriamine complexes of copper(II) and the kinetics of amino acid ester hydrolysis », Inorganic Chemistry, vol. 10, no 10, , p. 2238-2243 (DOI 10.1021/ic50104a030, lire en ligne).
- (en) Carsten Strohmann et Viktoria H. Gessner, « From the Alkyllithium Aggregate [{(nBuLi)2⋅PMDTA}2] to Lithiated PMDTA », Angewandte Chemie International Edition, vol. 46, no 24, , p. 4566-4569 (DOI 10.1002/anie.200605105, lire en ligne).
- (en) Gideon Fraenkel, « N,N,N′,N″,N″-Pentamethyldiethylenetriamine », Encyclopedia of Reagents for Organic Synthesis, , p. 806-813 (DOI 10.1002/047084289X.rp028, lire en ligne).
- (en) C. Elschenbroich, Organometallics, Wiley-VCH, p. 45-46, (ISBN 978-3-527-29390-2)
- (en) Donald Barr, William Clegg, Lucy Cowton, Lynne Horsburgh, Fiona M. Mackenzie et Robert E. Mulvey, « Lithium anilide complexed by pmdeta: expectation of a simple monomer, but in reality an odd trinuclear composition combining three-, four- and five-coordinate lithium », Journal of the Chemical Society, Chemical Communications, no 8, , p. 891-892 (DOI 10.1039/c39950000891, lire en ligne).





