Oxyde de cérium(IV)
composé chimique
(Redirigé depuis Oxyde de cérium IV)
L'oxyde de cérium(IV) également appelé dioxyde de cérium, oxyde de cérium ou historiquement ceria[a], est l'un des oxydes du cérium, de formule CeO2.
| Oxyde de cérium(IV) | ||

| ||
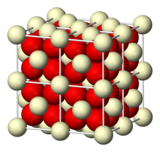 | ||
| Structure et apparence de l'oxyde de cérium(IV). | ||
| Identification | ||
|---|---|---|
| Nom UICPA | dioxocérium | |
| Synonymes |
oxyde de cérium |
|
| No CAS | (monohydrate) |
|
| No ECHA | 100.013.774 | |
| No CE | 215-150-4 | |
| ChEBI | 79089 | |
| SMILES | ||
| InChI | ||
| Apparence | Solide jaune pâle hygroscopique | |
| Propriétés chimiques | ||
| Formule | CeO2 [Isomères] |
|
| Masse molaire[1] | 172,115 ± 0,002 g/mol Ce 81,41 %, O 18,59 %, |
|
| Propriétés physiques | ||
| T° fusion | 2 400 °C | |
| T° ébullition | 3 500 °C | |
| Cristallographie | ||
| Système cristallin | Cubique | |
| Réseau de Bravais | cubique faces centrées | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Il se présente, dans les conditions normales de température et de pression (CNTP) sous la forme d'un solide jaune pâle, légèrement hygroscopique et capable d'absorber de petites quantités de dioxyde de carbone atmosphérique[3].
Cet oxyde de cérium peut être formé par calcination de l'oxalate de cérium ou de l'hydroxyde de cérium.
Le cérium forme aussi un autre oxyde, l'oxyde de cérium(III), de formule Ce2O3, qui est instable et s'oxyde en oxyde de cérium(IV) aux CNTP[4].
Notes et références
modifier- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Cérium(IV) oxide » (voir la liste des auteurs).
Notes
modifier- Le dioxyde de cérium est isolé indépendamment en 1803 par Martin Heinrich Klaproth et Jöns Jacob Berzelius aidé de Wilhelm Hisinger. Si Berzelius reconnaît la nouvelle substance comme un oxyde métallique et l'appellera consécutivement oxyde de cérium (cerium oxide), Klaproth considère ce composé comme une « terre » (catégorie de substances en usage au XVIIIe et XIXe siècles) et adopte la nomenclature associée en la nommant ceria, nom qui restera en usage[2].
Références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Episodes from the History of the Rare Earth Elements, Springer Netherlands, coll. « Chemists and Chemistry », (ISBN 9789401066143 et 9789400902879, DOI 10.1007/978-94-009-0287-9), p. 40-41.
- Robert David Green Carbon dioxide reduction on gadolinium-doped ceria cathodes. PhD Thesis. Department of Chemical Engineering, CASE Western Reserve University. Mai 2009.
- Thermodynamic data