Nirmatrelvir
Le nirmatrelvir est un antiviral développé par le laboratoire pharmaceutique américain Pfizer agissant comme inhibiteur de protéase 3C-like des coronavirus[2],[3],[4]. Il entre dans la combinaison nirmatrelvir/ritonavir distribuée sous la marque Paxlovid.
| Nirmatrelvir | |
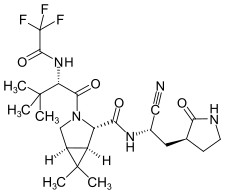
| |
| Structure du nirmatrelvir. | |
| Identification | |
|---|---|
| Nom UICPA | (1R,2S,5S)-N-[(1S)-1-cyano-2-[(3S)-2-oxopyrrolidin-3-yl]éthyl]-3-[(2S)-3,3-diméthyl-2-[(2,2,2-trifluoroacétyl)amino]butanoyl]-6,6-diméthyl-3-azabicyclo[3.1.0]hexane-2-carboxamide |
| Synonymes |
PF-07321332 |
| No CAS | |
| DrugBank | DB16691 |
| PubChem | 155903259 |
| ChEBI | 170007 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C23H32F3N5O4 |
| Masse molaire[1] | 499,526 5 ± 0,022 8 g/mol C 55,3 %, H 6,46 %, F 11,41 %, N 14,02 %, O 12,81 %, |
| Considérations thérapeutiques | |
| Classe thérapeutique | inhibiteur de protéase |
| Voie d’administration | voie orale |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
La protéase 3C-like, souvent notée 3CLpro, intervient notamment dans les modifications post-traductionnelles d'une polyprotéine du SARS-CoV-2, virus responsable du COVID-19, produisant 16 protéines non structurales, qui jouent un rôle essentiel dans la réplication, la transcription et la recombinaison virales au cours de l'infection. L'inhibition des peptidases bloque la libération de ces protéines non structurales et limite l'infectivité du SARS-CoV-2. C'est ce qui fait de la 3CLpro, principale protéase de ces coronavirus, une cible majeure pour le développement d'antiviraux indiqués pour traiter les cas de COVID-19[5].
Développement
modifierLes sites de clivage des polyprotéines par les peptidases coronavirales se trouvent généralement à la suite de résidus de glutamine. Des travaux précédents sur des rhinovirus humains apparentés ont montré que la chaîne latérale flexible des résidus de glutamine peut être remplacée par une pyrrolidone rigide[6],[7]. De tels médicaments ont été par la suite développés avant la pandémie de COVID-19 pour traiter d'autres maladies, dont le SRAS[8]. La première application effective de ce type de molécules a été le GC376, promédicament du GC373, introduit en 2018 pour traiter la péritonite infectieuse féline provoquée par le coronavirus félin[9], maladie dont le taux de létalité chez le chat atteint 100 %.
Le GC373 et le nirmatrelvir sont deux peptidomimétiques agissant comme inhibiteurs compétitifs avec une pyrrolidone en position P1 et, respectivement, un groupe aldéhyde et un groupe nitrile pour se lier au résidu de cystéine du site catalytique[10],[11]. Le nirmatrelvir a été développé en modifiant le lufotrelvir[12],[13], molécule précédemment testée comme promédicament phosphaté portant un groupe hydroxycétone de liaison à la protéase destiné à inhiber cette dernière. Le lufotrelvir était administré par injection intraveineuse, ce qui limitait son utilisation au secteur hospitalier. Des modifications successives du tripeptide peptidomimétique ont abouti au nirmatrelvir, qui peut être administré par voie orale[2]. Parmi les principaux changements, on relève une réduction du nombre de donneurs de liaisons hydrogène et du nombre de liaisons rotatives en introduisant un acide aminé non protéinogène bicyclique rigide, qui simule le résidu de leucine des inhibiteurs précédents. Ce résidu avait déjà été utilisé dans la synthèse du bocéprévir[14]. La tert-leucine, abrégée Tle, utilisée en position P3 du nirmatrelvir, avait initialement été identifiée comme acide aminé non standard optimal dans un médicament candidat ciblant la protéase 3C-like du SARS-CoV-2 en utilisant la chimie combinatoire[15],[16].
Utilisation
modifierL'administration par voie orale sous forme de gélules ou de comprimés permet de traiter les personnes infectées par le SARS-CoV-2 en phase précoce, lorsque la charge virale est particulièrement élevée mais qu'il y a peu de symptômes et que l'hospitalisation n'est pas ou pas encore nécessaire.
Dans les études cliniques, le nirmatrelvir a été administré avec une faible dose de ritonavir, inhibiteur de protéase du VIH[17], qui a déjà été approuvé pour traitement antirétroviral. La co-administration aide à ralentir la dégradation du nirmatrelvir afin d'accroître sa biodisponibilité dans l'organisme et pour qu'il puisse rester actif plus longtemps à des niveaux plus élevés pour être efficace contre le virus[18]. Le ritonavir est un inhibiteur du système du cytochrome P450 dans le foie.
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Dafydd R. Owen, Charlotte M. N. Allerton, Annaliesa S. Anderson, Lisa Aschenbrenner, Melissa Avery, Simon Berritt, Britton Boras, Rhonda D. Cardin, Anthony Carlo (...) et Yuao Zhu, « An oral SARS-CoV-2 Mpro inhibitor clinical candidate for the treatment of COVID-19 », Science, vol. 374, no 6575, , p. 1586-1593 (PMID 34726479, DOI 10.1126/science.abl4784, S2CID 240422219, lire en ligne )
- (en) Bilal Ahmad, Maria Batool, Qurat ul Ain, Moon Suk Kim et Sangdun Choi, « Exploring the Binding Mechanism of PF-07321332 SARS-CoV-2 Protease Inhibitor through Molecular Dynamics and Binding Free Energy Simulations », International Journal of Molecular Sciences, vol. 22, no 17, , article no 9124 (PMID 34502033, PMCID 8430524, DOI 10.3390/ijms22179124, lire en ligne )
- (en) Koen Vandyck et Jerome Deval, « Considerations for the discovery and development of 3-chymotrypsin-like cysteine protease inhibitors targeting SARS-CoV-2 infection », Current Opinion in Virology, vol. 49, , p. 36-40 (PMID 34029993, PMCID 8075814, DOI 10.1016/j.coviro.2021.04.006, lire en ligne )
- (en) Juliana C. Ferreira et Wael M. Rabeh, « Biochemical and biophysical characterization of the main protease, 3-chymotrypsin-like protease (3CLpro) from the novel coronavirus SARS-CoV 2 », Nature, vol. 10, no 1, , article no 22200 (PMID 33335206, PMCID 7747600, DOI 10.1038/s41598-020-79357-0, Bibcode 2020NatSR..1022200F, lire en ligne )
- (en) Kanchan Anand, John Ziebuhr, Parvesh Wadhwani, Jeroen R. Mesters et Rolf Hilgenfeld, « Coronavirus Main Proteinase (3CLpro) Structure: Basis for Design of Anti-SARS Drugs », Science, vol. 300, no 5626, , p. 1763-1767 (PMID 12746549, DOI 10.1126/science.1085658, Bibcode 2003Sci...300.1763A, S2CID 13031405, lire en ligne)
- (en) Peter S. Dragovich, Thomas J. Prins, Ru Zhou, Stephen E. Webber, Joseph T. Marakovits, Shella A. Fuhrman, Amy K. Patick, David A. Matthews, Caroline A. Lee, Clifford E. Ford, Benjamin J. Burke, Paul A. Rejto, Thomas F. Hendrickson, Tove Tuntland, Edward L. Brown, James W. Meador, Rose Ann Ferre, James E. V. Harr, Maha B. Kosa et Stephen T. Worland, « Structure-Based Design, Synthesis, and Biological Evaluation of Irreversible Human Rhinovirus 3C Protease Inhibitors. 4. Incorporation of P1 Lactam Moieties as l-Glutamine Replacements », Journal of Medicinal Chemistry, vol. 42, no 7, , p. 1213-1224 (PMID 10197965, DOI 10.1021/jm9805384, lire en ligne)
- (en) Thanigaimalai Pillaiyar, Manoj Manickam, Vigneshwaran Namasivayam, Yoshio Hayashi et Sang-Hun Jung, « An Overview of Severe Acute Respiratory Syndrome–Coronavirus (SARS-CoV) 3CL Protease Inhibitors: Peptidomimetics and Small Molecule Chemotherapy », Journal of Medicinal Chemistry, vol. 59, no 14, , p. 6595-6628 (PMID 26878082, PMCID 7075650, DOI 10.1021/acs.jmedchem.5b01461, lire en ligne)
- (en) Niels C. Pedersen, Yunjeong Kim, Hongwei Liu, Anushka C. Galasiti Kankanamalage, Chrissy Eckstrand, William C. Groutas, Michael Bannasch, Juliana M. Meadows et Kyeong-Ok Chang, « Efficacy of a 3C-like protease inhibitor in treating various forms of acquired feline infectious peritonitis », Journal of Feline Medicine and Surgery, vol. 20, no 4, , p. 378-392 (PMID 28901812, PMCID 5871025, DOI 10.1177/1098612X17729626, lire en ligne )
- (en) Bethany Halford, « Pfizer unveils its oral SARS-CoV-2 inhibitor », Chemical & Engineering News, vol. 99, no 13, , article no 7 (DOI 10.47287/cen-09913-scicon3, S2CID 234887434, lire en ligne )
- (en) Wayne Vuong, Muhammad Bashir Khan, Conrad Fischer, Elena Arutyunova, Tess Lamer, Justin Shields, Holly A. Saffran, Ryan T. McKay, Marco J. van Belkum, Michael A. Joyce, Howard S. Young, D. Lorne Tyrrell, John C. Vederas et M. Joanne Lemieux, « Feline coronavirus drug inhibits the main protease of SARS-CoV-2 and blocks virus replication », Nature Communications, vol. 11, , article no 4282 (PMID 32855413, PMCID 7453019, DOI 10.1038/s41467-020-18096-2, lire en ligne )
- (en) « First-In-Human Study To Evaluate Safety, Tolerability, And Pharmacokinetics Following Single Ascending And Multiple Ascending Doses of PF-07304814 In Hospitalized Participants With COVID-19 », sur clinicaltrials.gov, National Institutes of Health, (consulté le ).
- (en) Britton Boras, Rhys M. Jones (...) et Charlotte Allerton, « Preclinical characterization of an intravenous coronavirus 3CL protease inhibitor for the potential treatment of COVID19 », Nature Communications, vol. 12, , article no 6055 (PMID 34663813, PMCID 8523698, DOI 10.1038/s41467-021-26239-2, Bibcode 2021NatCo..12.6055B, lire en ligne )
- (en) F. George Njoroge, Kevin X. Chen, Neng-Yang Shih et John J. Piwinski, « Challenges in Modern Drug Discovery: A Case Study of Boceprevir, an HCV Protease Inhibitor for the Treatment of Hepatitis C Virus Infection », Accounts of Chemical Research, vol. 41, no 1, , p. 50-59 (PMID 18193821, DOI 10.1021/ar700109k, S2CID 2629035, lire en ligne)
- (en) Marcin Poreba, Guy S Salvesen et Marcin Drag, « Synthesis of a HyCoSuL peptide substrate library to dissect protease substrate specificity », Nature Protocols, vol. 12, no 10, , p. 2189-2214 (PMID 28933778, DOI 10.1038/nprot.2017.091, S2CID 23895951, lire en ligne)
- (en) Wioletta Rut, Katarzyna Groborz, Linlin Zhang, Xinyuanyuan Sun, Mikolaj Zmudzinski, Bartlomiej Pawlik, Xinyu Wang, Dirk Jochmans, Johan Neyts, Wojciech Młynarski, Rolf Hilgenfeld et Marcin Drag, « SARS-CoV-2 Mpro inhibitors and activity-based probes for patient-sample imaging », Nature Chemical Biology, vol. 17, no 2, , p. 222-228 (PMID 33093684, DOI 10.1038/s41589-020-00689-z, S2CID 224827220, lire en ligne )
- (en) Mark W. Hull et Julio S. G. Montaner, « Ritonavir-boosted protease inhibitors in HIV therapy », Annals of Medicine, vol. 43, no 5, , p. 375-388 (PMID 21501034, DOI 10.3109/07853890.2011.572905, lire en ligne )
- (en) « Pfizer’s Novel COVID-19 Oral Antiviral Treatment Candidate Reduced Risk of Hospitalization or Death by 89% in Interim Analysis of Phase 2/3 EPIC-HR Study », sur pfizer.com, Pfizer, (consulté le ).
Liens externes
modifier- Ressource relative à la santé :