Myopathie à némaline
La myopathie à némaline (ou myopathie à bâtonnets) se caractérise par une faiblesse et une hypotonie musculaire avec une diminution ou une abolition des réflexes tendineux.
| Spécialité | Neurologie |
|---|
| CIM-10 | G71.2 |
|---|---|
| CIM-9 | 359.0 |
| OMIM | 161800 256030 605355 |
| DiseasesDB | 31991 33448 33447 |
| eMedicine |
1175852 neuro/230 |
| MeSH | D017696 |
| GeneReviews | Nemaline myopathy |
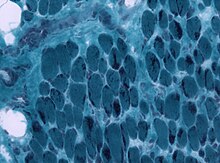
Cette myopathie atteint surtout le visage, les muscles fléchisseurs du cou, et les muscles proximaux des membres.
Causes
modifierLa mutation de plusieurs gènes est associée avec la maladie[1] : NEB, ACTA1, TPM3, TPM2, CFL2, TNNT1, KBTBD13, KLHL40, KLHL41[2] et LMOD3[3].
Les « némalines » sont des agrégats protéiques visualisés sous forme de bâtonnets dans les fibres musculaires.
Typologie
modifierIl existe six types de myopathie à némaline selon l'âge de début, la sévérité des troubles moteurs et l'atteinte des muscles respiratoires :
- La forme congénitale sévère ou néonatale (16 %) ;
- La forme type Amish ou congénitale intermédiaire (20 %) ;
- La forme congénitale typique (40 %) ;
- La forme de l'enfance (13 %) ;
- La forme de l'adulte (4 %).
Le chevauchement clinique est considérable. Mais il existe des différences de survie significative entre les formes sévères, intermédiaires et typiques. Dans la forme néonatale, la présence d'arthrogryposes multiples et de troubles respiratoires est associée avec une mortalité dans la première année de vie. L'acquisition de la marche avant 18 mois est un facteur pronostic important de survie. La plupart des enfants atteints de la forme congénitale typique sont capables de marcher.
Le diagnostic se fait sur la présence caractéristique de cellule à bâtonnet avec la coloration de Gomori. La transmission est dominante ou récessive. Le taux de mutation de novo est importante.
Notes et références
modifier- Romero NB, Sandaradura SA, Clarke NF, Recent advances in nemaline myopathy, Curr Opin Neurol, 2013;26:519–526
- Gupta VA, Ravenscroft G, Shaheen R et al. Identification of KLHL41 mutations implicates BTB-Kelch-mediated ubiquitination as an alternate pathway to myofibrillar disruption in nemaline myopathy, Am J Hum Genet, 2013;93:1108–1117
- Yuen M, Sandaradura SA, Dowling JJ et al. Leiomodin-3 dysfunction results in thin filament disorganization and nemaline myopathy, J Clin Invest, 2014
- (en) Kathryn North, Monique M Ryan, Nemaline Myopathy, Autosomal Dominant In GeneTests: Medical Genetics Information Resource (database online). Copyright, University of Washington, Seattle. 1993-2005 [1]