Microsporidia
Microsporidiomycota
| Règne | Fungi |
|---|
Classes de rang inférieur
- Chytridiopsidea Issi 1980
- Metchnikovellea Weiser 1977 em. Cavalier-Smith 1993
- Microsporidea Delphy 1936 em Levine & Corliss 1963, Levine et al., 1980
Les Microsporidies, Microsporidiomycota[1], anciennement Microsporidia, sont une division de champignons parasites intracellulaires obligatoires, appartenant au règne des Fungi.
Il semblerait qu'ils soient génétiquement très proches des Eumycètes dont ils dérivent peut-être par adaptation au parasitisme (Une hypothèse proposée par James & al. (2006) est que le groupe des microsporidia dériverait d'un ancêtre chytride endoparasite (proche de Rozella allomycis) appartenant à la première branche divergente de l'arbre phylogénétique des Fungi)[2]. La comparaison des régions de synténie avec d'autres champignons montre que les microsporidies seraient proches des Mucoromycotina. On en connaît maintenant 150 genres et 1200 espèces. Cependant, une nouvelle estimation du nombre d’espèces montre qu’il se pourrait que le nombre d’espèce de microsporidies atteigne le nombre d’espèces animales.
Les microsporidies présentent une adaptation caractérisée par la réduction. En effet les microsporidies sont réduites à beaucoup de niveaux par rapport aux autres eucaryotes ; au niveau du génome en premier lieu mais aussi au niveau de leur métabolisme (elles n'ont pas de mitochondries)[2].
Le génome de Encephalitozoon cuniculi a été entièrement séquencé. Ce parasite possède le génome eucaryote le plus petit connu à ce jour.
Histoire
modifierLa première description d’une microsporidie fut faite au milieu du XIXe siècle, quand la pébrine décimait les vers à soie. Cette maladie causée par Nosema bombycis fut identifiée par Karl Wilhelm von Nägeli en 1857[3]. Ce champignon semble avoir été signalé pour la première fois en 1849, avant l'identification de la pébrine, par Guérin-Méneville, qui croyait erronément que les vers à soie sur lesquels il l'observait étaient atteints de muscardine[4]. Après l'identification de la pébrine, Cornalia, Franz Leydig[5], Balbiani[6] et Pasteur[7] étudièrent son agent microbien (« corpuscules ») de façon plus approfondie. C’est ensuite Louis Pasteur qui eut l’idée de sélectionner les individus non infectés pour recréer de nouveaux élevages sains.
Pathologie
modifierLes Microsporidies parasitent de très nombreux Eucaryotes comme d'autres protistes, des Invertébrés, des Vertébrés dont l'humain. Elles infectent aussi certains protistes tels que des ciliés qui sont elles-mêmes des parasites. Ces parasites de parasites s’expliquent par le fait que ces 2 espèces infectaient précédemment le même hôte et qu’une des deux espèces s’est adaptée pour parasiter le voisin. Les espèces du genre Nosema sont très pathogènes pour les Insectes. Nosema bomycis attaque le ver à soie (la chenille du bombyx du murier), Nosema apis attaque l'abeille adulte. De nombreux microsporidies sont des pathogènes de poissons et de crustacés. Les espèces des genres Enterocytozoon et Encephalitozoon ont pour réservoir divers animaux et peuvent être pathogène opportuniste de l'humain, notamment chez les immunodéprimés. Chez l'humain, les microsporidies peuvent provoquer des troubles intestinaux ou oculaires et peuvent être détectées par un examen parasitologique des selles.
Bien que répandu chez tous les animaux, il semble que les microsporidies soient plus présentes chez les poissons et les arthropodes. Elles peuvent être utilisées comme agents biologiques de contrôle contre certains insectes mais peuvent aussi décimer certaines apicultures et aquacultures.
Il existe 13 espèces de microsporidies qui infectent l’humain, dont Encephalitozoon cuniculi. Beaucoup de maladies sont associées à ces parasites et la prévalence en Europe est de 8 %.
| Chez l’humain | Chez les rongeurs, les lagomorphes et les animaux domestiques | |
|---|---|---|
| Symptômes | Diarrhées chroniques, conjonctivites, pneumonies, bronchites, néphrites, hépatites, péritonites, atteintes du système nerveux, etc. | encéphalites granulomateuses, néphrites, infections chroniques menant à des infections granulomateuses de différents organes, torticolis, etc.[9] |
Structure
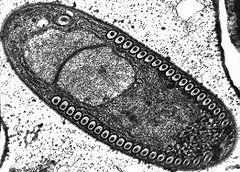
modifierLes microsporidies présentent une forme de résistance et de dissémination : la spore. La spore est le seul stade reconnaissable des microsporidies. C’est à ce stade que les espèces peuvent être différenciées et c’est le seul à être viable hors de la cellule hôte. La taille et la forme de la spore sont très conservés chez une même espèce.
La spore est entourée par une membrane plasmique classique ainsi que par deux parois extracellulaires rigides : exospore et endospore. L’exospore est faite d’une matrice glycoprotéique et fibreuse dense. L’endospore est composée de chitine alpha et d’autres protéines. Son épaisseur est assez uniforme sauf à l’apex où cette paroi est plus fine. À l’intérieur de la membrane se trouve le sporoplasme (cytoplasme de la spore) qui constitue le matériel infectieux. Il contient un seul noyau, il est riche en ribosomes et est occupé majoritairement par les trois structures nécessaires à l’infection :
- le polaroplaste ;
- le filament polaire ou tube polaire ;
- la vacuole postérieure
Le polaroplaste est une grande organisation de membrane occupant la partie antérieure de la spore. La portion antérieure du polaroplaste est hautement organisée sous forme de membranes empilées appelées polaroplaste lamellaire alors que la portion postérieure est moins organisée et est appelée polaroplaste vésiculaire. L’organite jouant le rôle le plus évident dans l’infection est le filament polaire (ou tube polaire). Dans le sporoplasme, il est composé de couche de glycoprotéines ; 0,1 à 0,2 µm de diamètre et 50 à 500 µm de long. Il est attaché à l’apex via une structure en parapluie appelée disque d’ancrage. Sur 1/3 de la spore ce filament est raide et hélicoïdal (le nombre de spires et leur angle sont conservés et permettent d’identifier certaines espèces). Ce filament se termine au niveau de la vacuole postérieure. Il semblerait qu’il y ait un contact physique entre ces 2 structures.
Infection et cycle de vie
modifierLe cycle se déroule en trois phases : la phase infectieuse, la phase de prolifération et la phase de différenciation.
La germination
modifierLa phase infectieuse commence par la germination des spores qui est un événement biologique assez surprenant. Cette germination commence par un environnement favorable ; ces conditions varient selon les espèces mais sont peu connues. Il peut s’agir d’une altération de pH, de déshydratation suivie d’une réhydratation, de la présence d’anions, de cations, d’UV, etc. Quand la germination commence, le premier signe est un grossissement de la spore et plus particulièrement du polaroplaste et de la vacuole postérieure. Il en résulte une forte augmentation de la pression osmotique. Cette augmentation de pression peut s’expliquer par deux mécanismes :
- les spores sont équipées d’aquaporines qui transportent l’eau vers l’intérieur du sporoplasme
- l’autre mécanisme fut suggéré quand on a constaté que le niveau de tréhalose augmente considérablement durant la germination. Ce sucre est un dimère de glucose et on suppose que sa dégradation augmente la molarité totale du sporoplasme et donc entraînerait l’entrée d’eau dans la cellule. (L’augmentation du niveau de tréhalose pourrait aussi jouer le rôle de métabolite anti-stress.)
Cependant on a constaté dans certaines espèces de microsporidies qu’il n’y avait pas de modification du niveau de tréhalose dans la cellule suggérant d’autres mécanismes pour l’entrée d’eau dans la spore durant la germination. Il existe une dernière hypothèse faisant intervenir la concentration de calcium dans l’influx d’eau et rôle de la calmoduline : la présence d’ions calcium améliore l’extrusion du tube polaire. Le début de dégradation de la membrane pourrait entraîner un afflux d’ions calcium dans le sporoplasme et ces ions induiraient l’influx d’eau mais aussi activeraient des enzymes telles que les tréhalases. Quoi qu’il en soit, l’augmentation de la pression osmotique entraîne la rupture du disque d’ancrage et la projection du filament polaire par éversion (ou dévagination : l'intérieur du tube passe à l'extérieur, comme retourner le doigt d’un gant sur lui-même). Cette éversion commence à l’apex, où le filament polaire casse la paroi au niveau où elle est la plus fine. Le filament devient un tube et l’intérieur passe à l’extérieur. C’est un évènement très rapide durant moins de 2 secondes et dont la vitesse est difficile à estimer. Le tube polaire mesure alors entre 50 et 500 µm (100 fois la taille de la spore) et le bout du tube peut aller à une vitesse de 100 µm/s. Ce tube sert donc de projectile et si une cellule est à côté, il peut transpercer la membrane plasmique. Une fois que le tube est totalement sorti, la pression osmotique résiduelle force le sporoplasme à passer dans le tube, qu’il parcourt en seulement 15 à 500 ms (notez la très forte déformation du sporoplasme). Ainsi le sporoplasme émerge directement dans le cytoplasme de la cellule hôte, il n’y a donc plus de reconnaissance en tant que corps étranger. La spore vide est abandonnée alors que le sporoplasme émerge dans la cellule avec une nouvelle membrane issue de la membrane du polaroplaste.
Phase proliférative ou schizogonie
modifierLa durée d’évolution du cycle est toujours brève, 24 à 48h, mais elle est liée à plusieurs facteurs extrinsèques : la température ambiante, qui influe sur le nombre de spores obtenues, ou les tissus de l’hôte.
Une fois dans la cellule-hôte, le sporoplasme déposé se divise par scission binaire (mérogonie), parfois à l’intérieur d’une vacuole parasitophore (comme dans le cas d’Encephalitozoon cuniculi), en formes prolifératives (mérontes) avec une simple membrane plasmique. Ces mérontes possèdent de petits ribosomes proches de ceux des procaryotes et des organites parsemées. Le parasite induit certains changements non délétères chez l’hôte. Souvent la cellule se réorganise autour du parasite et tous les organites sont autour de lui.
Phase de différenciation ou sporogonie
modifierIl s’agit de la formation des spores. Durant cette phase il y a une augmentation du réticulum endoplasmique et du nombre de ribosomes qui se regroupent en polyribosome. Le développement du sporonte consiste en plusieurs divisions et un développement du système d’extrusion (filament polaire, polaroplaste, vacuole postérieure). L'appareil de golgi donnerait naissance au filament polaire et le réticulum endoplasmique aux membranes du polaroplaste. Quand la maturité approche, la paroi de chitine de l’endospore se développe. L’élargissement de la vacuole parasitophore et/ou de la cellule hôte par les parasites conduit à la rupture de la cellule-hôte et au relargage des spores dans l'espace extracellulaire. Il y a ensuite libération de la spore complète qui va ensuite soit infecter le même hôte ou alors être transportée vers un autre hôte (via le système digestif). Les moyens de dissémination sont les urines, les fèces, la décomposition…
Métabolisme
modifierLes microsporidies sont des organismes anaérobies dénués de mitochondries, permettant l'oxydation des composés organiques. À la place, ils possèdent un organite appelé mitosome.
La difficulté des études biochimiques est due à leur mode de vie intracellulaire obligatoire. Concernant le métabolisme de base des microsporidies, on sait maintenant que ces parasites, ne possédant pas de cycle de Krebs, importent l’ATP de l’hôte. Cependant, elles produisent des acides lactiques et pyruviques et possèdent des enzymes impliquées dans la glycolyse, la voie des pentoses-phosphates et la voie de biosynthèse du tréhalose (et aussi pour sa dégradation. Contrairement aux êtres sans mitochondrie, les microsporidies ont une PDH (pyruvate déshydrogénase) et non une PFOR (pyruvate:ferrédoxine oxydoréductase). En revanche, la PDH aurait un rôle particulier dans les microsporidies car elle fonctionne avec uniquement la sous-unité E1 : elle utilise directement l’intermédiaire HETPP pour transférer les électrons à la ferodoxine. Il y a une autre différence avec les autres êtres sans mitochondrie : la phosphofructokinase serait ATP-dépendante comme chez les champignons au lieu d’être pyrophosphate dépendante.
Le fait que les microsporidies possèdent une HSP70 et une PDH et les données du génome d’Encephalitozoon cuniculi démontrent bien qu’elles dérivent d’un champignon possédant une mitochondrie.
Microsporidies hyperparasites
modifierLes microsporidies peuvent infecter de nombreux hôtes, parmi lesquels certains sont eux-mêmes des parasites. Dans ces cas, la microsporidie est un hyperparasite, c'est-à-dire un parasite de parasite. On connaît par exemple 18 espèces qui parasitent les digènes (un groupe de Plathelminthes parasites). Ces digènes sont eux-mêmes parasites de vertébrés et de mollusques. Huit de ces espèces appartiennent au genre Nosema[10]. De la même manière, la microsporidie Toguebayea baccigeri est hyperparasite du trématode digène Bacciger israelensis (Faustulidae), lui-même un parasite intestinal du bogue, Boops boops (Teleostei, Sparidae)[11].
Origines et évolution
modifierD’abord classé dans les schizomycètes (sorte de « fourre-tout » pour les bactéries, levures…) ces parasites ont vu la création d’un nouveau groupe, les microsporidies, par Édouard-Gérard Balbiani en 1882.
La place des microsporidies dans l’évolution a souvent changé depuis leur description au milieu du XIXe siècle. Elles ont d’abord été classées comme des « yeast-like fungus » puis, considérant leur mode d’infection unique, elles ont été exclues du groupe des champignons sans pour autant être rattachées à un autre groupe d’eucaryotes.
Au fil des observations et classifications, elles ont été classées comme parasite, levure, etc.
C’est en 1983 que s’est posé une nouvelle fois l’attention de biologistes sur ces microsporidies. On les a alors considérées comme des eucaryotes primitifs puisqu’elles ne possèdent pas de mitochondrie, elles auraient alors divergé avant l’endosymbiose à l’origine des mitochondries.
De plus les premières observations de phylogénie moléculaires ont montré que les microsporidies possédaient un ARN ribosomique 5.8 S fusionné avec l'équivalent de l’ARN 28S donnant ainsi un 23S comme chez les procaryotes. De même, plusieurs délétions sont présentes dans les ARNr en comparaison avec les ARNr conservées d’autres eucaryotes et procaryotes.
Cependant, cette hypothèse a été remise en cause lors de la découverte de séquences nucléotidiques microsporidiales homologues aux gènes codant des protéines mitochondriales et d’autre analyses comme la phylogénie des tubulines alpha et beta ont montré qu’elles appartenaient au même groupe que les champignons. Le séquençage du génome d'Encephalitozoon cuniculi a confirmé cette hypothèse.
Concernant l’absence de mitochondrie, la présence de gène mitochondriaux prouve que les microsporidies en possédaient une mais qu’elle a été perdue.
De nos jours les microsporidies sont considérées comme des champignons évolués proches des Mucoromycotina et très spécialisés dans le parasitisme et que leur simplicité apparente est due à une évolution réductrice causée par leur mode de vie particulier.
Liste des ordres, sous-ordres et non classés
modifierSelon NCBI (24 juin 2013)[12] :
- sous-ordre des Apansporoblastina
- sous-ordre des Pansporoblastina
- non classé Microsporidia incertae sedis
- ordre des Crustaceacida
Voir aussi
modifierNotes et références
modifier- V. Robert, G. Stegehuis and J. Stalpers. 2005. The MycoBank engine and related databases. https://www.mycobank.org/, consulté le 24 juin 2013
- James, T. Y., Kauff, F., Schoch, C. L., Matheny, P. B., Hofstetter, V., Cox, C. J., ... & Spotts, R. A. (2006). Reconstructing the early evolution of Fungi using a six-gene phylogeny. Nature, 443(7113), 818-822.
- Nägeli K.W., « Ueber die neue krankheit der Seidenraupe und verwandte organismen. », Bot. Z. 1857; 15:760-761.
- Guérin-Méneville, « Études sur les maladies des vers à soie (...) », Bulletin de la Société nationale et centrale d'agriculture de France, 2e sér., V, 1849-1850, p. 251-259. Voir Classic Encyclopedia, article « Silk », d'après l'Encyclopaedia Britannica de 1911. Sur la découverte des corpuscules de la pébrine par Guérin-Méneville en 1849, voir aussi L. Pasteur, Études sur la maladie des vers à soie, 1870, Œuvres complètes de L. Pasteur, t. 4, pp. 29-32, consultable sur Gallica.
- Leydig (Fr.) « Ueber Parasiten niederer Thiere », Archiv für pathologische Anatomie und Physiologie (Virchow), XIII, 1858, p. 280-282; id., Naturgeschichte der Daphniden (crustacea cladocera), Tübingen, 1860. (Cités par L. Pasteur, Études sur la maladie des vers à soie, Paris, 1870, Œuvres complètes de Pasteur, t. 4, p. 35, consultable sur Gallica.)
- Voir notamment Balbiani, « Recherches sur les corpuscules de la pébrine et sur leur mode de propagation », Comptes rendus de l'Académie des Sciences, séance du 27 août 1866, vol. 63 (1866), pp. 388-391.
- Voir le t. 4 de ses Œuvres complètes.
- Winters, A. D., Faisal, M. 2014. Molecular and ultrastructural characterization of Dictyocoela diporeiae n. sp. (Microsporidia), a parasite of Diporeia spp. (Amphipoda, Gammaridea). Parasite, 21, 26 DOI 10.1051/parasite/2014028
- « Séroprévalence d’Encephalitozoon cuniculi chez le lapin de compagnie en Région Parisienne », École nationale vétérinaire d’Alfort, (lire en ligne)
- Toguebaye, B. S., Quilichini, Y., Diagne, P. M. & Marchand, B. 2014: Ultrastructure and development of Nosema podocotyloidis n. sp. (Microsporidia), a hyperparasite of Podocotyloides magnatestis (Trematoda), a parasite of Parapristipoma octolineatum (Teleostei). Parasite, 21, 44. DOI 10.1051/parasite/2014044
- Jordi Miquel, Hichem Kacem, Edgar Baz-González, Pilar Foronda et Bernard Marchand, « Ultrastructural and molecular study of the microsporidian Toguebayea baccigeri n. gen., n. sp., a hyperparasite of the digenean trematode Bacciger israelensis (Faustulidae), a parasite of Boops boops (Teleostei, Sparidae) », EDP Sciences, vol. 29, , p. 2 (ISSN 1776-1042, DOI 10.1051/parasite/2022007)
- NCBI, consulté le 24 juin 2013
Références taxinomiques
modifierOrdre des Microsporidia
modifier- (en) Référence MycoBank : Microsporidia (consulté le )
- (en) Référence NCBI : Microsporidia (taxons inclus) (consulté le )
- (en) Référence Tree of Life Web Project : Microsporidia (consulté le )
Division des Microsporidiomycota
modifier- (en) Référence Index Fungorum : Microsporidiomycota Benny (consulté le )
- (en) Référence MycoBank : Microsporidiomycota Benny (consulté le )
Bibliographie
modifier- Murray Wittner et Louis M. Weiss (dir.), The Microsporidia and Microsporidiosis, ASM Press, 1999, (ISBN 1555811477)
- Keeling PJ, Fast NM. Microsporidia: biology and evolution of highly reduced intracellular parasites., Annu Rev Microbiol, 2002; 56:93-116. Epub 2002 Jan 30.
- Stentiford, G. D., Feist, S. W., Stone, D. M., Bateman, K. S., & Dunn, A. M. (2013). Microsporidia: diverse, dynamic, and emergent pathogens in aquatic systems. Trends in parasitology, 29(11), 567-578.