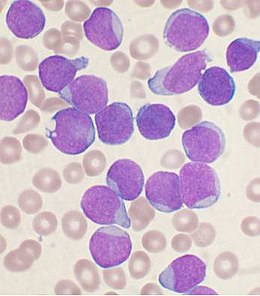
Leucémie aiguë lymphoblastique
La leucémie aiguë lymphoblastique (LAL) est un type de cancer et de leucémie provoquée par la multiplication de lymphocytes défaillants dans la moelle osseuse appelés blastes.
| Symptômes | Fièvre, asthénie, fatigue, amaigrissement, anorexie, douleur osseuse (en), douleur abdominale et dyspnée |
|---|
| Traitement | Transfusion sanguine, immunothérapie et transplantation de cellules souches hématopoïétiques |
|---|---|
| Médicament | Téniposide |
| Spécialité | Oncologie |
| CIM-10 | C91.0 |
|---|---|
| CIM-9 | 204.0 |
| ICD-O | M9835/3 |
| OMIM | et 613065 247640 et 613065 |
| DiseasesDB | 195 |
| MedlinePlus | 000541 |
| eMedicine |
207631 ped/2587 |
| MeSH | D054198 |
Elle affecte essentiellement les enfants; comme son nom « aiguë » l'indique, elle apparaît brutalement, avec seulement quelques jours ou semaines entre les premiers symptômes et le diagnostic, le traitement pouvant alors débuter dans les jours ou les heures qui suivent le diagnostic[1] .
Ce sont des leucocytes (globules blancs) dont le développement s'est bloqué à un stade immature ; ces cellules sont donc dans l'incapacité de protéger le sujet contre les corps étrangers, ce que font toutes les cellules normales de notre système immunitaire. En l'absence de traitements, les blastes vont proliférer, envahir la moelle osseuse, et tous les autres organes.
C'est une maladie rare (moins 300 nouveaux cas par an en France[1]) dont les causes sont encore inconnues. Elle n'est pas contagieuse, ni transmissible et ni héréditaire. Elle peut survenir à tout âge, chez le nourrisson comme chez la personne âgée, avec de fréquentes périodes de rémission chez l'enfant[2].
On parle de leucémies aiguës lymphoblastiques (LAL) en présence de plus 20 % de cellules blastiques, exprimant des molécules membranaires B ou T (1)[3].
Symptomatologie
modifierLa leucémie aiguë lymphoblastique peut présenter des symptômes spécifiques, mais non systématique
Cependant, étant donné que le système immunitaire produit des lymphocytes atrophiés et qu'il a besoin de lymphocytes viables, il puise dans les réserves du corps pour pouvoir en produire ce qui provoque rapidement les symptômes suivants :
- fatigue ;
- anémie ;
- perte de poids et d'appétit ;
- essoufflement ;
- palpitations ;
- douleurs osseuses ;
- augmentation de la taille de la rate[1] ;
- gonflement des ganglions (les ganglions étant le lieu de réunion des lymphocytes en vue de la purification de la lymphe avant son retour dans le sang, ils se remplissent de lymphoblastes et gonflent) ;
A l'accumulation de blaste dans le sang suite aux manques de lymphocytes fiable :
- fièvre et infection fréquentes sans raison connue ;
- apparition de saignements (de nez, des gencives, des muqueuses) et d'hématomes nombreux et apparaissant au moindre choc (à la suite de la chute du nombre des plaquettes (thrombopénie)[1].
Dans de rare cas; les blastes envahissent le liquide céphalo-rachidien avec une éventuelle atteinte des nerfs et/ou des méninges[1].
Causes
modifierElles sont encore inconnues. Aucune cause environnementale certaine n'a été identifiée et, selon les données disponibles, la cause n'est pas non plus directement infectieuse (au contraire, les maladies bénignes de l'enfant semblent protéger des leucémies[4]).
Traitements
modifierLes malades sont soignés par chimiothérapie et parfois par greffe de cellules souches hématopoïétiques (allogreffe[5]).
Les cellules Jurkat sont fréquemment utilisées comme modèle en recherche scientifique pour ce type de leucémie[6]. Un traitement basé sur le Transfert adoptif de cellules s'est avéré à ce jour comme la méthode obtenant le taux de guérison le plus durable[7],[8],[9].
En , le premier traitement à base de CAR a été approuvé par la FDA américaine[10] pour le traitement des leucémies aiguës lymphoblastiques chez l'enfant et les jeunes adultes[11]. Lors des essais cliniques, 79 % des patients traités avaient survécu 12 mois après traitement. Le coût du traitement appelé Kymriah et produit par Novartis s'élève à 475 000 dollars américains et n'est facturé qu'en cas de réussite du traitement[11].
Erytech Pharma réalise des études cliniques concernant l'encapsulation de l'Asparaginase dans des globules rouges pour traiter la maladie.
Des essais précliniques du lusvertikimab, un antagoniste du récepteur de l'interleukine 7, suggèrent une efficacité contre la LAL CD127+ (en particulier en combinaison avec une polychimiothérapie),[12].
Pronostic
modifierAvant que des traitements efficaces ne soient disponibles, le diagnostic de leucémie aiguë lymphoblastique signifiait pratiquement une condamnation à mort pour les patients concernés. En fonction du stade de la maladie, les patients décédaient dans les jours ou les semaines suivant le diagnostic. Les principales causes de décès étaient des infections graves dues à l'immunodéficience sévère, des hémorragies spontanées dues à la thrombocytopénie ou d'autres complications, notamment en cas d'atteinte du système nerveux central. Même à la fin des années 70, lorsque plusieurs agents chimiothérapeutiques efficaces étaient disponibles, le taux de survie moyen à 5 ans des patients adultes atteints en Allemagne était inférieur à 15%. Les résultats étaient meilleurs chez les enfants.
En 2023, la probabilité d'atteindre une rémission complète initiale est de ≥ 95% chez l'enfant et de 70 à 90% chez l'adulte[13]. Pour les enfants, plus de 80% des cas présentent une rémission persistante pendant 5 ans et sont considérés comme guéris[13]. En revanche, chez les adultes, moins de 50% ont une survie à long terme[13].
Notes et références
modifier- fiche d'information des patients, rédigée par les médecins de la Société Française d’Hématologie (mars 2009)
- Mathé G, Hayat M, Schwarzenberg L, Amiel JL, Schneider M, Cattan A, ... & Jasmin C (1968) Haute fréquence et qualité des rémissions de la leucémie aiguë lymphoblastique chez l'enfant. Arch. franç. Pédiat, 25, 181-188.
- Maarouf, N., Carli, P. M., Maynadié, M., & Troussard, X. (2007). Leucémie aiguë lymphoblastique. In Survie des patients atteints de cancer en France (pp. 347-354). Ed : Springer Paris (résumé)
- « Les résultats évoquent à nouveau le rôle protecteur des infections banales précoces et de la mise précoce en collectivité dans les leucémies, notamment pour les infections broncho-pulmonaires et les gastroentérites. Les vaccinations, obtenues en détail par le carnet de santé, n'étaient pas associées à la survenue de leucémie. Nous avons à nouveau observé une association entre l'utilisation maternelle d'insecticides pendant la grossesse et les leucémies avec la présence mitoyenne de stations-service et avec la proximité de routes à grande circulation. » source : Jacqueline Clavel (), résumé : ESCALE - Étude cas-témoins Sur les Cancers et les Leucémies de l'Enfant, collaboration : SFCE pediatric onco-hematological teams, pediatric neurosurgery teams, Biological resources center Epigenetec (INSERM U775, Mark Lathrop (CNG), CSA, Geocible
- « Tout savoir sur le don | Don de Moelle Osseuse », sur www.dondemoelleosseuse.fr (consulté le )
- (en) Ulrich Schneider, Hans-Ulrich Schwenk et Georg Bornkamm, « Characterization of EBV-genome negative “null” and “T” cell lines derived from children with acute lymphoblastic leukemia and leukemic transformed non-Hodgkin lymphoma », International Journal of Cancer, vol. 19, , p. 621–626 (ISSN 1097-0215, DOI 10.1002/ijc.2910190505, lire en ligne, consulté le )
- "ASCO 2016 : les CAR T-cells, serial killers des cellules cancéreuses "
- "T Cell Therapy for Acute Lymphoblastic Leukemia: Results as of November 2013"
- "Fevrier 2016: Hutch"
- (en) Heidi Ledford, « Engineered cell therapy for cancer gets thumbs up from FDA advisers », Nature, vol. 547, no 7663, , p. 270–270 (DOI 10.1038/nature.2017.22304, lire en ligne, consulté le )
- (en) Emily Mullin, « A pioneering gene therapy for leukemia has arrived in the U.S. », MIT Technology Review, (lire en ligne, consulté le )
- (en) Lennart Lenk, Irène Baccelli, Anna Laqua et Julia Heymann, « The IL-7R antagonist lusvertikimab reduces leukemic burden in xenograft ALL via antibody-dependent cellular phagocytosis », Blood, vol. 143, no 26, , p. 2735–2748 (ISSN 0006-4971 et 1528-0020, PMID 38518105, PMCID PMC11251409, DOI 10.1182/blood.2023021088, lire en ligne, consulté le )
- « Leucémie lymphoblastique aiguë - Hématologie et oncologie », sur Édition professionnelle du Manuel MSD (consulté le )
Voir aussi
modifierArticles connexes
modifierLiens externes
modifier- fiche d'information des patients, rédigée par les médecins de la Société Française d’Hématologie ()
Bibliographie
modifier- Ayraud N, Dujardin P & Audoly P (1975) Leucémie aiguë lymphoblastique avec chromosome Philadelphie. Nouv Presse Med, 4, 3013.
- de Botton S (2004) Leucémies aiguës lymphoblastiques. Hématologie, 10(1), 26-32.
- Huguet F (2008). Leucémies aiguës lymphoblastiques. Hématologie, 13(1), 38-44.
- Hoerni BH, Vital C & Bonnaud E (1972) Leucémie aiguë lymphoblastique chez un sujet atteint d’ataxie-télangiectasie. Acta Haematologica, 47(4), 250-254.
- Lara D. & Gauthier M (2001) Leucémies aiguës lymphoblastiques. Hématologie, 1(1), 0-0 ([résumé]).
- Mathieu-Mahul D, Bernheim A, Sigaux F, Daniel M.T, Larsen CJ & Berger R (1986) Translocation t (1; 14) et remaniement du gène de la chaîne alpha du récepteur T dans une leucémie aiguë lymphoblastique T. Comptes rendus de l'Académie des sciences. Série 3, Sciences de la vie, 302(14), 525-528.
- Rigal-Huguet F (2006) Leucémies aiguës lymphoblastiques. Hématologie, 12(2), 34-38.
- Zultak M, Blanc D, Merle C, Maíngon P & Rosenbaum A (1989) Erythème annulaire centrifuge et leucémie aiguë myéloblastique. In Annales de dermatologie et de vénéréologie (Vol. 116, No. 6-7, pp. 477-480) (notice Inist-CNRS)