Isorénieratène
L'isorénieratène est un pigment photosynthétique caroténoïde produit exclusivement par le genre Chlorobium, qui sont les souches de couleur brune de la famille des bactéries vertes sulfureuses (Chlorobiaceae)[4]. Les bactéries vertes sulfureuses sont des organismes photoautotrophes anaérobies, ce qui signifie qu'elles effectuent la photosynthèse en l'absence d'oxygène en utilisant du sulfure d'hydrogène dans la réaction suivante :
| Isorénieratène | ||

| ||
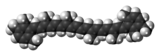 | ||
| Structure de l'isorénieratène | ||
| Identification | ||
|---|---|---|
| Nom UICPA | φ,φ-Carotène[1] | |
| Synonymes |
1,2,4-trimethyl-3-[(1E,3E,5E,7E,9E,11E,13E,15E,17E)-3,7,12,16-tétraméthyl-18-(2,3,6-trimethylphenyl)octadeca-1,3,5,7,9,11,13,15,17-nonaenyl]benzene |
|
| No CAS | ||
| PubChem | 9984420 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C40H48 |
|
| Masse molaire[3] | 528,809 1 ± 0,035 4 g/mol C 90,85 %, H 9,15 %, |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
H2S + CO2 → SO2–
4 + composés organiques
Une telle photosynthèse anoxygénique (en) nécessite une réduction du soufre et de la lumière ; ainsi, ce métabolisme ne se produit que dans des environnements strictement photiques et euxiniques. Par conséquent, la découverte de l'isoréniératène et de ses dérivés dans les sédiments et les roches sont des biomarqueurs utiles pour identifier les colonnes d'eau euxiniques dans la zone photique[5],[6].
Structure
modifierL'isoréniératène a la formule chimique C40H48[7]. Il s'agit d'un caroténoïde diaromatique avec une chaîne isoprénoïde régulièrement liée, à l'exception d'une seule liaison queue à queue au milieu de la molécule. L'isoréniératène présente un motif de substitution caractéristique 1-alkyl-2,3,6-triméthyle sur les cycles aromatiques, ce qui permet d'identifier la molécule. Les neuf liaisons doubles conjuguées sur le squelette isoprénoïde sont toutes dans la configuration trans et rendent la molécule très réactive avec les espèces soufrées inorganiques réduites[8]. La molécule est hydrophobe et insoluble dans l’eau, comme la plupart des autres caroténoïdes. L'isoréniératène est généralement non toxique.
Sources biologiques
modifierL'isorénieratène a été découvert pour la première fois lorsqu'il a été isolé de l'éponge de couleur orange Reniera japonica[9]. Les éponges marines sont brillamment colorées en raison de la présence de plusieurs caroténoïdes et de leur association avec des symbiotes tels que des bactéries ou des algues. Par conséquent, on suppose que l’isoréniératène dans les éponges provient de la symbiose entre les éponges et les bactéries vertes sufureuses (Chlorobiaceae)[10].
Les bactéries vertes sulfureuses vivent dans des environnements euxiniques, souvent au niveau de la chimiocline, où le flux lumineux est présent mais faible. Pour augmenter leur efficacité métabolique, ils ont développé un chlorosome, une antenne liée à une membrane contenant la bactériochlorophylle c, d ou e[11]. La souche de couleur brune des Chlorobiaceae contient de la bactériochlorophylle dans son chlorosome, qui produit principalement de l'isoréniératène. On suppose que l'isoréniératène et d'autres caroténoïdes apparentés sont des adaptations qui aident les organismes à vivre dans des conditions de faible luminosité[11]. Les bactéries vertes sulfureuses fixent le carbone via le cycle inverse de l'acide tricarboxylique, ce qui entraîne que la biomasse produite, y compris l'isoréniératène, est anormalement enrichie en carbone 13 (13C) par rapport aux autres biomasses d'algues d'environ 15 par mil[12]. Le δ13C de la biomasse des bactéries vertes sulfureuses se situe entre –9 et –21 par mil. L'isoréniératène est relativement rare mais revêt une grande importance lorsqu'il est rencontré. Il s'agit d'un indicateur puissant des conditions euxiniques dans la zone photique, tant aujourd'hui que dans les archives géologiques.
Répartition environnementale
modifierLa combinaison des conditions dans lesquelles vivent les bactéries vertes sulfureuses et, par conséquent, où se trouve l'isoréniératène, est aujourd'hui limitée. La plupart de ces emplacements sont des bassins d'eau restreints avec des eaux hautement stratifiées, permettant le développement d'anoxie dans les couches inférieures et l'accumulation de H2S. La mer Noire est l'un de ces bassins d'eau où l'interface du sulfure d'hydrogène, ou chimiocline, s'est déplacée vers le haut dans la zone photique, et où l'on trouve de fortes concentrations de bactéries vertes sulfureuses et d'isoréniératène[13]. D'autres environnements modernes comprennent les lacs méromictiques, les fjords restreints et certains milieux marins. Il a été démontré que les bactéries vertes sulfureuses jouent un rôle dans les écosystèmes coralliens et qu'elles vivent sur les coraux et les éponges en tant que symbiotes possibles[14].
Plusieurs cas ont été trouvés où les bactéries vertes sulfureuses avec la bactériochlorophylle e sont abondantes, mais aucun isoréniratène n'a été documenté. Des bactéries vertes sulfureuses se sont avérées vivre près d'un évent hydrothermal profond au large des côtes du Mexique[15] ; cependant, les bactéries ne font plus de photosynthèse à cette profondeur et aucun isoréniatène n’a été isolé. Dans le lac Vert (en) de Fayetteville dans l'État de New York, les bactéries vertes sulfureuses et la bactériochlorophylle étaient abondantes sous la chimiocline, mais les sédiments manquaient d'isorénieratène[16]. Ces absences inattendues d’isoréniératène nécessitent une exploration continue de l’écologie microbienne de la production de biomarqueurs dans les environnements modernes.
Conservation et mesure
modifierL'isoréniératène est généralement mal conservé car sa structure est susceptible d'être altérée et dégradée. Lors de la diagenèse et de la catagenèse (en), l'isoréniératène peut être transformé et produire divers produits apparentés qui indiquent encore l'euxinia de la zone photique dans l'environnement de dépôt[17]. Les deux principaux processus de transformation sont la saturation des doubles liaisons pour former l'isoréniératane et la rupture de la chaîne carbonée aboutissant à des fragments moléculaires plus petits. D'autres altérations incluent la sulfuration, la cyclisation et l'aromatisation[17].
Utilisation comme biomarqueur
modifierBien que les conditions euxiniques soient rares aujourd'hui, au début de l'histoire de la Terre (en), on pensait que ces conditions étaient présentes dans tous les océans à des profondeurs d'environ 100 mètres. La détection d'isoréniératène et de bactéries vertes sulfureuses au milieu du Protérozoïque a été utilisée comme preuve des conditions euxiniques à long terme qui subsistent dans les océans après la Grande Oxydation. Par exemple, la formation de Barney Creek, âgée de 1,64 milliards d'années, dans le nord de l'Australie, héberge de nombreux biomarqueurs, notamment l'isoréniératène, qui signifient que ces roches ont été déposées dans un bassin marin aux eaux profondes anoxiques, sulfurées et hautement stratifiées avec des colonies de bactéries vertes et pourpres sulfureuses[18].
Des dérivés de l'isoréniératène ont été identifiés dans les roches sédimentaires du Paléozoïque et du Mésozoïque, ce qui signifie que la photosynthèse anoxygénique était un processus plus courant dans le passé[19]. Des dérivés de l'isoréniératène ont également été isolés de nombreuses roches mères pétrolières, ce qui suggère que les conditions euxiniques et l'anoxie sont favorables à la préservation de la matière organique, conduisant à la formation de réservoirs pétroliers[19]. De plus, la détection de dérivés de l'isoréniératène lors d'extinctions massives signifie que des conditions euxiniques peuvent être courantes lors de tels événements. Par exemple, l'isolement de l'isoréniératène à partir d'unités rocheuses déposées lors de l'extinction de masse Permien-Trias, l'extinction de masse la plus meurtrière sur Terre, a été utilisée comme preuve de plusieurs impulsions d'euxinisme de la zone photique répandue avant et pendant l'événement d'extinction[20].
Notes et références
modifier- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Isorenieratene » (voir la liste des auteurs).
- (en) Royal Society of Chemistry, « Isorenieratene », sur ChemSpider, (consulté le ).
- (en) National Center for Biotechnology Information, « Isorenieratene », sur United States National Library of Medicine, (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Jaap S Sinninghe Damsté, Stefan Schouten et Adri C. T van Duin, « Isorenieratene derivatives in sediments: possible controls on their distribution », Geochimica et Cosmochimica Acta, vol. 65, no 10, , p. 1557–1571 (ISSN 0016-7037, DOI 10.1016/S0016-7037(01)00549-X, Bibcode 2001GeCoA..65.1557S, lire en ligne).
- Pierre Caumette, Développement des bactéries phototrophes et des bactéries sulfato-réductrices dans des lagunes peu profondes et des lagunes stratifiées : Étude de leur rôle dans le cycle du soufre et dans la production de biomasse, Marseille, Université de Droit, d'Économie et des Sciences d'Aix-Marseille, , 336 p. (lire en ligne).
- (en) Martin P. Koopmans, Jürgen Köster, Heidy M. E. Van Kaam-Peters, Fabien Kenig, Stefan Schouten, Walter A. Hartgers, Jan W. de Leeuw et Jaap S. Sinninghe Damsté, « Diagenetic and catagenetic products of isorenieratene: Molecular indicators for photic zone anoxia », Geochimica et Cosmochimica Acta, vol. 60, no 22, , p. 4467–4496 (ISSN 0016-7037, DOI 10.1016/S0016-7037(96)00238-4, Bibcode 1996GeCoA..60.4467K, hdl 1874/4280, S2CID 95423218, lire en ligne).
- (en) Masaru Yamaguchi, « Chemical Constitution of Isorenieratene », Bulletin of the Chemical Society of Japan, vol. 31, no 1, , p. 51–55 (ISSN 0009-2673, DOI 10.1246/bcsj.31.51).
- (en) Martin P. Koopmans, Jürgen Köster, Heidy M. E. Van Kaam-Peters, Fabien Kenig, Stefan Schouten, Walter A. Hartgers, Jan W. de Leeuw et Jaap S. Sinninghe Damsté, « Diagenetic and catagenetic products of isorenieratene: Molecular indicators for photic zone anoxia », Geochimica et Cosmochimica Acta, vol. 60, no 22, , p. 4467–4496 (ISSN 0016-7037, DOI 10.1016/S0016-7037(96)00238-4, Bibcode 1996GeCoA..60.4467K, hdl 1874/4280, S2CID 95423218, lire en ligne).
- (en) Masaru Yamaguchi, « Chemical Constitution of Isorenieratene », Bulletin of the Chemical Society of Japan, vol. 31, no 1, , p. 51–55 (ISSN 0009-2673, DOI 10.1246/bcsj.31.51).
- (en) Yasin Genç, Hilal Bardakci, Çiğdem Yücel, Gökçe Şeker Karatoprak, Esra Küpeli Akkol, Timur Hakan Barak et Eduardo Sobarzo-Sánchez, « Oxidative Stress and Marine Carotenoids: Application by Using Nanoformulations », Marine Drugs, vol. 18, no 8, , p. 423 (ISSN 1660-3397, PMID 32823595, PMCID 7459739, DOI 10.3390/md18080423).
- (en) Julia A. Maresca, Steven P. Romberger et Donald A. Bryant, « Isorenieratene Biosynthesis in Green Sulfur Bacteria Requires the Cooperative Actions of Two Carotenoid Cyclases », périodique of Bacteriology, vol. 190, no 19, , p. 6384–6391 (ISSN 0021-9193, PMID 18676669, PMCID 2565998, DOI 10.1128/JB.00758-08).
- (en) Martin P. Koopmans, Jürgen Köster, Heidy M. E. Van Kaam-Peters, Fabien Kenig, Stefan Schouten, Walter A. Hartgers, Jan W. de Leeuw et Jaap S. Sinninghe Damsté, « Diagenetic and catagenetic products of isorenieratene: Molecular indicators for photic zone anoxia », Geochimica et Cosmochimica Acta, vol. 60, no 22, , p. 4467–4496 (ISSN 0016-7037, DOI 10.1016/S0016-7037(96)00238-4, Bibcode 1996GeCoA..60.4467K, hdl 1874/4280, S2CID 95423218, lire en ligne).
- (en) Evelyn Marschall, Mareike Jogler, Uta Henßge et Jörg Overmann, « Large-scale distribution and activity patterns of an extremely low-light-adapted population of green sulfur bacteria in the Black Sea: Green sulfur bacteria in the Black Sea », Environmental Microbiology, vol. 12, no 5, , p. 1348–1362 (PMID 20236170, DOI 10.1111/j.1462-2920.2010.02178.x, lire en ligne).
- (en) Shan-Hua Yang, Sonny T. M. Lee, Chang-Rung Huang, Ching-Hung Tseng, Pei-Wen Chiang, Chung-Pin Chen, Hsing-Ju Chen et Sen-Lin Tang, « Prevalence of potential nitrogen-fixing, green sulfur bacteria in the skeleton of reef-building coral Isopora palifera: Endolithic bacteria in coral skeletons », Limnology and Oceanography, vol. 61, no 3, , p. 1078–1086 (DOI 10.1002/lno.10277, S2CID 87463811).
- (en) J. Thomas Beatty, Jörg Overmann, Michael T. Lince, Ann K. Manske, Andrew S. Lang, Robert E. Blankenship, Cindy L. Van Dover, Tracey A. Martinson et F. Gerald Plumley, « An obligately photosynthetic bacterial anaerobe from a deep-sea hydrothermal vent », Proceedings of the National Academy of Sciences, vol. 102, no 26, , p. 9306–9310 (ISSN 0027-8424, PMID 15967984, PMCID 1166624, DOI 10.1073/pnas.0503674102, Bibcode 2005PNAS..102.9306B).
- (en) K. M. Meyer, J. L. Macalady, J. M. Fulton, L. R. Kump, I. Schaperdoth et K. H. Freeman, « Carotenoid biomarkers as an imperfect reflection of the anoxygenic phototrophic community in meromictic Fayetteville Green Lake: Biomarkers of anoxygenic phototrophs », Geobiology, vol. 9, no 4, , p. 321–329 (PMID 21682840, DOI 10.1111/j.1472-4669.2011.00285.x, S2CID 19668364, lire en ligne).
- (en) Martin P. Koopmans, Jürgen Köster, Heidy M. E. Van Kaam-Peters, Fabien Kenig, Stefan Schouten, Walter A. Hartgers, Jan W. de Leeuw et Jaap S. Sinninghe Damsté, « Diagenetic and catagenetic products of isorenieratene: Molecular indicators for photic zone anoxia », Geochimica et Cosmochimica Acta, vol. 60, no 22, , p. 4467–4496 (ISSN 0016-7037, DOI 10.1016/S0016-7037(96)00238-4, Bibcode 1996GeCoA..60.4467K, hdl 1874/4280, S2CID 95423218, lire en ligne).
- (en) Jochen J. Brocks, Gordon D. Love, Roger E. Summons, Andrew H. Knoll, Graham A. Logan et Stephen A. Bowden, « Biomarker evidence for green and purple sulphur bacteria in a stratified Palaeoproterozoic sea », Nature, vol. 437, no 7060, , p. 866–870 (ISSN 1476-4687, PMID 16208367, DOI 10.1038/nature04068, Bibcode 2005Natur.437..866B, S2CID 4427285, lire en ligne).
- (en) Martin P. Koopmans, Jürgen Köster, Heidy M. E. Van Kaam-Peters, Fabien Kenig, Stefan Schouten, Walter A. Hartgers, Jan W. de Leeuw et Jaap S. Sinninghe Damsté, « Diagenetic and catagenetic products of isorenieratene: Molecular indicators for photic zone anoxia », Geochimica et Cosmochimica Acta, vol. 60, no 22, , p. 4467–4496 (ISSN 0016-7037, DOI 10.1016/S0016-7037(96)00238-4, Bibcode 1996GeCoA..60.4467K, hdl 1874/4280, S2CID 95423218, lire en ligne).
- (en) Birgit Nabbefeld, Kliti Grice, Richard J. Twitchett, Roger E. Summons, Lindsay Hays, Michael E. Böttcher et Muhammad Asif, « An integrated biomarker, isotopic and palaeoenvironmental study through the Late Permian event at Lusitaniadalen, Spitsbergen », Earth and Planetary Science Letters, vol. 291, no 1, , p. 84–96 (ISSN 0012-821X, DOI 10.1016/j.epsl.2009.12.053, Bibcode 2010E&PSL.291...84N, lire en ligne).
