2-Méthylpropan-1-ol
Le 2-méthylpropan-1-ol, méthylpropan-1-ol, ou isobutanol, est un alcool primaire de formule brute C4H10O. C'est un des isomères du butanol. Il est très utilisé comme solvant lors des réactions chimiques, mais aussi comme réactif en synthèse organique.
| 2-Méthylpropan-1-ol | ||
| ||
 | ||
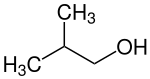
| structure du 2-méthylpropan-1-ol | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 2-Méthylpropan-1-ol | |
| Synonymes |
Isobutanol |
|
| No CAS | ||
| No ECHA | 100.001.044 | |
| No CE | 201-148-0 | |
| FEMA | 2179 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide incolore, d'odeur caractéristique[1]. | |
| Propriétés chimiques | ||
| Formule | C4H10O [Isomères] |
|
| Masse molaire[3] | 74,121 6 ± 0,004 2 g/mol C 64,82 %, H 13,6 %, O 21,59 %, |
|
| Moment dipolaire | 1,64 ± 0,08 D [2] | |
| Propriétés physiques | ||
| T° fusion | −108 °C[1] | |
| T° ébullition | 108 °C[1] | |
| Solubilité | dans l'eau à 20 °C : 87 g·l-1[1] | |
| Paramètre de solubilité δ | 21,5 MPa1/2 (25 °C)[4]; 22,9 J1/2·cm-3/2 (25 °C)[5] |
|
| Masse volumique | 0,8 g·cm-3[1] | |
| T° d'auto-inflammation | 415 °C[1] | |
| Point d’éclair | 28 °C (coupelle fermée)[1] | |
| Limites d’explosivité dans l’air | 1,7–10,9 %vol[1] | |
| Pression de vapeur saturante | 12 mbar à 20 °C 22 mbar à 30 °C 73 mbar à 50 °C |
|
| Point critique | 274,65 °C, 4,3 MPa, 0,586 l·mol-1[6] | |
| Thermochimie | ||
| Cp | ||
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 10,02 ± 0,04 eV (gaz)[8] | |
| Propriétés optiques | ||
| Indice de réfraction | 1,3939 [5] | |
| Précautions | ||
| SGH[9] | ||
| H226, H315, H318, H335 et H336 |
||
| SIMDUT[10] | ||
  B2, D2B, |
||
| NFPA 704 | ||
| Transport | ||
| Écotoxicologie | ||
| DL50 | 2 460 mg·kg-1 (Rat, orale) 3 400 mg·kg-1 (Lapin, cutanée) 3 040 mg·kg-1 (Lapin, orale) |
|
| CL50 | Souris: 15 500 mg·m-3 pour 4 heures Rat: 19 200 mg·m-3 pour 4 heures Cobaye: 19 900 mg·m-3 pour 4 heures |
|
| LogP | 0,8[1] | |
| Seuil de l’odorat | bas : 0,66 ppm haut : 40 ppm[11] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Utilisations
modifierEn synthèse
modifierLa principale utilisation en synthèse de l'isobutanol est son estérification, notamment en acétate d'isobutyle :
L'acétate de d'isobutyle sert alors dans la production de laques et autres revêtements, ainsi que dans l'industrie agro-alimentaire, comme arôme artificiel. D'autres esters de l'isobutanol comme le phtalate de diisobutyle (DIBP) sont utilisés comme agents plastifiants dans les plastiques, caoutchouc, etc.
L'isobutanol peut aussi être oxydé en 2-méthylpropanal:
Directe
modifierL'isobutanol peut être inclus dans les solvants de peinture, les décapants de vernis ou d'encre. En petite quantité dans les peintures, il réduit leur viscosité, améliore la glisse de la brosse et retarde l'apparition de résidus d'huile (le "blush") sur les surfaces peintes.
Il a d'autres utilisation plus mineures, par exemple comme additif à l'essence pour les moteurs à allumage commandé, dans laquelle il contribue à prévenir le givrage du carburateur, ou encore dans les polisseurs et nettoyants. Il est utilisé comme solvant d'extraction dans la production de composés organiques, et comme phase mobile en chromatographie sur couche mince.
Propriétés physico-chimiques
modifierLe 2-méthylpropan-1-ol est un liquide incolore, d'odeur douce assez caractéristique. Comme tous les butanols il est inflammable. Il est soluble dans la plupart des solvants organiques éther-oxydes, alcools, aldéhydes, cétones, etc., mais est relativement peu soluble dans l'eau.
Production et synthèse
modifierL'isobutanol peut être biosynthétisé par des micro-organismes.
Chimiquement, l'isobutanol peut être synthétisé, comme le butan-1-ol par hydroformylation du propène.
On réduit ensuite le 2-Méthylpropanal (et non le butanal, comme dans la synthèse du butan-1-ol) obtenu par hydroformylation:
Articles connexes
modifierRéférences
modifier- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Isobutanol » (voir la liste des auteurs) et en allemand « 2-Methyl-1-propanol » (voir la liste des auteurs).
- fiche du Service du répertoire toxicologique
- ISOBUTANOL, Fiches internationales de sécurité chimique
- ↑ (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 9-50
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 978-0-471-98369-9, LCCN 98018212)
- ↑ (en) Claudio A. Faúndez et José O. Valderrama, « Activity Coefficient Models to Describe Vapor-Liquid Equilibrium in Ternary Hydro-Alcoholic Solutions », Chinese Journal of Chemical Engineering, vol. 17, no 2, , p. 259-267 (DOI 10.1016/S1004-9541(08)60203-7)
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 1, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 978-0-88415-857-8, LCCN 96036328)
- ↑ (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ « Alcool isobutylique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ « Isobutyl alcohol », sur hazmap.nlm.nih.gov (consulté le )








