Hexacène
L'hexacène est un composé chimique de formule C26H16 appartenant à la famille des hydrocarbures aromatiques polycycliques (HAP) et composé de six noyaux benzéniques disposés linéairement. Comme pour ses dérivés, ses propriétés de semiconducteur organique font l'objet de recherches actives.
| Hexacène | |
 Structure de l'hexacène. |
|
| Identification | |
|---|---|
| Nom UICPA | hexacène |
| No CAS | |
| PubChem | 123044 |
| ChEBI | 33152 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C26H16 |
| Masse molaire[1] | 328,405 2 ± 0,021 9 g/mol C 95,09 %, H 4,91 %, |
| Propriétés physiques | |
| T° fusion | 300 °C (décomposition) [2] |
| Cristallographie | |
| Système cristallin | triclinique[3] |
| Classe cristalline ou groupe d’espace | [3] |
| Paramètres de maille | a = 7,9 Å[3] b = 6,1 Å |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
C'est une molécule très instable, particulièrement réactive au niveau des carbones no 6 et 15 en raison de la localisation des électrons π. Son spectre doit être obtenu à partir d'échantillons récents maintenus sous atmosphère inerte d'azote ou d'argon. Il peut être isolé avec de grands substituants, notamment le 6,15-bis(tri-t-butylsilyléthynyl)hexacène, qui fond en se décomposant vers 96 °C[4].
La première synthèse de l'hexacène pur remonte à 1942[5]. En 1955, il est produit par déshydrogénation d'hexacosadéshydrohexacène catalysée au palladium sur carbone[6]. En 1982, il est décrit comme un composé bleu vert qui se décompose vers 380 °C[7]. En 2007, une équipe a annoncé la première synthèse reproductible d'hexacène non substitué, invalidant du même coup les annonces antérieures, à partir de décarbonylation photochimique d'un précurseur dicétone[8] :
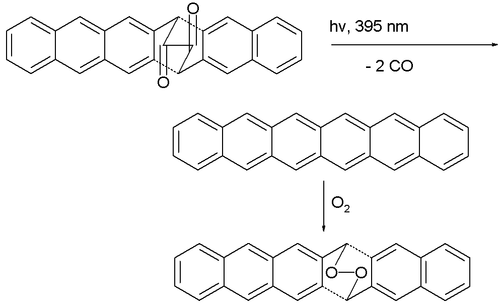
Deux phénomènes empêchent la purification de l'hexacène : il dimérise même à des concentrations aussi faibles que 10−4 M ; il est oxydé par l'air dissous. Cependant une matrice polymère en PMMA atténue suffisamment ces réactions pour permettre à l'hexacène d'y subsister une douzaine d'heures.
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) E. Clar, « Hexacen, ein grüner, einfacher Kohlenwasserstoff », Chemische Berichte, vol. 72, no 10, , p. 1818-1892
- (en) R.B. Campbell, J. M. Robertson et J. Trotter, « The crystal structure of hexacene, and a revision of the crystallographic data for tetracene », Acta Crystallographica, vol. 15, no 5, , p. 289-290
- (en) Payne M. M., Parkin S. R., Anthony J. E., « Functionalized higher acenes: hexacene and heptacene », Journal of the American Chemical Society, vol. 127, no 22, , p. 8028–8029(2) (DOI 10.1021/ja051798v)
- (en) E. Clar, « Eine neue Synthese des Hexacens (Aromatische Kohlenwasserstoffe, XXXIV. Mitteil.) », Berichte der deutschen chemischen Gesellschaft, vol. 75, no 11, , p. 1283–1287(5) (DOI 10.1002/cber.19420751102)
- (en) William J. Bailey, Chien-Wei Liao, « Cyclic Dienes. XI. New Syntheses of Hexacene and Heptacene », J. Am. Chem. Soc., vol. 4, no 77, , p. 992-993(2) (DOI 10.1021/ja01609a055)
- (en) Angliker H., Rommel E., Wirz J., « Electronic spectra of hexacene in solution (ground state, triplet state, dication and dianion) », Chemical Physics Letters, vol. 87, no 2, , p. 208–212(5) (DOI 10.1016/0009-2614(82)83589-6)
- (en) Rajib Mondal, Ravi M. Adhikari, Bipin K. Shah, Douglas C. Neckers, « Revisiting the Stability of Hexacenes », Org. Lett., vol. 13, no 9, , p. 2505-2508(4) (DOI 10.1021/ol0709376)
