Gène et protéine CFTR
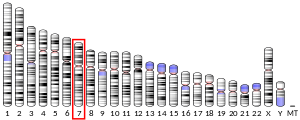
Dans l'espèce humaine comme chez les autres mammifères, le gène CFTR (pour l'anglais cystic fibrosis transmembrane conductance regulator) code une protéine membranaire, dite aussi CFTR, qui est responsable du flux d'ions chlorure. Chez l'humain, le gène CFTR est localisé sur le locus 7q31.2, donc dans la sous-bande 2 de la bande 1 de la région 3 du bras long du chromosome 7. Il est constitué d'environ 250 000 paires de bases et contient 27 exons[5],[6]. Des mutations de ce gène sont responsables de la mucoviscidose, la maladie génétique la plus fréquente dans la population caucasienne, et de l'absence bilatérale des canaux déférents (en) (ABCD).
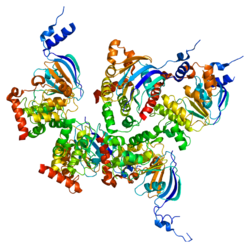
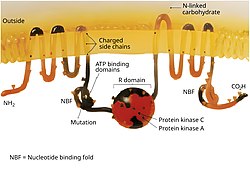
La protéine CFTR est un membre de la superfamille des transporteurs ABC, que l'on retrouve dans tous les domaines du vivant (bactéries, archées et eucaryotes). Elle se distingue de tous les autres membres de cette superfamille par son statut de canal ionique ainsi que par la présence de son domaine régulatoire (R), unique[7]. Elle forme un canal perméable aux ions chlorure et thiocyanate[8], des cellules épithéliales.
Le gène
modifierHistoire
modifierL'étude de la transmission de la mucoviscidose dans de grandes familles aboutit à la découverte en 1985 de liaisons génétiques entre la maladie et deux marqueurs génétiques :
- le gène PON qui code une enzyme, la paraxonase plasmatique ;
- le fragment RFLP appelé DOCRI 917.
Le gène CFTR fut découvert en 1989 par une équipe canadienne, dirigée par Lap-Chee Tsui.
La découverte de ce gène est un bon exemple de clonage positionnel qui consiste à identifier un gène responsable d'un phénotype à partir de sa localisation chromosomique déterminée par des analyses de liaison génétique dans des familles (ou par croisement chez des animaux ou des plantes).
Mutations
modifierOn connaît plus de 1 900 mutations du gène CFTR, qui à l'état homozygote entraînent l'apparition de la mucoviscidose[9]. La plus fréquente, dite p.Phe508del, supprime le 508e acide aminé.
La fréquence significative d'une mutation aussi délétère (la maladie touchant un nouveau-né sur 2 000 à 3 000 en Europe, on estime à 4 % la proportion d'Européens porteurs sains, c'est-à-dire hétérozygotes pour ce gène) est étonnante, l'évolution étant a priori capable d'éliminer la mutation ou d'en limiter bien plus la prévalence. L'explication est en fait la même que pour l'anémie falciforme : à l'état hétérozygote la mutation entraîne un avantage sélectif, en l'occurrence une résistance accrue aux diarrhées sécrétoires dues au choléra et à d'autres contaminations bactériennes (pour l’anémie falciforme, l’avantage sélectif est pour le paludisme). Ce sont deux exemples de « polymorphisme équilibré », c’est-à-dire d’un avantage à l’état hétérozygote, mais d’un inconvénient à l’état homozygote. De fait, la mutation est apparue au début de l'âge du bronze en Europe de l'Ouest et du Nord, puis s'est répandue vers le sud et l'est de concert avec la culture campaniforme des éleveurs de bétail (et consommateurs de produits laitiers)[9],[10].
La protéine
modifierLa protéine CFTR comporte environ 1 480 acides aminés[9]. Logée dans la membrane des cellules, elle sert de canal pour les ions chlorure.
Rôle
modifierLa protéine est exprimée dès la vie fœtale[11].
Il s'agit d'un canal ionique régulé par l'AMP cyclique[12].
La protéine CFTR est impliquée dans le non-transport des halogènes chlore (Cl−), iode (I−), brome (Br−) et pseudohalogène thiocyanate (SCN−) chez les personnes atteintes de mucoviscidose, entraînant des pertes de sueur riches en sodium. De fait, les composés du système endogène de défense immunitaire[13] du poumon de type hypoiodite (OI−), hypochlorite (OCl−), hypothiocyanite (OSCN−) ne peuvent être produits et de fait, les mécanismes de défenses antimicrobiens sont inhibés[14],[15].
Elle permet également l'hydratation du mucus en favorisant la sécrétion d'eau et en inhibant une pompe à sodium épithéliale[16]. Elle favorise aussi le passage d'ions bicarbonates dans le mucus et contrôle ainsi son acidité[17]. Cette alcalinisation pourrait être importante car un mucus trop acide a des propriétés antibactériennes moindres[18].
Régulation
modifierLa régulation du canal CFTR débute lors de la fixation d’hormones comme le glucagon, l’adrénaline, l’acétylcholine, ..) sur les récepteurs de l’adénylate cyclase. Cette enzyme déclenche alors la production d’AMP cyclique dans la cellule, augmentant sa concentration intracellulaire.
Cette augmentation entraîne d’abord la phosphorylation du domaine régulateur R par la PKA, l’ATP peut alors se fixer sur les deux domaines NBD, ce qui déclenche leur dimérisation et des changements conformationnel influençant donc l’inclinaison des hélices membranaires, permettant l’ouverture du canal. L’ATP est alors hydrolysé en ADP, le canal est fermé et l’ADP est libéré.
Le canal CFTR est aussi régulé par la concentration en Mg2+ intracellulaire, qui est elle-même contrôlé par un autre canal, le canal TRMP7. Le canal CFTR est donc lié au fonctionnement du canal TRMP7.
Cible thérapeutique
modifierL'ivacaftor permet d'augmenter la probabilité de l'ouverture d'un canal CFTR[19]. La molécule semble pallier certains symptômes de la mucoviscidose par ce biais[20].
Notes et références
modifier- GRCh38: Ensembl release 89: ENSG00000001626 - Ensembl, May 2017
- GRCm38: Ensembl release 89: ENSMUSG00000041301 - Ensembl, May 2017
- « Publications PubMed pour l'Homme », sur National Center for Biotechnology Information, U.S. National Library of Medicine
- « Publications PubMed pour la Souris », sur National Center for Biotechnology Information, U.S. National Library of Medicine
- (en) « CFTR: The Gene Associated with Cystic Fibrosis », sur ornl.gov, Genomics.energy.gov, (consulté le ).
- (en) « CFTR », sur ghr.nlm.nih.gov, Genetics Home Reference, (consulté le ).
- (en) Aswathy Sebastian, Lavanya Rishishwar, Jianrong Wang, Karen F. Bernard, Andrew B. Conley et al., « Origin and evolution of the cystic fibrosis transmembrane regulator protein R domain », Gene, vol. 523, no 2, , p. 137-146 (DOI 10.1016/j.gene.2013.02.050).
- (en) M. Childers, G. Eckel, A. Himmel et J. Caldwell, « A new model of cystic fibrosis pathology: lack of transport of glutathione and its thiocyanate conjugates », Med Hypotheses, vol. 68, no 1, , p. 101-112 (DOI 10.1016/j.mehy.2006.06.020, présentation en ligne).
- Hervé le Guyader, « Du pot au lait à la mucoviscidose », Pour la science, no 500, , p. 92-94.
- (en) Miguel A. Alfonso-Sanchez, Ana Maria Pérez-Miranda, Susana Garcia-Obregon et José A Peña, « An evolutionary approach to the high frequency of the Delta F508 CFTR mutation in European populations », Medical Hypotheses, vol. 74, no 6, , p. 989-992 (DOI 10.1016/j.mehy.2009.12.018).
- (en) Ann E.O. Trezise, Julie A. Chambers, Catherine J. Wardle, Stephen Gould et Ann Harris, « Expression of the cystic fibrosis gene in human foetal tissues », Human Molecular Genetics, vol. 2, no 3, , p. 213-218 (lire en ligne, consulté le )
- (en) Stutts MJ, Canessa CM, Olsen J, « CCFTR as a cAMP-dependent regulator of sodium channels » Science, 1995;269:847-850
- (en) Gregory E. Conner, Corinne Wijkstrom-Frei, Scott H. Randell, Vania E. Fernandez et Matthias Salathe, « The Lactoperoxidase System Links Anion Transport To Host Defense in Cystic Fibrosis », FEBS Lett., vol. 581, no 2, , p. 271-278 (PMID 17204267, PMCID PMC1851694, lire en ligne, consulté le )
- (en) Fischer H. « Mechanism and function of DUOX in epithelia of the lung » Antioxid Redox Signal. 2009;11(10):1-13. https://www.ncbi.nlm.nih.gov/pubmed/19358684
- (en) Xu Y, Szep S, Lu Z. « The antioxidant role of thiocyanate in the pathogenesis of cystic fibrosis and other inflammation related diseases », PNAS. 2009; Early edition, November 16th http://www.pnas.org/content/106/48/20515.full.pdf+html
- (en) Boucher RC, « Airway surface dehydration in cystic fibrosis: pathogenesis and therapy » Annu Rev Med, 2007;58:157-170
- (en) Poulsen JH, Fischer H, Illek B, Machen TE, « Bicarbonate conductance and pH regulatory capability of cystic fibrosis transmembrane conductance regulator », Proc Natl Acad Sci U S A, 1994;91:5340-5344
- (en) Stoltz DA, Meyerholz DK, Welsh MJ, « Origins of cystic fibrosis lung disease », N Engl J Med. 2015;372:351-362
- (en) Van Goor F, Hadida S, Grootenhuis PD et al. « Rescue of CF airway epithelial cell function in vitro by a CFTR potentiator, VX-770 », Proc Natl Acad Sci U S A, 2009;106:18825-18830
- (en) Ramsey BW, Davies J, Elvaney G et al. « A CFTR potentiator in patients with cystic fibrosis and the G551D mutation », N Engl J Med. 2011;365:1663-1672