Diagramme de Ramachandran
Le diagramme de Ramachandran est une représentation graphique permettant d'analyser la conformation du squelette polypeptidique des protéines. Pour chaque acide aminé de la protéine, on porte la valeur de l'angle diédral φ en abscisse et celle de l'angle diédral ψ en ordonnée, pour des valeurs de -180 à +180 degrés. En raison de la périodicité aux limites du diagramme, la représentation de Ramachandran est formellement équivalente à un tore déplié.
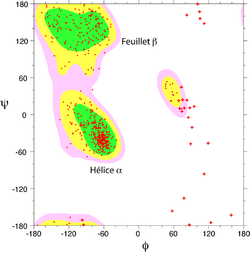
Toutes les valeurs des angles φ et ψ ne sont pas possibles car certaines conduisent à des contacts trop proches entre atomes qui sont énergétiquement très défavorables. Une étude systématique des combinaisons admissibles d'angles φ et ψ a été réalisé par le biologiste et physicien indien Gopalasamudram Narayana Ramachandran en 1963[1].
Le diagramme comporte trois zones favorables, colorées sur l'exemple représenté à droite. Lorsqu'on analyse une structure de protéine, on observe que la majeure partie des acides aminés ont des combinaisons d'angles (φ ,ψ) qui s'inscrivent à l'intérieur de ces trois zones. Les deux principales régions correspondent aux structures secondaires régulières qui sont principalement observées dans les protéines : la région des hélices α et celle des feuillets β. La troisième région, plus petite, correspond à une conformation en hélice gauche (φ>0). Les glycines, qui ne comportent pas de chaîne latérale, ont une plus grande liberté conformationnelle. Elles échappent donc à cette règle et peuvent se trouver en dehors des régions favorables du diagramme.
Utilisation
modifierLe diagramme de Ramachandran est l'un des indicateurs utilisés pour contrôler la qualité des structures de protéines déterminées par cristallographie ou RMN. Dans les structures de haute qualité, plus de 90 % des résidus d'acide aminé (hors glycines) sont situés à l'intérieur des zones les plus favorables. Plus la résolution est élevée et plus le nombre d'acides aminés en dehors des zones privilégiées est faible.
Historique
modifierG. N. Ramachandran, jeune professeur de physique à l'université de Madras travaillait au début des années cinquante sur la structure du collagène. En 1954, il publie un modèle, aujourd'hui classique, de la structure en triple faisceau d'hélices du collagène[2]. Ce modèle fut attaqué l'année d'après par Francis Crick, l'un des deux découvreurs de la structure de la double hélice[3]. Le prestige de Crick et de l'école structurale de Cambridge était très important à l'époque, si bien que Ramachandran se lança pour se défendre et répondre à Crick dans une étude systématique de la stéréochimie des chaînes polypeptidiques qui se prolongea dans la première moitié des années 1960. C'est au cours de ces travaux qu'il imagina cette représentation graphique de la conformation des peptides qui porte aujourd'hui son nom[4].
Notes et références
modifier- Ramachandran, G.N., Sasisekharan, V. & Ramakrishnan, C. (1963) J. Mol. Biol. 7, 95–99
- (en) Ramachandran G.N., Kartha G., « Structure of collagen », Nature, vol. 174, , p. 296-270 (PMID 13185286)
- (en) Rich A., Crick F.H., « Structure of collagen », Nature, vol. 176, , p. 915-946 (PMID 13272717)
- (en) Balaram P., « Revisiting an Old Triumph. », Current Science, vol. 87, , p. 549-550