Décafluorure de disoufre
Le décafluorure de disoufre est un composé chimique de formule S2F10. Il s'agit d'un liquide incolore hautement toxique à l'odeur semblable à celle du dioxyde de soufre SO2.
| Décafluorure de disoufre | |
 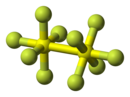  Structure du décafluorure de disoufre |
|
| Identification | |
|---|---|
| Nom UICPA | pentafluoro-(pentafluoro-λ6-sulfanyl)-λ6-sulfane |
| Synonymes |
pentafluorure de soufre |
| No CAS | |
| No ECHA | 100.024.732 |
| No CE | 227-204-4 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | F10S2 |
| Masse molaire[1] | 254,114 ± 0,01 g/mol F 74,76 %, S 25,24 %, |
| Propriétés physiques | |
| T° fusion | −55 °C[2] |
| T° ébullition | 28,7 °C[2] |
| Masse volumique | 2,08 g·cm-3[2] à 25 °C |
| Pression de vapeur saturante | 74,8 kPa[2] à 20 °C |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
La toxicité du S2F10 est quatre fois supérieure à celle du phosgène (dichlorure de carbonyle COCl2), son absorption pouvant notamment entraîner un œdème aigu du poumon, de sorte qu'il a été envisagé comme arme chimique au cours de la Seconde Guerre mondiale car son exposition ne donne lieu à aucune manifestation d'irritation susceptible d'avertir de sa présence ; sa toxicité résulterait essentiellement de la libération d'acide fluorhydrique HF(aq) et d'acide sulfureux H2SO3 à partir du tétrafluorure de soufre SF4 au contact de l'humidité physiologique.
Le décafluorure de disoufre est produit par décomposition électrique de l'hexafluorure de soufre SF6, un gaz inerte utilisé dans les isolateurs des postes électriques, lignes à haute tension et autres appareillages électriques à haute tension :
Les atomes de soufre de S2F10 ont une géométrie octaédrique et sont à l'état d'oxydation +5. Ce composé se dismute lentement en hexafluorure de soufre SF6 et tétrafluorure de soufre SF4 à une température supérieure à 150 °C :
Il réagit avec la tétrafluorohydrazine N2F4 pour donner du difluoroaminopentafluorure de soufre SF5NF2. Il réagit avec le dioxyde de soufre SO2 pour former du fluorosulfonate de pentafluorosulfanyle SF5OSO2F sous l'effet d'un rayonnement ultraviolet. Il réagit avec un excès de chlore Cl2 pour donner du chloropentafluorure de soufre SF5Cl :
Enfin, l'ammoniac NH3 est oxydé en trifluorure de thiazyle NSF3 par le décafluorure de disoufre.
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Disulfur decafluoride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 30 novembre 2012 (JavaScript nécessaire)