Conjugué anticorps-médicament
Les conjugués anticorps-médicaments (en anglais antibody-drug conjugates ou ADC) sont une classe de médicaments biopharmaceutiques conçus comme une thérapie ciblée pour le traitement des cancers. Contrairement à la chimiothérapie, les ADC sont conçus pour cibler et tuer les cellules tumorales tout en épargnant les cellules saines. En 2019, quelque 56 sociétés pharmaceutiques développaient des ADC[1].
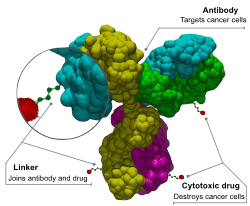
Les ADC sont des molécules complexes composées d'un anticorps lié à une charge utile ou à un médicament cytotoxique (anticancéreux) biologiquement actif[2]. Les conjugués anticorps-médicaments sont des exemples de bioconjugués et d'immunoconjugués.
Les ADC combinent les capacités de ciblage des anticorps monoclonaux et la capacité de destruction du cancer des médicaments cytotoxiques. Ils peuvent être conçus pour faire la distinction entre les tissus sains et les tissus malades[3].
Mécanisme d'action
modifierLes conjugués anticorps-médicament jouent en synergie le rôle de ciblage « spécifique » et l’effet destructeur « efficace » sur les cellules cancéreuses. Ces médicaments sont comme un « missile biologique » guidé avec précision, capable de détruire les cellules cancéreuses avec précision, améliorant ainsi la fenêtre thérapeutique et réduisant les effets secondaires non ciblés[4].Une fois que l'anticorps du conjugué est lié aux antigènes cibles spécifiquement exprimés sur les cellules cancéreuses, le conjugué anticorps-médicament est endocytosé/intériorisé par les cellules pour former un endosome précoce, suivi d'une maturation en endosomes tardifs et finalement fusionné avec des lysosomes. Les charges utiles cytotoxiques sont finalement libérées via une libération médiée par des produits chimiques ou des enzymes dans les lysosomes, entraînant l'apoptose ou la mort des cellules via le ciblage de l'acide désoxyribonucléique ou des microtubules[5]. Lorsque la charge utile libérée est perméable ou transmembranaire, elle peut également induire un effet spectateur pour améliorer l'efficacité du conjugués anticorps-médicament. De plus, l’effet de ces médicaments peut également modifier le microenvironnement tumoral, ce qui peut à son tour renforcer l’effet destructeur des conjugués anticorps-médicaments[6].
L'activité anticancéreuse des conjugués anticorps-médicament est également impliquée dans les effets de cytotoxicité médiée par les anticorps, la phagocytose dépendante des anticorps et la cytotoxicité médiée par le complément[7],[8]. Le segment Fab de l'anticorps de certains conjugués anticorps-médicament pourrait se lier à l'épitope antigénique des cellules infectées par le virus ou des cellules tumorales tandis que le segment Fc se lie au récepteur Fc à la surface des cellules tueuses (cellules NK, macrophages, etc.), médiant ainsi les effets de destruction directe. De plus, le composant anticorps du conjugué anticorps-médicament pourrait se lier spécifiquement à l'antigène épitopique des cellules cancéreuses et inhiber la transduction du signal en aval du récepteur de l'antigène. Par exemple, le trastuzumab du T-DM1 peut se lier au récepteur HER2 des cellules cancéreuses et bloquer la formation d'hétérodimère entre HER2 et HER1, HER3 ou HER4, ce qui inhibe les voies de transduction du signal de survie et de prolifération cellulaire. pour induire l’apoptose cellulaire[9].
Historique
modifierLes médicaments qui ciblent les cellules tumorales et en ignorent d'autres ont été conçus dès 1900 par Paul Ehrlich, lauréat allemand du prix Nobel[1].
En 2001, le médicament de Pfizer/Wyeth, Gemtuzumab ozogamicin (nom commercial : Mylotarg) a été approuvé. Cependant, à la demande de la Food and Drug Administration (FDA) des États-Unis, la société l'a retirée en juin 2010[10] et l'a réintroduite sur le marché américain en 2017[11].
Le brentuximab védotine (nom commercial : Adcetris, commercialisé par Seattle Genetics et Millennium/Takeda)[12] a été approuvé par la FDA le 19 août 2011 pour le HL récidivant et le sALCL récidivant et a reçu une autorisation de mise sur le marché conditionnelle de l'Agence européenne des médicaments en octobre 2012.
L'emtansine de trastuzumab (ado-trastuzumab emtansine ou T-DM1, nom commercial : Kadcyla, commercialisé par Genentech et Roche) a été approuvée en février 2013 pour le traitement du cancer du sein métastatique HER2-positif (CBM) chez les personnes ayant reçu un traitement antérieur par trastuzumab et une chimiothérapie par taxane[13],[14].
La Commission européenne a approuvé l'Inotuzumab ozogamicine[15] en monothérapie pour le traitement de la leucémie lymphoblastique aiguë (LLA) précurseur des lymphocytes B CD22-positifs ou récidivants chez l'adulte le 30 juin 2017 sous le nom commercial Besponsa (Pfizer/Wyeth), suivi le 17 août 2017 de la FDA[16].
Le premier conjugué anticorps-médicament immunologique (iADC), ABBV-3373, fait actuellement l'objet d'essais cliniques chez des participants atteints de polyarthrite rhumatoïde modérée à grave[17].
En 2019, AstraZeneca a accepté de verser jusqu'à 6,9 milliards de dollars américains pour développer conjointement le DS-8201, commercialisé sous le nom Enhertu, avec le japonais Daiichi Sankyo[18]. Le DS-8201 transporte huit charges utiles, contre quatre jusqu'alors[1]. En juin 2019, Daiichi Sankyo Co. fait état des succès très prometteurs des essais cliniques du médicament qui devrait être mis sur le marché d'ici la fin de l'année 2019[19]. Enhertu (Trastuzumab deruxtecan (en)) bénéficie en France d'une autorisation temporaire d'utilisation en troisième ligne[18].
Les différents conjugués anticorps-médicaments
modifierLe tableau recense les conjugués anticorps-médicament disponible au 31 Décembre 2021 dans le monde et approuvé par une des agences des médicaments suivantes: Food and Drug Administration, Agence européenne des médicaments, Agence des médicaments et dispositifs médicaux du Japon (Pharmaceuticals and Medical Devices Agency of Japan) et le Bureau national des médicaments de Chine (Medical Products Administration of China)[20].
| Nom | Nom commercial | Récepteur cible | Année d'approbation | Indications |
|---|---|---|---|---|
| Hémopathies malignes | ||||
| Gemtuzumab ozogamicine | Mylotarg | CD33 | 2001 | |
| Brentuximab védotine | Adcetris | CD30 | 2011 | |
| Inotuzumab ozogamicine | Besponsa | CD22 | 2017 | |
| Moxetumomab pasudotox | Lumoxiti | CD22 | 2018 | |
| Polatuzumab védotine | Polivy | CD79B | 2019 | |
| Bélantamab mafodotine | Blenrep | BCMA | 2020 | |
| Loncastuximab tésirine | Zynlonta | CD19 | 2021 | |
| Tumeurs solides | ||||
| Ado-trastuzumab emtansine | Kadcyla | HER2 | 2013 | |
| Enfortumab védotine | Padcev | Nectin-4 | 2019 | |
| Fam-trastuzumab deruxtecan | Enhertu | HER2 | 2019 | |
| Sacituzumab govitecan | Trodelvy | Trop-2 | 2020 | |
| Cetuximab sarotalocan | Akalux | EFGR | 2020 | |
| Disitamab védotine | Aidixi | HER2 | 2021 | |
| Tisotumab védotine | Tivdak | TF | 2021 | |
Sources de l'article
modifierFu, Z., Li, S., Han, S. et al. Antibody drug conjugate: the “biological missile” for targeted cancer therapy. Sig Transduct Target Ther 7, 93 (2022). https://doi.org/10.1038/s41392-022-00947-7 paru sous license Creative Commons Attribution 4.0 International
Références
modifier- Kanoko Matsuyama, « Drug to replace chemotherapy may reshape cancer care », sur BNN Bloomberg, (consulté le )
- « Antibody-Drug Conjugates Stage a Comeback »,
- Ravi V. J. Chari, Bridget A. Martell, Jonathan L. Gross, Sherrilyn B. Cook, Sudhir A. Shah, Walter A. Blättler, Sara J. McKenzie et Victor S. Goldmacher, « Immunoconjugates containing novel maytansinoids: promising anticancer drugs », Cancer Research, vol. 52, no 1, , p. 127–31 (PMID 1727373)
- (en) John R Adair, Philip W Howard, John A Hartley et David G Williams, « Antibody–drug conjugates – a perfect synergy », Expert Opinion on Biological Therapy, vol. 12, no 9, , p. 1191–1206 (ISSN 1471-2598 et 1744-7682, DOI 10.1517/14712598.2012.693473, lire en ligne, consulté le )
- Michael J Birrer, Kathleen N Moore, Ilaria Betella et Richard C Bates, « Antibody-Drug Conjugate-Based Therapeutics: State of the Science », JNCI: Journal of the National Cancer Institute, vol. 111, no 6, , p. 538–549 (ISSN 0027-8874 et 1460-2105, DOI 10.1093/jnci/djz035, lire en ligne, consulté le )
- (en) Alexander H. Staudacher et Michael P. Brown, « Antibody drug conjugates and bystander killing: is antigen-dependent internalisation required? », British Journal of Cancer, vol. 117, no 12, , p. 1736–1742 (ISSN 1532-1827, DOI 10.1038/bjc.2017.367, lire en ligne, consulté le )
- Yu-Tzu Tai, Patrick A. Mayes, Chirag Acharya et Mike Y. Zhong, « Novel anti–B-cell maturation antigen antibody-drug conjugate (GSK2857916) selectively induces killing of multiple myeloma », Blood, vol. 123, no 20, , p. 3128–3138 (ISSN 0006-4971 et 1528-0020, PMID 24569262, PMCID PMC4023420, DOI 10.1182/blood-2013-10-535088, lire en ligne, consulté le )
- (en) Jakub Radocha, Niels W. C. J. van de Donk et Katja Weisel, « Monoclonal Antibodies and Antibody Drug Conjugates in Multiple Myeloma », Cancers, vol. 13, no 7, , p. 1571 (ISSN 2072-6694, PMID 33805481, PMCID PMC8037134, DOI 10.3390/cancers13071571, lire en ligne, consulté le )
- Oostra, D. R. & Macrae, E. R. Role of trastuzumab emtansine in the treatment of HER2-positive breast cancer. Breast Cancer (Lond.) 6, 103 (2014).
- FDA: Pfizer Voluntarily Withdraws Cancer Treatment Mylotarg from U.S. Market, US FDA
- « Approved Drugs > FDA Approves Gemtuzumab Ozogamicin for CD33-positive AML », sur fda.gov, Silver Spring, USA, U.S. Food and Drug Administration, (consulté le )
- Brentuximab vedotin (SGN35), ADC Review/Journal of Antibody-drug Conjugates
- FDA Approves Genentech's Kadcyla® (Ado-Trastuzumab Emtansine), the First Antibody-Drug Conjugate for Treating Her2-Positive Metastatic Breast Cancer [1]
- Ado-trastuzumab emtansine (U.S. Department of Health and Human Services | National Institutes of Health | National Cancer Institute.) [2]
- Inotuzumab ozogamicin (drug description), ADC Review/Journal of Antibody-drug Conjugates [3]
- U.S. FDA Approves Inotuzumab Ozogamicin for Treatment of Patients with R/R B-cell precursor Acute Lymphoblastic Leukemia, ADC Review/Journal of Antibody-drug Conjugates, August 17, 2017 [4]
- « A Study to Evaluate the Safety, Tolerability, Pharmacokinetics, and Efficacy of ABBV-3373 in Participants With Moderate to Severe Rheumatoid Arthritis - Full Text View - ClinicalTrials.gov », sur clinicaltrials.gov
- « PROTOCOLE D’UTILISATION THERAPEUTIQUE ET DE RECUEIL D’INFORMATIONS », sur ansm.sante.fr,
- (en-US) Kanoko Matsuyama, « Drug devised to replace chemotherapy may reshape cancer care », The Japan Times Online, (ISSN 0447-5763, lire en ligne, consulté le )
- (en) Zhiwen Fu, Shijun Li, Sifei Han et Chen Shi, « Antibody drug conjugate: the “biological missile” for targeted cancer therapy », Signal Transduction and Targeted Therapy, vol. 7, no 1, , p. 1–25 (ISSN 2059-3635, PMID 35318309, PMCID PMC8941077, DOI 10.1038/s41392-022-00947-7, lire en ligne, consulté le )