Chlorure de rhodium carbonyle
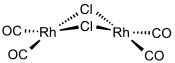
Le chlorure de rhodium carbonyle est un composé chimique de formule [Rh(CO)2(µ-Cl)]2, généralement écrite simplement Rh2Cl2(CO)4. Il s'agit d'un solide volatil brun rougeâtre soluble dans les solvants organiques apolaires. C'est un précurseur vers d'autres complexes de rhodium carbonyle, dont certains sont utilisés en catalyse homogène. La molécule est un dimère constitué de deux centres rhodium(I) liés par deux ligands chlorure Cl− pontants, chaque centre portant deux ligands carbonyle CO. L'analyse de la structure par cristallographie aux rayons X montre que les centres Rh(I) adoptent un géométrie plane carrée avec un angle dièdre de 53° entre les deux plans RhCl2 tandis que les centres métalliques eux-mêmes ne sont pas liés directement[3].
| Chlorure de rhodium carbonyle | |
| |
| Structure du chlorure de rhodium carbonyle | |
| Identification | |
|---|---|
| Nom UICPA | Di-μ-chloro-tétracarbonyldirhodium(I) |
| No CAS | |
| No ECHA | 100.035.021 |
| No CE | 238-540-6 |
| PubChem | 24852228 |
| Apparence | solide brun rouge inodore[1] |
| Propriétés chimiques | |
| Formule | C4Cl2O4Rh2 |
| Masse molaire[2] | 388,757 ± 0,008 g/mol C 12,36 %, Cl 18,24 %, O 16,46 %, Rh 52,94 %, |
| Propriétés physiques | |
| T° fusion | 121 °C[1] |
| Précautions | |
| SGH[1] | |
| H302, P264, P280 et P301+P310 |
|
| NFPA 704[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Synthèse et réactions
modifierObtenu pour la première fois en 1943 par le chimiste allemand Walter Hieber (en)[4], le chlorure de rhodium carbonyle est généralement produit en traitant l'hydrate de chlorure de rhodium(III) RhCl3·3H2O par un flux de monoxyde de carbone CO, selon l'équation idéalisée[5] :
- 2 RhCl3·3H2O + 6 CO ⟶ Rh2Cl2(CO)4 + 2 COCl2 + 6 H2O.
Il réagit avec la triphénylphosphine P(C6H5)3 pour donner le chlorure de bis(triphénylphosphine)rhodium carbonyle trans-[RhCl(CO)(P(C6H5)3)2] :
- Rh2Cl2(CO)4 + 4 P(C6H5)3 ⟶ 2 trans-[RhCl(CO)(P(C6H5)3)2] + 2 CO.
La réaction avec les sels de chlorure libère des dichlorures anioniques :
- Rh2Cl2(CO)4 + 2 Cl− ⟶ 2 cis-[RhCl2(CO)2]−.
La réaction avec l'acétylacétone CH3COCH2COCH3 donne l'acétylacétonate de rhodium(I) dicarbonyle Rh(O2C5H7)(CO)2.
Le dimère réagit avec diverses bases de Lewis (notées :B) pour former des adduits de la forme RhCl(CO)2:B. Ainsi, avec le tétrahydrothiophène :S(CH2)4, la réaction s'écrit :
Les ligands carbènes N-hétérocycliques (en) (NHC) réagissent avec le chlorure de rhodium carbonyle pour donner des complexes cis-[RhCl(NHC)(CO)2] monomériques. Les spectres infrarouges de ces complexes ont été utilisés pour évaluer la force donneuse de ces NHC[6],[7].
Notes et références
modifier- « Fiche du composé Tetracarbonyldi-µ-chlorodirhodium(I), Rh 50.1-52.9% », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) L. Walz et P. Scheer, « Structure of di-µ-chloro-bis[dicarbonylrhodium(I)] », Acta Crystallographica Section C, vol. 47, no 3, , p. 640-641 (DOI 10.1107/S0108270190009404, lire en ligne).
- (de) W. Hieber et H. Lagally, « Über Metallcarbonyle. XLV. Das Rhodium im System der Metallcarbonyle », Zeitschrift für anorganische und allgemeine Chemie, vol. 251, no 1, , p. 96-113 (DOI 10.1002/zaac.19432510110, lire en ligne).
- (en) Richard Cramer, J. A. McCleverty et J. Bray, « Di-μ-chlorotetrakis(ethylene)dirhodium(I), 2,4-Pentanedionatobis(ethylene)rhodium(I), and Di-μ-chlorotetracarbonyldirhodium(I) », Inorganic Syntheses, vol. 15, , p. 211-214 (DOI 10.1002/9780470132463.ch4, lire en ligne).
- (en) Michael Nonnenmacher, Dominik M. Buck et Doris Kunz, « Experimental and theoretical investigations on the high-electron donor character of pyrido-annelated N-heterocyclic carbenes », Beilstein Journal of Organic Chemistry, vol. 12, , p. 1884-1896 (PMID 27829895, PMCID 5082490, DOI 10.3762/bjoc.12.178, lire en ligne).
- (en) Han Vinh Huynh, « Electronic Properties of N-Heterocyclic Carbenes and Their Experimental Determination », Chemical Reviews, vol. 118, no 19, , p. 9457-9492 (PMID 29601194, DOI 10.1021/acs.chemrev.8b00067, lire en ligne).

