Chiroptera
Chiroptères · Chauves-souris, Chauvesouris
| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Super-classe | Tetrapoda |
| Classe | Mammalia |
| Cohorte | Placentalia |
| Super-ordre | Laurasiatheria |
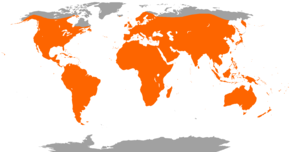
Répartition géographique
Les Chiroptères (Chiroptera), appelés couramment chauves-souris (ou chauvesouris[n 1]), sont un ordre de mammifères placentaires comptant près de 1 400 espèces, soit un cinquième des 6 500 espèces de mammifères connues[2], avec 175 genres regroupés en 20 familles[3],[4],[5]. C'est le groupe de mammifères le plus important après celui des rongeurs[6],[7].
Les chiroptères sont les seuls mammifères doués du vol actif, à distinguer du vol plané que pratiquent les écureuils volants, les phalangers ou les galéopithèques[8]. Ils se déplacent dans les airs grâce à une aile formée d'une membrane de peau entre le corps, les membres et les doigts. La plupart des espèces ne se posent qu'exceptionnellement au sol et s'y meuvent maladroitement.
Ces animaux nocturnes volants sont souvent capables d'écholocation. Cette capacité est surtout développée chez les Microchiroptères insectivores ; essentiellement actifs la nuit, ils se dirigent dans l'obscurité en émettant des ultrasons dont ils captent la réflexion, écholocalisant ainsi leurs proies et les obstacles. Les Mégachiroptères, quant à eux, se fient plus à leur vue et à leur odorat.
Deux sous-ordres étaient classiquement admis : les Microchiroptères aux petits yeux et aux grandes oreilles et les Mégachiroptères aux grands yeux et aux petites oreilles[9]. Les Microchiroptères comportent 17 familles, environ 146 genres et 814 espèces, de petite taille relative, capables d’écholocation, et les Mégachiroptères ne comportent qu'une famille avec environ 41 genres et 170 espèces dont les fameuses roussettes, de grande taille relative (Dobson 1875). Récemment, sur des bases moléculaires, l’ordre a été redécoupé en deux nouveaux sous-ordres pour rompre la paraphylie des Microchiroptères : les Yinpterochiroptera et les Yangochiroptera[7].
Dans les zones anthropiques ou de déforestation, de nombreuses espèces de chiroptères sont en forte régression ou ont localement disparu. Certaines font l'objet de plans de restauration ou bénéficient d'un statut de protection, notamment en France[10].
Dans la culture populaire, l'image de la chauve-souris peut être positive ou négative selon les pays. À cause de leur aspect étrange et de leur vie nocturne et, par voie de conséquence, du mystère qui entoure leur mode de vie, elles sont souvent victimes d'idées reçues qui leur ont valu longtemps d'être persécutées.
Étymologie et histoire
modifierOrigine du mot « chiroptère »
modifierChiroptère signifie littéralement « mains ailées ». Le terme chiroptère dérive du grec ancien. Il est composé de chiro et de ptère, empruntés respectivement aux noms grecs : kheir (ἣ χείρ → « la main »), et ptéron (τὸ πτερόν → « l'aile », mais ordinairement pluriel : τὰ πτερά ta ptéra → « les ailes », car le singulier désigne plutôt « la plume »)[11]. Ce qui donne, étymologiquement, le substantif composé kheiroptera.
Ce nom évoque donc une particularité morphologique de cet animal qui, tout aussi littéralement, « vole avec les mains » : puisque son « aile est formée par quatre doigts hypertrophiés et reliés par une membrane de peau souple et élastique. Le pouce est réduit et sa griffe permet à l’animal de s’accrocher occasionnellement ou de prendre appui pour ramper[12] ».
Historiquement l'appellation de cheiroptère a été donnée par Georges Cuvier en 1798, dans son Tableau élémentaire de l'histoire naturelle des animaux (« Mammifères carnassiers volants » ou cheiroptères[13]). En 1838, elle devient chiroptère (Ac. Compl. 1842)[14].
Origine du mot « chauve-souris »
modifierProblème : un mystère sémantique
modifierLe vocable français de « chauve-souris » est assez étrange, les chiroptères n'étant pas du tout des rongeurs Muridés (ordre et famille de la souris grise ou souris domestique), encore moins chauves[12],[16],[17]. Plusieurs hypothèses philologiques[18] ont été émises pour expliquer cette énigme étymologique[16].
Hypothèse
modifierL’hypothèse la plus vraisemblable et la plus consensuelle aujourd’hui[19],[20],[21],[22] ,[23], mais toujours discutée[24],[25], indique que cet étrange vocable est probablement dû à une erreur de transcription des grammairiens du haut Moyen Âge qui ont mixé (ou confondu) par contamination phonétique et paronymie "reconstruite"[25] des termes d’origine celtique (ou gallo-romane), d’origine francique et d’origine latine. Cette erreur de transcription a été pressentie ou envisagée dès la seconde moitié du XIXe siècle par Émile Littré dans son Dictionnaire de la langue française[25].
De plus, dans l'Antiquité tardive et le haut Moyen Âge, et parfois jusqu’au début du XIXe siècle[18], on tenait cet animal pour apparenté à la souris, ou bien on le considérait comme une sorte d’hybride entre un oiseau nocturne, comme une chouette (pour ses mœurs nocturnes et sa capacité à voler), et une souris[26],[25] (pour sa forme générale, sa taille — pour les plus petits chiroptères comme les pipistrelles — et ses poils).
Par ailleurs, encore « jusqu'au début du XIXe siècle la chauve-souris était souvent classée parmi les oiseaux. Cette ancienne classification approximative et métaphorique (par ressemblance d’aspect, de comportement, ou par analogie erronée), s’est maintenue malgré les encyclopédistes, et, redoublée par l’erreur probable de traduction du gallo roman au latin »[16], elle serait à l’origine des diverses dénominations des chiroptères dont nous héritons. Elle aurait donc fait passer le chiroptère pour une « chouette-souris » puis pour une « chauve-souris ». Alors qu’il n’est ni oiseau, ni chauve, ni souris.
Étapes
modifierEn bas latin de Gaule[19], on trouve le terme de calvas sorices (au pluriel[23]), qui a donné « chauve-souris » , attesté dès le VIIIe siècle en Picardie et dans les Gloses de Reichenau[23] pour traduire précisément le latin classique vespertiliones (terme générique désignant tous les chiroptères). Il s’agit probablement d’une altération[19] du gallo-roman *cawa sorīce[n 2],[19], par contamination du latin calvas, « chauves » au féminin pluriel. Cette expression était composée de *cawa[16],[17] (ou * kāwa[12]), mot dérivé du Vieux-francique et qui signifie « chouette », et du mot *sorīce(m), accusatif de *sorīx (en latin classique : sorex, -ĭcis), qui veut dire « souris »[20],[21],[22],[23].
*Cawa (« chouette » donc), se retrouvait lui-même, peut-être à partir d'une racine indo-européenne commune, dans le mot latin tardif căvannus[n 3] désignant la chouette hulotte ou le hibou[31], lui-même emprunté au gaulois *cauannos[n 2] qui donne le breton kaouenn.
Alors le mot gaulois (gallo roman) de « *cawasorīce », (« et en bas latin populaire « *cawa sorīx » vers le Ve siècle après J.C.[17] »), signifiait donc à l'origine littéralement « chouette-souris », en raison des mœurs nocturnes de l'animal, de sa capacité à voler comme un oiseau et de sa ressemblance avec la souris commune[25] « pour la forme et la grosseur du corps »[26]. Mais « pour les Romains, cawa sorīx ne voulait rien dire »[17], si bien que mal compris et déformé au fil du temps, ce mot aurait donc dans l'usage oral été assimilé abusivement au latin calvas (« chauves » au féminin devenu pluriel par contamination du "s" initial de sorīx : *cawa-(s)-s-orīx), puis retranscrit par erreur, par les latinistes : calvas sorices[12],[19].
Ainsi dès le VIIIe siècle on trouve aussi la forme « calves sorices »[18]. Puis au XIe siècle dans les Gloses du rabbin et lettré Rachi, on trouve la forme « Kalve soriç »[32], et la forme « chalve suriz » en 1180 dans les Fables de Marie de France[33]. Enfin on trouve la forme « chauves soriz » tout à la fin du XIIe siècle[24], et encore chez Marie de France (Fable 31), les formes : « chauve suris » et « chauve souriz »[34]. Au XIIIe siècle chez Jean de Meung, on trouve l’inversion « soris chauve »[25],[34]. Il est imité en cela plus tard par Jean de La Fontaine, qui utilisait indifféremment la forme inversée ou la forme classique (lui aussi pour les besoins de la rime[18],[25]). On note qu’ici la chauve-souris est pour La Fontaine un oiseau. Dans le livre II de ses Fables, toujours cité par Littré[25], on trouvait déjà la forme non inversée et sans tiret, mais cette fois la « Chauvesouris » est assimilée par la belette tantôt à la souris tantôt à l’oiseau pour en faire sa proie préférée, et le chiroptère joue sur cette prétendue ambiguïté de nature pour se sauver
L'humour avec lequel La Fontaine joue de l'hésitation taxonomique de son époque (à ranger la chauve-souris parmi les oiseaux ou parmi les rongeurs) fait écho à celui du Roman de Renart qui, dès la fin XIIe siècle et au XIIIe siècle, nomme la souris « Chauve » et son "mari" le rat « Pelé », faisant clairement allusion au mot de « chauve-souris » et le renvoyant probablement à sa bizarrerie sémantique sinon à son étymologie douteuse, et en assimilant volontairement chiroptères et rongeurs. D'ailleurs cet extrait — présenté ici plus largement — est cité dans le Littré[25] et dans le site "La langue française"[34] à l'entrée « chauve-souris ».
- L’étymologie « métaphorique » d’une « chouette-chauve-souris » qui n’est ni oiseau, ni chauve, ni souris.
-
1 - Pipistrelle soprane ou Pipistrellus pygmaeus, à Sotchi (Russie, ).
-
2 - Pipistrelle commune, à Kauns (Tyrol autrichien, ).
-
3 – Pipistrelle commune ou Pipistrellus pipistrellus en vol nocturne (Bretagne, ).
Discussion
modifierParallèlement, probablement formé à partir de *cawa sōrice (et donc au sens de « chouette-souris » cette fois), on trouve jusqu’à la fin du XIIIe siècle en wallon (toujours dans le cadre donc des langues d’oïl) les formes « chawe-sori » et « cauwesoris »[24]. En picard, on trouve les formes « casseuris », et « cateseuris » ; en dialecte de Namur les formes « chau-sori », « chèhau-sori »[25]. Mais comme les formes dérivées de calves sorices et celles dérivées de *cawa sōrice ont continué à cohabiter du VIIIe siècle au XIVe siècle, et se sont toutes deux ultérieurement rencontrées, on ne peut établir avec certitude lesquelles ont servi de modèle aux autres ou les ont altérées[24]. D’ailleurs, pour les linguistes Albert Dauzat et Jean Séguy, « il est peu probable que calves sorices soit dès le VIIIe siècle une altération du type *cawa sōrice »[35]. Mais cette altération est donc peut-être plus tardive et la cohabitation des deux types serait devenue ultérieurement une fusion au bénéfice de la forme « chauve-souris »[34].
Enfin, certaines sources remettent en question cette hypothèse du glissement — seulement phonétique et sans vraie raison sémantique — de la « chouette-souris » vers la « chauve-souris », soit en arguant de la difficulté d’établir une antériorité de l’une sur l’autre, soit en tentant d’établir un lien entre les chiroptères et la calvitie. Ainsi le Littré, citant Charles Grandgagnage qui était partisan de cette hypothèse de l’altération de « chouette-souris » en « chauve-souris », le réfute en s’appuyant sur une chronologie qui lui semble mal établie : « Grandgagnage fait remarquer que les formes wallonnes veulent dire souris-chouette ; de sorte qu'il y aurait là une paronymie qui aurait changé chawe, chouette, en chauve. Mais ce qui empêche d'admettre cette opinion, c'est que chauve-souris se trouve dans les plus anciens textes sans variante, ce qui ne serait pas si chauve était une corruption de quelque autre mot »[25]. De plus, le Littré revient à l’hypothèse première que cette appellation de chauve-souris viendrait simplement du fait qu'il s'agirait vraiment pour nos devanciers d'une souris chauve, « cet animal ayant pu être ainsi nommé à cause que ses ailes n'ont pas de plumes »[25].
Plus récemment, on trouve des sources qui justifient cette appellation par une calvitie relative mais réelle de certains chiroptères : « Chauves-souris (XIIe siècle emprunté au latin tardif calva sorix "souris chauve, sans poil" (l’animal ayant des poils très courts sur la tête) ; peut-être par altération d’un francique *kawa (chouette) »[22]. D’autres sources, reprenant l’argument de Littré sur la nudité de leurs ailes et y ajoutant des exemples dans des langues non latines, indiquent que l’altération de *cawa en calva pourrait être intentionnelle et non pas résulter d’une transcription phonétique par inadvertance : « Il faut cependant noter que la membrane nue sans poil des ailes des chauves-souris pourrait justifier un lien avec la calvitie annoncée : d’autres langues évoquent des animaux chauves (albanais par exemple) et la transformation de cawa en calva n’est peut-être pas uniquement justifiée par la proximité phonétique. En tout cas, pour revenir à la pilosité des chauves-souris, elle est non seulement abondante mais diversifiée ! Selon l’espèce, le poil est long ou court, d’aspect raide ou laineux. On en trouve à la tignasse tellement bien développée qu’elle leur cache presque les yeux. On trouve des poils sur les pattes, certaines espèces les ont d’ailleurs particulièrement longs »[17].
Toujours est-il que le terme « erroné » de calvas sorices (puis « chauve-souris ») a donc éliminé le nom latin classique des chiroptères (soit vespertilio, de vesper, « soir ») en Gaule du Nord[23], puis les appellations issues du surnom de « chouettes-souris », pour s’imposer enfin chez toutes les populations francophones comme nom générique des chiroptères. Mais ce mot latin classique de vespertilio se retrouve aussi aujourd'hui dans le nom vernaculaire de vespertilion, ainsi que dans celui de pipistrelle qui nous vient du terme latin classique via l’italien : pipistrello (« chauve-souris » générique), déformation de l’ancien italien vipistrello, issu lui-même du latin vespertilio (voir aussi l'entrée « pipistrelle » dans le Wiktionnaire).
Noms vernaculaires
modifierEn français les diverses chauves-souris reçoivent de très nombreux noms vernaculaires différents, dont les plus connus ou les plus courants, outre la pipistrelle et le vespertilion déjà cités, sont probablement : la roussette, l'oreillard, la noctule, la barbastelle, le rhinolophe, le rhinopome, la sérotine, le nyctère et les célèbres vampires (en fait une sous famille des Desmodontinae)[36],[34].
Conclusion
modifierL’origine de l’appellation de « chauve-souris » reste donc discutée…
Ainsi le mystère qui a longtemps entouré cet animal nocturne, seul mammifère capable de voler vraiment, et de manière virtuose dans l’obscurité totale, — mystère nourrissant à tort de nombreux fantasmes maléfiques, aujourd’hui redoublés (toujours à tort probablement) par une certaine affinité entre les chiroptères et les coronavirus[37] — trouve un écho intéressant dans l’énigme de son nom, puisqu’elle n’est « ni chauve ni souris. Faut-il changer [son] nom ? Bien sûr que non, ces animaux mystérieux le sont jusque dans leur nom, c’est très bien comme ça, et puis, franchement, qui pense encore à une souris chauve quand on parle de chauve-souris ? »[17].
Morphologie
modifierAiles et vol
modifierLes chauve-souris sont caractérisés par la transformation de leurs membres antérieurs en ailes. Les os de l'avant-bras, les métacarpes et les phalanges du deuxième au cinquième doigt sont très allongés (hypertrophie en relation avec l'adaptation au vol battu)[n 4]. Ils forment la structure de l'aile dont la surface portante de l'aile (ou patagium) est un repli de peau constitué de deux couches d'épithélium séparées par une fine couche de vaisseaux lymphatiques et sanguins (le réseau artériel et veineux aboutissant à un fin réseau capillaire qui participe à la thermorégulation de l'animal, notamment à la dissipation de la chaleur lors du vol)[38], de nerfs, de muscles et de tissus conjonctifs spécialisés[39]. Le tissu qui forme l'aile des chiroptères est l'un de ceux qui se régénère le plus rapidement dans tout le règne animal[40]. Le vol des chauves-souris serait encore plus efficient et sobre en consommation d'énergie que celui des oiseaux (moindre consommation d'oxygène) comparables en taille ou type de vol. Des tests en soufflerie réalisés en Suède et aux États-Unis avec des chauves-souris nectarivores ont montré que, comme les insectes, elles optimisent leur vol lorsque leurs ailes s'abaissent en gérant au mieux les microturbulences du bord d'attaque des ailes qui confèrent jusqu'à 40 % de la poussée[réf. souhaitée].
Le pouce n'est pas compris dans le patagium et est pourvu d'une griffe. La membrane située entre le talon, l'extrémité de la queue et le bassin – que l'on nomme uropatagium – peut servir, lorsqu'elle est large, à attraper les insectes ou accueillir les petits pendant la mise bas.
Les espèces du genre Thyroptera possèdent des ventouses qui leur permettent d'adhérer à des surfaces très lisses[41],[42].
L'anatomie comparée du membre supérieur de l'homme, des ailes des chauves-souris et des oiseaux permet de mettre en évidence que ces appendices locomoteurs sont homologues en tant que membre chiridien de tétrapode. Chez les chauves-souris, les phalanges des membres antérieurs ont cinq doigts. Sauf chez le pouce[n 5], ils sont très allongés et réunis par une double membrane cutanée alaire appelée patagium. Chez les oiseaux , les membres antérieurs comportent trois doigts[n 6] et des os fusionnés, le carpométacarpe (en jaune sur le schéma ci-contre) sur lesquels s'insèrent les rémiges primaires. Les transformations sur ces membres antérieurs allongés (hypertrophie des phalanges et développement d'une grande surface alaire via le patagium chez les chauve-souris, réduction du nombre de doigts et développement d'une grande surface alaire via les plumes chez les oiseaux) sont liées à l'adaptation au vol battu[43].
Vocalises et communication
modifierLes chiroptères disposent de capacité de communication en grande partie dans un spectre non accessible à l'oreille humaine (ultra-sons) participant aussi à l'écholocation. Selon les espèces les chiroptères émettent des sons différents, qui sont propres à l'espèce, mais qui peuvent également être entendus par d'autres chauves-souris, congénères ou d'autres espèces. (voir plus bas)
Des scientifiques ont récemment observé que certaines chauves-souris gazouillent aussi parfois à la manière d'oiseaux, émettant des chants composés de « trilles multisyllabiques et de gazouillis dans des combinaisons et des rythmes spécifiques (...) aussi complexes que les chants d'oiseaux chanteurs »[44].
Plusieurs chiroptérologues (Kirsten Bohn, Michael Smotherman, et d'autres) ont montré que (comme chez de nombreux oiseaux chanteurs) les chanteurs sont la plupart du temps chez les chauves-souris des mâles vivant au sein de sociétés où les mâles sont polygames[44]. Une hypothèse est qu'ils chantent pour faire leur cour aux femelles et défendre leurs territoires. Il semble que leurs chants ne soient pas innés, mais qu'ils fassent l'objet d'un apprentissage vocal (comme le chant complexe des oiseaux et la parole humaine)[44].
Ouïe et écholocation
modifier
| Fichier audio | |
| Écholocation de pipistrelle | |
| modifier |
La majorité des microchiroptères se dirigent grâce à l'écholocation, un système de localisation fonctionnant sur un principe similaire à celui du sonar : ils émettent des cris ultrasonores et captent en retour l’écho envoyé par les obstacles. La majorité des mégachiroptères, comme tout le genre Pteropus, ont perdu leur capacité d'écholocation. Au lieu de cela, les roussettes (ou renards volants) ont d'excellents sens de l'odorat et de grands yeux puissants[45].
Dès 1794, le savant et évêque de Pavie, Lazzaro Spallanzani met en évidence cette écholocation chez les chauves-souris en 1794 : il perce les yeux de quelques individus avec des aiguilles chauffées au rouge sans que cela n'affecte leur vol ; quand il leur bouche les oreilles avec de la cire, elle ne sont plus capables de se déplacer efficacement[46]. Un siècle et demi plus tard, en 1938, Griffin escalade une tour de Boston pour collecter une espèce différente, myotis lucifugus, dans de petits filets ; Griffin choisit cette espèce comme organisme modèle car elle a le comportement typique d'une chauve-souris vivant dans un climat tempéré, très similaire à ce qu'ont montré les expériences faites par Spallanzani et Hartridge en 1920[47]. Encore étudiant, Griffin place des chauves-souris devant un microphone que G. W. Pierce a conçu pour enregistrer des ondes sonores dont la fréquence se situait au-delà de la perception humaine. Il observe que les chauves-souris émettent des « clics » brefs caractérisés par un énorme niveau de pression acoustique[9]. Les résultats qu'il publie en 1958, ainsi que les recherches de son collègue et ami Robert Galambos en 1941, ont ensuite été confirmés pour des espèces européennes, montrant comment une chauve-souris navigue dans l'obscurité totale[48],[49].
Les chauves-souris produisent des cris en ultrasons[n 8] en faisant vibrer leurs plis ventriculaires à proximité des cordes vocales, dans le larynx. Ces vibrations acoustiques sont ensuite amplifiées dans les résonateurs situés dans le nez et la gorge et filtrées en fréquence. Les Vespertilionidés émettent le son par la gueule tandis que les Rhinolophidés le font par les narines. Les premiers sont plus aptes pour les signaux en fréquences modulées et les seconds pour les fréquences constantes. La nature du signal émis varie selon l'espèce (signature acoustique)[n 9] mais aussi selon le comportement de l’animal. Les signaux sont différents, s’il vole en transit sur un itinéraire connu, dans un milieu encombré, en action de chasse ou en capturant des proies[50].
Les études basées sur l'anatomie et la physiologie des adultes, sur les fossiles, les analyses génomiques et phylogénétiques et les recherches embryologiques font ressortir deux hypothèses concurrentes principales concernant l'acquisition de l'écholocation laryngée présente chez près de 90 % des espèces de chiroptères : une seule apparition ancestrale à l'ancêtre commun des chauves-souris modernes suivie d'une perte caractérisant la famille des ptéropodidés[51],[52],[53],[54], ou de multiples apparitions indépendantes dans deux des trois principaux groupes de chauves-souris actuels. Dans cette dernière hypothèse, deux scénarios additionnels sont envisageables : l'ancêtre commun des chauves-souris modernes est capable ou non d'écholocalisation[55],[56].
La durée typique d’un cri est de 5 ms. Les impulsions sonores doivent être très courtes car, pendant l’émission, le récepteur est sursaturé et ne peut capturer l’écho notablement plus faible. Le chevauchement entre le cri et l’écho aboutit à dresser une « fenêtre aveugle » devant la chauve-souris[n 10]. Quand elle s’approche de sa proie, elle réduit encore la durée de son cri pour diminuer la fenêtre aveugle. De nombreuses chauves-souris peuvent raccourcir leur cri jusqu’à 0,3 ms dans la phase finale d’approche, avant la capture, ce qui correspond à une fenêtre aveugle de seulement 5-6 cm[9]. Cette rafale de la phase finale d’approche provient de la contraction de muscles laryngés, jusqu'à 200 fois par seconde, ce qui en fait les muscles squelettiques les plus rapides des mammifères[57].
Russo et Jones[58] ont proposé une classification des cris de 22 espèces de chauves-souris enregistrés en Italie. Nous pouvons voir sur le schéma ci-contre quatre types importants. Les cris des Noctules (Nyctalus) et pipistrelles (et autres Vespertilionidés) se caractérisent par une modulation de fréquence abrupte (FM) suivie par une fréquence quasi constante (QCF). Les Rhinolophidés émettent des cris typiques FM/FC/FM, c'est-à-dire une longue composante à fréquence constante FC, précédée et suivie par de brefs cris à fréquences modulées FM. L'analyse de l'écholocation des Rhinolophes est très différente de l'esquisse présentée ci-dessus.
Les oreilles, dont certaines peuvent être très grandes et pourvues d'un tragus, servent de récepteurs.
Les Ptéropodidés mettent en œuvre ce sens d'une manière différente et moins performante de celle des autres chiroptères.
L'écho qui résulte des ultrasons émis permet à ce petit mammifère de localiser les objets, d'en déterminer la taille et le mouvement avec une précision extraordinaire. Des tests sur un chiroptère africain ont montré qu'il pouvait entendre les pas d'un coléoptère marchant sur le sable. Attraper au filet à mailles un petit Rhinolophe est impossible, il détecte un fil de 0,1 mm de diamètre à 10 m de distance ![réf. nécessaire]
Sens de l'orientation
modifierD'après des études menées en 2006[59],[60], comme d'autres espèces douées d'un bon sens de l'orientation (oiseaux migrateurs par exemple) elles utilisent également un minéral magnétique appelé magnétite comme « boussole interne » pour s’orienter grâce au champ magnétique terrestre.
Vision
modifierLes chauves-souris ne sont pas aveugles et il semble qu'elles aient une vue bien adaptée aux conditions nocturnes. Elles peuvent être éblouies ou perturbées par l'éclairage artificiel extérieur (phénomène dit de pollution lumineuse)[61]. La possibilité d'attraper des chauves-souris au filet tient au fait que l'écholocation n'est utilisée que lors de la chasse ou de déplacements en terrain non connu. Les déplacements connus (dans les galeries pratiquées chaque jour ou lors d'approche de territoires de chasse parcourus régulièrement) sont alors effectués sans écholocation ou en espaçant considérablement les émissions d'ultrasons. Les émissions sonores nécessaires pour l'écholocation représentent en effet une dépense énergétique très importante et les chauves-souris peuvent de la sorte économiser leurs réserves énergétiques.
Nez
modifierIl peut prendre des formes très variées.
Les Pteropodidés ont un museau pointu rappelant celui des Canidés.
Certains microchiroptères ont un appendice nasal fortement sillonné qui aide à focaliser l’onde sonore émise, pour réduire les perturbations de l’environnement. Constitué de replis de la peau, cet appendice est appelé feuille nasale.
Déjection
modifierLa déjection de chauves-souris d'Europe est semblable aux crottes de souris. La distinction se fait à la main : frottée entre deux doigts, celle de la souris s'écrase, celle de la chauve-souris s'effrite. À l'œil, on voit également dans la crotte de chauves-souris des résidus brillants (aile et élytre d'insectes). Ce guano de chauves-souris est un excellent engrais mais il faut le couper à 50 % avec de l'eau pour l'utiliser sans brûler les plantes.
Rappelons néanmoins ici que cette substance doit être manipulée avec précaution (jamais à mains nues, et avec filtre respiratoire), car les déjections de chauve-souris sont vecteur de maladies et contiennent de nombreux virus et bactéries pathogènes (voir sections suivantes).
Écologie et comportement
modifierLes mégachiroptères sont surtout crépusculaires, ne se déplacent guère la nuit et se dirigent surtout grâce à leurs yeux et leur odorat. Les microchiroptères sont nocturnes et se servent surtout de l'écholocation pour chasser et se repérer la nuit. Une étude en 2011 portant sur leurs dépenses énergétiques et leur température corporelle explique cette activité nocturne : leurs déplacements de jour provoquent en effet une trop grande surchauffe (par leurs ailes membraneuses nues et sombres qui absorbent efficacement les ondes courtes du rayonnement solaire) et un surcoût métabolique (modification de la cinématique du battement d'ailes pour évacuer ce surplus de chaleur)[62].
Les chauves-souris dorment en général 20 heures par jour, la tête en bas.
Alimentation
modifierLes mégachiroptères se nourrissent de fruits, de fleurs et de pollen.
Les microchiroptères se servent de l'écholocation pour trouver leur nourriture. Leur régime alimentaire est très varié, mais provient essentiellement du « plancton aérien ».
Les chauves-souris d'Europe sont exclusivement insectivores, ce qui explique en grande partie leur déclin[63]. Leur régime alimentaire est identique à celui de l'hirondelle de cheminée ou du martinet noir : tout ce qui est petit et vole. Lorsqu'elles tournent au-dessus des têtes, assez près souvent, c'est pour consommer le nuage de moucherons ou de moustiques qui se forme au-dessus des convives lors des soirées estivales en plein air[réf. nécessaire].
De manière générale, « elles se nourrissent chaque nuit de près du tiers de leur poids en insectes. Une Pipistrelle peut ainsi engloutir plus de 2 000 moustiques en une nuit. Une seule Noctule commune va manger près d'1 kg durant les six mois d'« estivage » ; 100 Murins de grande taille attrapent en une nuit l'équivalent de 4 000 petits carabes[64] ». Mais certaines peuvent ingurgiter de bien plus grandes quantités : certaines frugivores peuvent se nourrir quotidiennement de la moitié de leur poids, et des insectivores, jusqu'à l'équivalent de 120 % de leur poids total[65]. En effet, leur nécessaire hibernation, ainsi que leur assez long temps de sommeil quotidien (voir ci-dessus), leur imposent de "faire des réserves" et intensifient leur régime alimentaire en période de veille.
Ces caractéristiques alimentaires des microchiroptères comme prédateurs généralistes d'insectes nuisibles, ainsi que le rôle des mégachiroptères dans le cycle reproductif des végétaux, font des chauve-souris des auxiliaires des cultures, et l'un des agents de la prévention contre les maladies dont certains de ces insectes sont les vecteurs.
C'est une des raisons pour laquelle on a mis sur pied certains programmes de protection et de sauvegarde des chiroptères en général et particulièrement des microchiroptères nocturnes, afin de préserver ce cycle de prédation naturelle et « leur rôle vital au sein de la biodiversité [...], leur [fonction de] régulation des populations de moustiques et de pollinisation des fruits et des fleurs »[37] [voir ci-dessous la section : « Interaction écologique »]. Protection nécessaire, car « en quelques décennies, les populations de chauves-souris ont été décimées par les pesticides, la déforestation, l’étalement urbain »[37], la dégradation de leur habitat et la perte de leurs lieux de nichage[66] et d'hibernation [voir ci-dessous la section : « Déclin des populations »]. Certaines chassent en vol comme les pipistrelles ou les barbastelles, d'autres comme les rhinolophes chassent à l'affût, pendues à la branche d'un arbre.
Reproduction
modifier- Les chiroptères atteignent leur maturité sexuelle de la première à la troisième année suivant les espèces. Après avoir choisi un lieu de parturition, chaud, ce qui peut donner lieu à une grande migration, les femelles gardent en elles le sperme « en sommeil » pendant l'hibernation, jusqu'aux beaux jours où la fécondation s'opère par l'ouverture de la membrane du sac à sperme si les conditions sont remplies (température élevée, nourriture abondante, quiétude et regroupement en nurserie).
- Elles donnent le plus souvent naissance à un seul petit par an, le chauve-souriceau. La gémellité n'est habituelle que chez les pipistrelles et les noctules.
- La chauve-souris naît nue et aveugle. La maman parture la tête en bas et le petit doit s'accrocher de lui-même, faute de quoi il tombe au sol. Le petit rampe après quelques jours mais, bien que le vol soit inné[réf. nécessaire], ses ailes sont trop peu développées à la naissance pour le soutenir dans les airs.
- Les femelles élèvent les petits sans les mâles dans ces colonies maternelles. La femelle est dotée de deux mamelles pour allaiter. Elle utilise la peau située entre les pattes arrière et la queue comme parapet pour que le petit ne tombe pas lors des changements d'hôte.
- Les petits sont gardés par d'autres femelles hôtes pendant que les mères chassent ; la reconnaissance se fait à l'odeur.
- Le jeune Microchiroptère est autonome vers six à huit semaines tandis que le Mégachiroptère l'est vers quatre mois.
- La longévité dans la nature dépasse 15 ans pour de nombreuses espèces, 30 ans pour cinq espèces, le maximum reporté est de 41 ans pour une colonie élevée en laboratoire[67].
- Chez certaines espèces comme le Murin de Bechstein, des femelles sont capables de réguler les naissances. Il semble que lorsque les conditions sont mauvaises (manque de nourriture, perturbation de l'habitat), une sorte de décision collective soit prise pour la survie du groupe, les femelles dominantes assurant peut-être une sélection entre celles qui pourront donner la vie et les autres qui devront abandonner leur unique bébé annuel. Ces dernières secrètent une enzyme entraînant une diminution de la progestérone plasmatique qui provoque l'avortement ayant lieu en dehors du gîte[68].
Hibernation
modifierLes chauves-souris d'Europe vivent dans des endroits remplis d’insectes l’été, mais déserts l’hiver. Elles doivent alors hiberner, en attendant des jours meilleurs dans des endroits à humidité fixe et chauds (en relatif par rapport à l'extérieur froid) comme les grottes, mais un vieux tronc ou une maison non chauffée feront l’affaire. Certaines aiment avoir de l’espace, d’autres au contraire se serrent les unes aux autres pour garder la chaleur. Elles baissent leur température de 39 °C à moins de 10 °C (1 à 10 °C selon les espèces). La pulsation cardiaque diminue. Réveiller une chauve-souris en pleine hibernation risque fortement de la tuer (trop grosse consommation d'énergie pour le réveil, petit tour glacial dehors et absence de nourriture). Si vous découvrez une hibernante, reculez tranquillement sans bruit et laissez-la en paix (d'autant que toutes les espèces de chauves-souris sont protégées en France)[69],[70].
Longévité
modifierContrairement à une idée répandue, les chauves-souris ont une remarquable longévité par rapport à leur taille et leur poids (quatre fois supérieure à l'âge des rongeurs et dix fois plus que les mammifères de même taille)[72]. Grâce au baguage, les chiroptérologues ont pu déterminer qu'une vingtaine d'espèces ont une longévité supérieure à 20 ans, et plus de 30 ans pour six espèces[73]. Le record de longévité est détenu par le Murin de Sibérie (en) dont un individu capturé en 2005 en Sibérie avait 41 ans[74]. Cette longévité exceptionnelle malgré un fort taux métabolique remet en question la vieille théorie du taux de vie (en). Elle s'explique notamment par leur capacité à entrer en hibernation (ce qui les protège en cas de conditions climatiques extrêmes ou en cas de privation alimentaire)[75], leur activité nocturne et leur capacité de vol qui réduisent la pression de prédation[76]. Les chercheurs ont identifié d'autres explications qui impliquent des voies moléculaires et cellulaires d'atténuation du stress oxydant[77] et de réparation des lésions de l'ADN[n 11]. Des gènes associés au maintien des télomères et à la réparation de l'ADN[78] sont spécifiquement étudiés pour comprendre les mécanismes moléculaires mis en jeu dans le processus de vieillissement[79].
Répartition et habitat
modifierRépartition
modifierEn Europe, on ne recense que 38 espèces de microchiroptères, essentiellement insectivores appartenant à quatre familles : 1 Molossidé, 5 Rhinolophes, 31 Vespertilionidae et 1 Miniopteridae. 33 de ces espèces sont encore présentes en France métropolitaine, mais souvent de manière isolée et en petites populations. Elles bénéficient toutes d’une protection nationale[80].
Habitat
modifierLes chauves-souris choisissent un coin noir et des fissures sombres pour y faire leurs perchoirs sur lesquels elles s'accrochent, posées à plat sur le ventre ou sur le dos, ou, posture la plus emblématique, suspendues. Cette posture, par exemple chez les Rhinolophe et les Ptéropodidés, leur permet d'être inaccessibles aux prédateurs qui vivent pour la plupart au sol, suspendues au plafond, grâce à un système de blocage automatique (par des ventouses chez les Phyllostomidae et quelques autres espèces)[81].
Le lieu où elles s'abritent s'appelle le gîte. À chaque saison son gîte qui peut être naturel ou artificiel : gîte estival, gîte de transit, gîte de reproduction (appelé aussi gîte de mise bas ou nurserie), gîte de regroupement automnal (« swarming »), gîte estival. Elles peuvent utiliser des arbres (dendromicrohabitats tels que loges de pics, fentes, écorces décollées chez les espèces arboricoles), des grottes et autres cavités souterraines (anciennes carrières, caves, souterrains, tunnels chez les espèces cavernicoles), des anfractuosités des parois rocheuses et des falaises (espèces rupicoles), des bâtiments (greniers, combles, volets, caves, fissures…) et ouvrages d'art (espèces anthropophiles)[82].
- En Europe, les chauves-souris utilisent deux types de gîtes : un pour l'hiver (cavité sombre sans courant d'air avec une température et surtout une hygrométrie stable, où se mêlent mâles et femelles de plusieurs espèces pour hiberner suspendues au plafond) et un pour l'été (les mâles isolés çà et là dans les fissures de mur, toit, pont, cave ou écorce d'arbre et les femelles groupées en grande nurserie d'une même espèce dans un lieu très chaud sans courant d'air comme les combles, écurie ou tunnel d'égout).
- Durant l'hiver, les cavités souterraines sont le lieu d'hibernation d'une majorité d'espèces, et en particulier des cavernicoles : les trois espèces de rhinolophes, le grand murin, le murin à moustaches, le minioptère, etc. D'autres espèces y passent ou y séjournent plus ou moins longtemps. Ces cavités souterraines ont pour la plupart une température trop basse pour la reproduction.
- Les cavités des arbres pour les espèces sylvicoles durant l'hibernation et la reproduction : les noctules, la barbastelle, l'oreillard roux, le murin de Bechstein et le murin de Natterer. Pour d'autres espèces ce sont des gîtes secondaires.
- Les bâtiments dans les endroits où la chaleur s'accumule comme lieu de reproduction, greniers et combles pour les murins et le grand et le petit rhinolophe ou fissures et petites cavités pour les petites espèces, pipistrelles et barbastelles.
- Le dessous des ponts est souvent un gîte de transit. Les ponts ferroviaires désaffectés ainsi que les tunnels d’égout ont les faveurs des chauves-souris.
- Le recensement des populations est un travail complexe ; les mâles se déplacent tout le temps ; seule une nurserie découverte permet de faire un recensement intéressant.
Une bonne connaissance de leurs exigences écologiques permet déjà de préserver leurs gîtes traditionnels d'hibernation connus en particulier les grottes et les ouvrages souterrains (forts militaires, sapes, etc., carrières souterraines, mines désaffectées, etc.) et, pour remplacer la disparition de certains autres gîtes d'été, l'installation de nichoirs (briques creuses sous les ponts, bûches creuses dans les milieux arborés ou planchettes dans les greniers). Le taux de colonisation de tels nichoirs est cependant très variable en fonction du type de nichoir, de leur position et de la région où ils ont été posés (« ces dames » sont très difficiles pour se loger et encore plus pour élever leurs petits).
Migrations
modifierUne partie des espèces de chauves-souris est migratrice.
En Europe de l'Ouest, par exemple, au moins quatre espèces de chauves-souris sont migratrices sur de longues distances (déplacement de plusieurs centaines à plus de 3 000 - 4 000 km parcourus) : Vespertilio murinus, Pipistrellus nathusii, Nyctalus noctula et Nyctalus leisleri[83]. Début 2008, aucune donnée sur la très rare Grande noctule n’a pu valider ou invalider son éventuel statut de migratrice ou non-migratrice.
Les Chauves-souris en migration comme beaucoup d'oiseaux longent certains littoraux[84], mais traversent facilement des deltas[85], détroits, bras de mer ou petites mers. Les premières données disponibles, utilisant notamment le suivi ultrasonore[86] ont par exemple montré en Europe de l'Ouest des migrations fréquentes sur un axe principal NE-SO et une espèce a été détectée sur un axe presque nord-sud traversant la mer Noire. Des données récentes[87] laissent penser que certains groupes de Pipistrellus pipistrellus au moins pourraient également migrer sur des distances importantes.
Un suivi par radar[88] a montré en Europe du Nord qu'au-dessus de la mer, les chauves-souris volent généralement à basse altitude, même pour Nyctalus noctula (dans ce cas à 10 m au-dessus de la surface, alors qu'elle vole habituellement en hauteur, bien que quelques individus aient été vus à plus de 40 m d'altitude).
Les observations directes et automatiques ont détecté 11 espèces (sur 18 espèces potentiellement présentes) qui ont survolé l'océan à 14 km du rivage. Les détecteurs d'ultrasons ont montré que toutes les chauves-souris utilisaient leur sonar lors de ces migrations en mer, et souvent avec des fréquences légèrement plus faibles et des intervalles de pulsations plus longs que ceux utilisés sur les terres. L'altitude de vol était le plus souvent d'environ 10 m au-dessus de la mer. Les auteurs de ces études estiment que les chauves-souris doivent utiliser d'autres systèmes sensoriels de navigation à longue distance (dont le champ magnétique terrestre[89], mais qu'elles utilisent aussi les échos renvoyés par la surface de l'eau pour maintenir leur hauteur de vol et s'orienter dans l'environnement immédiat. Les chauves-souris migrantes, comme les résidentes s'alimentent au-dessus de la mer dans les zones où les insectes sont abondants dans l'air et aussi de crustacés dans les eaux de surface. Quand elles chassent les insectes ou migrent à proximité de grands objets verticaux tels que les phares ou éoliennes offshore, le radar a montré que les chauves-souris changeaient rapidement d'altitude. Les observateurs ont aussi constaté que quand elles approchaient le phare d'Utgrunden où les scientifiques avaient positionné leur radar, les chauves-souris ont toujours évité la zone proche du phare quand le radar y fonctionnait, ce qui semble confirmer l'aversion aux effets de certains rayonnements électromagnétiques déjà mise en évidence par Nicholls et Racey (2007[90], 2009[91]). Le Radar montrait que N. noctula passait d'une altitude basse au-dessus de la surface de l'eau à une altitude permettant de passer au-dessus d'une éolienne proche en quelques minutes.
Ces études ont aussi montré que toutes les chauves-souris peuvent aussi se nourrir d'insectes en mer ; Il peut s'agir d'insectes d'origine continentale emportés en mer par le vent, ou bien d'insectes eux-mêmes en migration, ou encore de chironomidés dits marins (mais qui sont pour la plupart d'origine intertidale[92] bien que quelques espèces de Clunio ou de Pontomyia soient connues pour être adaptées à l'environnement marin (P.cottoni Womersley, P. natans Edwards, P. natans Tokunaga, P. pacifica Tokunaga)[93]). De plus, au moins deux espèces de chiroptères traversant la mer Baltique volent au ras de l'eau et semblent capables d'y capturer, en s'aidant de leurs capacités d'écholocation[94],[95] peut-on supposer), des crustacés en surface (Myotis daubentonii et Myotis dasycneme ; dans des zones sans corrélation apparente avec l'abondance en insectes, la distance au littoral ou la structure sous-jacente des fonds marins. Les espèces consommées pourraient éventuellement être identifiées par analyse des excréments[96] d'un de ces chiroptères, mais qu'il faudrait d'abord capturer.
Des recherches basées sur l’étude des rapports isotopiques (du deutérium et de l'oxygène) dans les poils de l’année sont en cours pour mieux comprendre les migrations[97]. La mue se produit annuellement sous l’impulsion d’hormones. Toutes les chauves-souris des régions tempérées font une mue par an, toujours dans le gîte de reproduction[98] et toujours en fin de saison de reproduction pour les femelles, et quelques semaines après pour les mâles. Les chiroptérologues espèrent obtenir des données sur l’emplacement des gîtes estivaux et de reproduction, par analyse des poils de chauves-souris prélevés en automne ou hiver lors de leurs migrations ou sur site d’hivernation. L'empreinte isotopique de ces poils est caractéristique de la zone où vivait l'animal au moment de la mue. Des études de ce type ont déjà permis de préciser les voies et stratégies migratoires de petites migrations d’oiseaux européens sédentaires[99].
Interaction écologique
modifierPrédateurs et parasites
modifierÉtant donné leur mode de vie, les chiroptères comptent peu de prédateurs mais on en retrouve chez les oiseaux, les mammifères, les reptiles (serpents) et même chez les arachnides. En Europe, ces animaux sont occasionnellement la proie de rapaces, de serpents et, plus régulièrement, de chats[100].
De façon plus inattendue, il peut advenir que des chauves-souris soient attrapées et dévorées par des araignées. Selon une étude menée par des chercheurs de l’Université d'Aarhus (Danemark), les cas d'attaque d'araignées sur des chiroptères semblent assez courantes[101],[102].
Leurs pires ennemis restent cependant les parasites, et les chauves-souris, comme la plupart des mammifères, hébergent un nombre impressionnant d'espèces de parasites internes et externes[103]. Leurs ailes, avec les nombreux vaisseaux sanguins, sont une source de nourriture idéale pour les tiques et les puces. Des insectes hématophages de type Hippoboscidae sont des ectoparasites et vivent toute leur vie sur le corps de leur hôte[104].
En Afrique et en Océanie, dans beaucoup de régions, la roussette est pour l'homme un gibier et un plat de choix.
La sortie groupée des chauves-souris qui forment des colonies de reproduction comme les sérotines serait une possible stratégie pour diminuer la probabilité individuelle de se faire capturer par leurs prédateurs[105].
Régulation des populations d'insectes
modifierLes chauves-souris ont un rôle majeur en tant que prédateurs d'insectes ravageurs et nuisibles. Une étude publiée en 2011 dans Science faisait état de pertes pouvant aller jusqu'à 3,7 milliards de dollars par an pour les agriculteurs nord-américains, provoquées en très grande partie par le syndrome du nez blanc décimant les colonies nord-américaines[106],[107].
L'université de Floride (Gainesville), envahie par les moustiques, a accueilli dans les années 1990 une expérience sur le sujet. En , une bat house capable d'accueillir 200 000 chauves-souris fut construite avec toit de lattes et de bonnes conditions de température et de circulation d'air, et laissée à la colonisation naturelle après un premier essai de transfert resté infructueux.
Au printemps, 18 mâles s'installèrent, suivi par 300 autres mâles dans l'année; il s'agissait de molosses du Brésil. Au printemps 1995, arrivèrent plus de 1 000 femelles qui donnèrent naissance à des centaines de petites chauves-souris. En , à peu près 70 000 chiroptères peuplaient la bat house, consommant chaque nuit quelque 60 millions d'insectes réputés nuisibles, ce qui permit de ne plus utiliser le moindre produit chimique et donc de faire d'importantes économies.
Cette population de chauves-souris attira de nombreux hiboux et faucons, mais aussi de nombreux guetteurs humains, amateurs de chiroptères et d'oiseaux. Quelques années plus tard, l'expérience fut reconduite avec une autre bat house du côté du lac Alice.
Les chauves-souris pourraient être au moins aussi importantes que les oiseaux dans la régulation des populations d'insectes en milieu tropical. Deux équipes indépendantes ont démontré que certaines espèces d'insectes nuisibles proliféreraient si elles n'étaient pas traquées la nuit par les chauves-souris[108].
Interaction avec les plantes
modifierLes espèces de mégachiroptères se nourrissant de nectar sont d'excellents pollinisateurs, d'autres disséminent les graines par l'intermédiaire des déjections en vol.
Certaines espèces d'arbres comme un baobab du genre Adansonia ou bien les arbres à saucisses forment même une interaction mutualiste avec les chauves-souris. Leurs grosses fleurs, à l'odeur nauséabonde pour l'homme, s'épanouissent la nuit et pendent sur le chemin des pollinisateurs.
Vecteur et réservoir de maladies
modifierLes chauves-souris sont le second groupe de mammifères en nombre d'espèces, chez qui plus de 200 virus[109] — pour certains zoonotiques mortels — ont été isolés ou détectés[5]. Certaines chauves-souris sont migratrices et leur distribution mondiale est très étendue[110]. En outre, elles vivent souvent en très grande promiscuité au sein de colonies souvent denses, qui dans quelques cas abritent plus d'un million d'individus (20 millions dans la Bracken Cave). Les grottes, mines, granges, greniers, etc., peuvent abriter conjointement plusieurs espèces de chiroptères. De plus, certains abris tels que des grottes peuvent être utilisés depuis des millénaires, et peuvent contenir de grandes quantités de guano (parfois exploité comme engrais). Enfin, par leur faible degré d'exposition, aucun de ces lieux ne bénéficie des effets désinfectants des rayons UV solaires.
Ces caractéristiques font des chiroptères — comme c'est le cas pour les rongeurs ou pour les oiseaux pour ce qui concerne les grippes aviaires — des vecteurs ou des réservoirs (« hôtes compétents ») pour au moins quelques virus zoonotiques préoccupants pour la santé publique et vétérinaire[5],[111],[112]. Les chiroptères jouent ainsi un rôle écoépidémiologique particulier et d'importance majeure dans le monde animal.
Les maladies qu'ils véhiculent contribuent à réguler les populations animales, et sont aussi régulièrement sources de maladies émergentes chez l'Homme[111],[113].
Ces maladies peuvent être, suivant les cas, transmises à d'autres animaux, en particulier aux humains par contact, léchage ou griffure ou encore par consommation de leur viande. Les chauves-souris ne mordent normalement pas, cependant la rage peut parfois les pousser à mordre lorsque la maladie en est à un stade avancé.
Pour ces raisons, par prudence, il est déconseillé de toucher une chauve-souris, surtout si elle présente un comportement anormal, se laisse approcher ou vole difficilement. Il convient de la laisser s'échapper seule ou bien de faire intervenir un service compétent pour la soigner. Le cadavre d'un animal retrouvé mort ne doit pas être manipulé ni touché : il doit être analysé par un laboratoire spécialisé qui viendra le prendre[114].
Immunité chez les chiroptères
modifierLes chiroptères sont l'un des vecteurs de la rage et semblent directement ou indirectement (via des espèces-relai), contribuer à l'émergence et/ou à la réémergence de maladies virales parfois capables d'affecter l'Homme[111]. Les récentes épidémies ou pandémies de maladies à coronavirus ont suscité un intérêt pour l'immunologie chez les chiroptères. Il y a de nombreuses raisons à cela[115]. Des chercheurs travaillent à comprendre comment ils coexistent — généralement sans symptômes de maladie — avec ces virus ; probablement grâce à des mécanismes d'immunité innée et adaptative encore à découvrir. Ces travaux pourraient déboucher sur des thérapies médicales et vétérinaires nouvelles et plus efficaces[111]. Les progrès de la génomique et de la bioinformatique sont mis à profit pour tenter de découvrir quels sont les gènes de l'immunité chez les chiroptères (par exemple à partir de Pteropus vampyrus et Myotis lucifugus respectivement de grande et de petite taille).
Plusieurs études ont mis en avant de légères différences qualitatives et quantitatives dans la réponse immunitaire des chiroptères (par rapport aux mêmes réponses chez les autres mammifères). On cherche si ces différences ont à voir avec la capacité des chiroptères à coexister avec de nombreux virus[111]. Une première réponse est que leur système immunitaire est rendu plus performant grâce à l'efficacité des protéines P53 et MDM2[116]. En 2022, une étude du génome de vingt espèces de chiroptères provenant de France métropolitaine, de Guyane et du Gabon montre que le gène PKR, qui code la protéine kinase R (en), a été dupliqué et muté à diverses reprises chez les chiroptères alors que tous autres mammifères étudiés (primates, rongeurs, artiodactyles et carnivores) n'en possèdent qu'une copie, également moins diverse. L'étude montre aussi que ce gène a coévolué chez les chiroptères avec des pathogènes viraux variés et notamment les poxviridés[117].
Les chiroptères semblent donc parfaitement adaptés à cette cohabitation. Il existe cependant un réel danger lorsque ces virus passent la barrière des espèces. En effet, la cohabitation avec le système immunitaire hors-norme des chauves-souris rend souvent ces agents infectieux bien plus virulents et enclins à infecter d’autres espèces animales possédant une réponse immunitaire bien moindre. Ceci explique en partie les effets ravageurs qu’ont eus les récentes épidémies et pandémies de ces dernières années, comme celles d’Ebola, de SRAS, ou encore de COVID-19 [118].
Filovirus, dont virus Ebola et Marburgvirus
modifierUne étude a montré que des populations de chauves-souris tropicales jouaient un rôle de réservoir pour divers filovirus causes des flambées de fièvre hémorragique associées à des taux de mortalité élevés[119], dont :
Coronavirus
modifierL'affinité entre les chiroptères et les coronavirus
modifierLes chauves-souris sont au premier rang des hôtes naturels des coronavirus[122]. Des chercheurs dressent donc un portrait de cette cohabitation ancestrale, qui a créé une immunité particulière chez cet animal, afin de mieux comprendre ces pathogènes et de lutter contre eux[122]. Bien que les coronavirus étudiés chez l'animal avant 2020 aient été par conséquent différents de celui déclenchant la maladie de Covid-19, une étude avait montré que deux grandes familles de chauves-souris, les vespertilionidés et les rhinolophidés hébergent à elles seules 46 % des coronavirus identifiés dans le monde[122].
En , les premières analyses des patients chinois de Wuhan victimes de la Covid-19 montraient que le SARS-CoV-2 était plus proche du virus du SRAS de la chauve-souris que de celui du SRAS humain[123]. Pour autant, il était à l'époque très peu probable que la chauve-souris ait transmis directement le virus à l'humain sans le concours d'une espèce intermédiaire[123].
Jusqu'à la fin de l'année 2020, de nombreuses études convergeaient vers un relatif consensus scientifique à savoir que les chauves-souris ne causent pas directement ni ne propagent chez l'homme la COVID-19, car le SARS-CoV-2 n'a pas été détecté tel quel chez elles (même si elles constituent un réservoir de coronavirus génétiquement très proches du SARS-CoV-2), et que pour l'instant la maladie ne semble se transmettre massivement à l'homme que par l'homme[124]. De plus, bien que le passage direct et initial (du virus d'origine du SARS-CoV-2) des chauves-souris aux humains ne puisse être formellement exclu, il est généralement admis que la transmission zoonotique des coronavirus de la chauve-souris à l'humain doive passer par une espèce animale hôte intermédiaire et qu'elle soit un prérequis pour le saut de la relative barrière entre espèces. En effet les récepteurs cellulaires comme l'ACE2 — qui permet la liaison de la protéine S du virus SARS-CoV-2 à la cellule hôte — sont différents entre un humain et une chauve-souris[125] (à ce sujet, voir la sous-section "Entrée dans une cellule" de l'article détaillé consacré au SARS-CoV-2, ainsi que la sous-section "Réservoirs de coronavirus et d’autres virus" de l'article consacré au genre Rhinolophe).
De plus, les cas avérés d'animaux domestiques (surtout les chats mais aussi les chiens) qui ont été testés positifs à la Covid-19, et qui ont donc été contaminés par le SARS-CoV-2, ont été selon toute probabilité contaminés par leur propre maître[126]. Néanmoins, les propriétaires des animaux ayant été anonymés pour donner leur consentement à l'étude, on ne sait pas si ces chats et chiens fréquentent d’autres animaux, ainsi que le commente le Docteur Ly cité dans le New York Times et repris par Ouest-France et « on ne sait pas non plus si les chats de compagnie infectés vivaient exclusivement à l’intérieur ou aussi à l’extérieur, ni dans quelle mesure le virus était transmissible d’un chat à l’autre »[127].
Les docteures Dorothee Bienzle (Université de Guelph, Canada) et Els Broens (Université d'Utrecht, Pays-Bas), autrices de deux études sur la transmission de la Covid-19 aux animaux de compagnie, convergent sur le risque élevé de transmission de l'homme à l'animal et recommandent toutes deux d'éviter tout contact avec son chat ou son chien, comme on le ferait avec d’autres personnes si l'on a la Covid-19[127]. En revanche, si nos animaux de compagnie peuvent être contaminés par l'homme et sont donc porteurs du SARS-CoV-2, la réciproque est fort peu probable et rien ne prouve pour l’instant que ces animaux peuvent le transmettre à l’homme[127]. Comme le souligne la même Docteure Els Broens :
« À ce jour, aucune transmission d’animal de compagnie à l’homme n’a été signalée. Ainsi, malgré la prévalence plutôt élevée parmi les animaux de compagnie des ménages positifs au Covid-19 dans cette étude, il semble peu probable que les animaux de compagnie jouent un rôle quelconque dans la pandémie »[127].
De plus, si elle n'est pas nulle dans l'absolu, la probabilité d'une transmission du SARS-CoV-2 par la chauve-souris à nos chats et chiens par contact direct est infime, parce que ce virus proprement dit n'a pas été détecté chez elle, et parce que les espèces de chauves-souris porteuses de coronavirus les plus proches du SARS-CoV-2 (soit les Rhinolophus affinis, malayanus, marshalli et pusillus) ne vivent pas dans nos régions[128].
Nouveaux éléments sur la proximité génétique du SARS-CoV-2 et des coronavirus de chiroptères
modifierEn , une équipe franco-laotienne a découvert de nouveaux coronavirus, génétiquement très proches du SARS-CoV-2, chez des chauves-souris au Laos. Cette étude semble montrer que des coronavirus de chauves-souris, légèrement différents du SARS-CoV-2, pourraient contaminer directement l’homme[129]. Néanmoins, selon Yannick Simonin, virologue à l’université de Montpellier, « ces travaux confirment que le SRAS-CoV-2 est une zoonose due aux chauves-souris, mais ne résolvent pas la question de savoir comment la maladie est passée de la chauve-souris à l’homme »[129].
En effet, cette étude a réussi à identifier les plus proches ancêtres du SARS-CoV-2 connus à ce jour, en l’occurrence des coronavirus de chauves-souris présentes au Laos, à savoir les virus nommés "BANAL-52"[n 13], "BANAL-103" et "BANAL-236", respectivement isolés chez trois espèces de « chauves-souris fer à cheval » ou Rhinolophes : Rhinolophus malayanus, Rhinolophus marshalli et Rhinolophus pusillus ; celles-ci vivent plus au sud de la province chinoise du Yunnan, si bien que le foyer d’origine du SARS-CoV-2 pourrait être apparu dans cette région située autour du Mékong, car ces chauves-souris qui vivent dans des grottes en Chine vivent probablement également au Laos, au Myanmar (ex-Birmanie), en Thaïlande et au Vietnam[130].
Elle a aussi montré que le génome de BANAL-52 trouvé au Laos en 2020 présente une identité de 96,85 % avec SARS-CoV-2. Plus précisément, les chercheurs ont déterminé que les coronavirus de chauves-souris BANAL-52 et BANAL-103 ont en commun 16 acides aminés sur les 17 qui interagissent avec le récepteur cellulaire humain ACE2 (ou « enzyme de conversion de l'angiotensine 2 »)[130]. Néanmoins, « la totalité des sarbecovirus[n 14] des espèces chauves-souris capturées au Laos partagent une caractéristique majeure : ils sont dépourvus d’une séquence particulière, dénommé “site de clivage de la furine”, que possède en revanche le SARS-CoV-2 et qui joue un rôle majeur dans la fusion entre les membranes virale et cellulaire, ainsi que dans la transmission du virus »[130].
L’ensemble des résultats présentés dans ce "preprint" (prépublication non encore évaluée par les pairs) est en faveur de l’hypothèse selon laquelle le SARS-CoV-2 résulterait d’une recombinaison de séquences génétiques préexistantes dans des espèces de chauves-souris Rhinolophus vivant dans des massifs à reliefs karstiques, fréquents en Asie du Sud-Est et en Chine du Sud, dans lesquels l’eau a creusé de nombreuses et vastes cavités où cohabitent plusieurs espèces différentes de chauves-souris[130], facteur favorisant ces recombinaisons. « Selon les auteurs, il n’est pas impossible que des prélèvements supplémentaires chez des chauves-souris finissent par aboutir à l’identification de souches virales possédant un site de clivage de la furine. Les chercheurs pasteuriens estiment qu’on ne peut toutefois exclure d’autres hypothèses, à savoir que ce site de clivage ait été acquis à la faveur de la transmission du virus à un hôte intermédiaire, voire après une circulation du coronavirus passée inaperçue chez des humains ne présentant que peu de symptômes »[130].
Toujours est-il qu'avec l'émergence de SARS-CoV-2 nous avons bien affaire à un scénario de recombinaison génétique encore inconnu, et « l’on ignore où ces recombinaisons génétiques entre souches de sarbecovirus de chauves-souris se seraient produites et les circonstances qui ont présidé au franchissement de la barrière d’espèce entre l’animal et l’homme. Selon les auteurs, dans la mesure où les nouveaux sarbecovirus de chauves-souris identifiés par les chercheurs pasteuriens semblent avoir le même potentiel infectieux que les premières souches de SARS-CoV-2, “les personnes travaillant dans les grottes, comme les collecteurs de guano, certaines communautés religieuses ascétiques qui y passent du temps à l’intérieur ou à proximité, ainsi que les touristes qui les visitent, sont particulièrement susceptibles d’être exposés” », de même que ceux qui pratiquent le trafic illégal d’animaux sauvages[130].
Des recherches supplémentaires seront nécessaires pour évaluer si ces populations exposées ont pu être infectées par l’un de ces virus de chauves-souris laotiennes, si ces infections entraînent des symptômes, et si elles ont pu favoriser les multiples recombinaisons entre génomes de plusieurs sarbecovirus hébergés par des espèces différentes de chauves-souris dont le génome du SARS-CoV-2 serait la résultante[130]. Car il apparaît que plusieurs fragments du génome du SARS-CoV-2 semblent provenir de plusieurs souches différentes et non dériver d’un ancêtre unique. Enfin, il faudra continuer les investigations pour vérifier si ces éventuelles infections à sarbecovirus peuvent conférer une protection contre une infection ultérieure à SARS-CoV-2[130].
Rage
modifierEn Europe, les chauves-souris qui en sont parfois porteuses sont susceptibles de transmettre la rage, leurs glandes salivaires pouvant contenir deux formes de virus de la rage, le virus EBL (European Bat Lyssavirus : EBLV-1 (en) et EBLV-2 (en)) et BBL (Bokeloh Bat lyssavirus (en))[131]. Il est donc possible, mais très rare, qu'un humain contracte la rage de la chauve-souris (attention, il ne s'agit pas de la même rage que celle du chien)[132],[114] et cette maladie n'est mortelle pour l'homme que si aucun traitement n'est entrepris rapidement[133],[134].
Dans les années 1950, plusieurs morsures de chauves-souris ont entraîné des cas de rage humaine, dont une personne décédée aux Indes, deux mordues à Hambourg par des espèces d’origine africaine et une en Tchécoslovaquie[135],[136].
En Europe le risque est minime : en un peu plus d'un quart de siècle, seules 8 personnes ont été ainsi contaminées entre 1977 et 2003 (3 en Ukraine, 2 en Russie, 1 en Finlande, 1 en Lettonie et 1 en Angleterre)[114].
En France, le Haut Conseil de la santé publique a émis en 2013 un avis relatif à la vaccination antirabique préventive, traitement post-exposition et suivi sérologique des personnes régulièrement exposées au virus de la rage (voyageurs, professionnels, chiroptérologues)[137] sur la base d'un rapport également publié en 2013[138].
Cependant, dans certaines régions d'Amérique du Sud où la maladie est endémique chez des chauves-souris, dont une espèce est susceptible de chercher à sucer le sang des humains, il est conseillé de dormir sous une moustiquaire.
Histoplasmose
modifierDe plus, les fientes de chauves-souris, comme de pigeons ou de poulets, sont des lieux propices à Histoplasma capsulatum responsable de l'histoplasmose. La maladie est transmise par l'inhalation de spores. Il est donc conseillé d'éviter de s'exposer aux poussières des fientes et de porter un masque et d'arroser avec de l'eau si celles-ci devaient être nettoyées.
Déclin des populations
modifierDans toutes les zones densément habitées et d'agriculture intensive, la plupart des populations de chauves-souris sont en déclin, mais il existe quelques exceptions dans des zones où leurs gîtes et colonies ont fait l'objet de mesures de protection ou restauration. De manière générale, on constate une accentuation croissante de l'isolement des populations et des colonies.
Causes possibles
modifierLes raisons de ce déclin sont multiples et semblent, directement ou indirectement, être liées à l'activité humaine[139].
- L'utilisation immodérée des pesticides et autres produits phytosanitaires provoque d'une part la raréfaction et la banalisation de la faune entomologique qui est la nourriture des chauves-souris de l'hémisphère nord. D'autre part, certains de ces produits s'accumulent dans les tissus des chauves-souris, voire les tuent par ingestion directe.
- Il est possible que l'exposition à de nombreux polluants et substances chimiques connues pour être reprotoxiques ou perturbateur endocrinien chez d'autres espèces[140] et une perte de diversité génétique puissent affecter l'immunité des chauves-souris. On constate en tous cas des épizooties préoccupantes en Amérique du Nord avec le « syndrome du nez blanc »[141]. Des coronavirus ont aussi été signalés chez des chauves-souris européennes[142].
- La fragmentation forestière par les infrastructures ainsi que la fragmentation écologique des zones humides ou de territoires antérieurement sauvages est également responsable du déclin des chiroptères[143], ainsi que toutes les modifications paysagères liées aux activités de l'homme (monoculture, assèchement de zones humides, pollution des sols…).
- En période hivernale, la majorité des chauves-souris hivernent dans des cavités souterraines naturelles ou anthropiques (forts, mines, carrières souterraines, etc.). La fréquentation accrue de ces sites (tourisme de masse) peut conduire à des gênes des colonies et entraîner leur déclin.
- Les chauves-souris ont besoin de conditions très spécifiques pour se reproduire. Or ces sites de reproduction ont tendance à disparaître, notamment dans l'architecture récente qui laisse peu de place aux espaces inoccupés sous les toitures. La destruction ou la restauration de bâtiments anciens, la disparition des accès aux clochers, aux combles, aux caves inoccupées (il est recommandé de mettre des soupiraux avec des barreaux horizontaux plutôt que verticaux aux caves inoccupées, elles n'entrent dans ces lieux qu'en volant) ou l'abattage d’arbres creux ne font qu'amplifier cette tendance.
- Les chauves-souris sont adaptées à l'environnement nocturne et souffrent d'une pollution lumineuse croissante. Nous savions déjà que les éclairages leurrent bon nombre d'hyménoptères jusque l'épuisement les soustrayant ainsi à leurs régimes alimentaires. D'autre part, une étude récente a porté sur l'éclairage direct des chauves-souris (ici des colonies de Rhinolophus ferrumequinum, Myotis emarginatus et Myotis oxygnathus) vivant dans des bâtiments plus ou moins illuminés et non-éclairés, mais dans des bâtiments proches les uns des autres. Les chercheurs ont étudié et comparé les dates des naissances, la masse corporelle et la longueur de l'avant-bras de ces chauves-souris et ont constaté que l'éclairage artificiel retardait le développement des jeunes de ces espèces et qu'il pouvait parfois même anéantir toute une colonie. Les petits étaient significativement plus faibles dans les bâtiments illuminés que ceux des bâtiments non-éclairés. Les différences de longueur de l'avant-bras et de masse corporelle suggèrent qu'après l'accouchement le taux de croissance des jeunes est plus faible chez les chauves-souris vivant dans les bâtiments illuminés[144]. Il a été récemment suggéré un prélèvement plus important de chiroptère par les oiseaux de proie du fait qu'ils parviennent visuellement à les localiser quand ceux-ci prélèvent des insectes dans le flux lumineux de ces éclairages.
- Les surfaces réfléchissantes verticales sont des pièges sensoriels pour un grand nombre de chauves-souris qui les confondent avec des voies ouvertes et entrent en collision avec ces obstacles. En 2017, Greif et al. ont montré que les chauves-souris qu’on pensait protégées par leurs capacités d’écholocation semblent percevoir des surfaces verticales très lisses comme des zones ouvertes (sur 21 chauves-souris filmées dans un couloir de vol où a été placée une surface lisse verticale, 19 ont heurté cette surface sans la percevoir assez tôt, alors que dans le même environnement tout autre obstacle naturel était facilement évité par tous les individus observés[145]) ; il reste à étudier les effets des vitres urbaines ou de murs anti-bruit, ou certaines parois métalliques lisses verticales urbaines et à voir si les chauves-souris ont trouvé des parades ou développent un apprentissage au cours de leur vie[146],[147].
- Les éoliennes constituent une menace sérieuse pour les chauve-souris qui sont attirées par ces dispositifs (contrairement aux oiseaux, peu de cadavres de chauves-souris sont retrouvés au niveau de structures anthropiques autres que les éoliennes)[n 15]. Les espèces de haut-vol comme la noctule commune ou la noctule de Leisler, qui se déplacent au niveau des pales des aérogénérateurs vers 100 m de haut[n 16], sont menacées de disparition. Au-delà d'un seuil de mortalité des chauve-souris, le phénomène serait quasi irréversible[148],[149]. Ainsi, le développement de l’éolien pourrait contribuer à l’extinction de la Chauve-souris cendrée, une espèce migratrice nord-américaine[150].
- Une étude canadienne parue dans la revue Current Biology le montre que des chauves-souris en migration volant très près de pales d'éoliennes en rotation peuvent subir une hémorragie interne due à la chute de pression dans le sillage de la pale[151].
- Les déflagrations d'armes à feu (de chasse, ball-trap ou d'exercice militaires), des feux d'artifice, des pétards utilisés près de leurs lieux d'hivernages ou de sommeil, ou des vibrations d'engins de chantiers peuvent les sortir de leur sommeil hivernal accélérant leur rythme cardiaque, augmentant leur température, et par conséquent les épuiser avant même le sortir de l'hiver.
Détermination
modifierElle se fait au moyen d'une clé de détermination, des enregistrements sonores, et depuis peu avec des outils informatiques qui apparaissent, dont en France, un outil d'Identification assistée par ordinateur (IAO)[152] développé avec l'université de Jussieu.
Systématique
modifierL'ordre des Chiroptères a été décrit pour le naturaliste allemand Johann Friedrich Blumenbach en 1779.
Rappel : en français les chauves-souris sont nommées par de très nombreux noms vernaculaires différents (voir la section "Étymologie"). Voir aussi :
Taxinomie
modifier- Liste des sous-ordres
Selon ITIS:
- sous-ordre Megachiroptera Dobson, 1875
- sous-ordre Microchiroptera Dobson, 1875
- Liste des familles
Sous-ordres selon ITIS et familles selon MSW.
Les deux sous-ordres et familles de chiroptères sont :
- sous-ordre Megachiroptera - Mégachiroptères
- famille des Pteropodidae - Ptéropodidés (roussette)
- sous-ordre Microchiroptera - Microchiroptères
- famille des Craseonycteridae - Craséonyctéridés (craséonycte)
- famille des Emballonuridae - Emballonuridés (emballonure, rynchonyctère…)
- famille des Furipteridae - Furiptéridés (communément appelés furies, en référence aux divinités gréco-latines nommées « Érinyes » en Grèce et « Furies » à Rome)
- famille des Hipposideridae
- famille des Megadermatidae - Mégadermatidés (faux-vampire)
- famille des Molossidae - Molossidés (molosse, mulot volant...)
- famille des Mormoopidae - Mormoopidés (chauve-souris à moustaches…)
- famille des Mystacinidae - Mystacinidés (chauve-souris à queue courte)
- famille des Myzopodidae - Myzopodidés (vespertilion doré)
- famille des Natalidae - Natalidés (Murin à moustaches, chauve-souris à oreilles tubulées)
- famille des Noctilionidae - Noctilionidés (noctilion)
- famille des Nycteridae - Nyctéridés (nyctère)
- famille des Phyllostomidae - Phyllostomidés (chiroderme, vampire…)
- famille des Rhinolophidae - Rhinolophidés (phyllorine, rhinolophe…)
- famille des Rhinopomatidae - Rhinopomatidés (rhinopome)
- famille des Thyropteridae - Thyropteridés (thyroptère)
- famille des Vespertilionidae - Vespertilionidés (kérivoule, oreillard, pipistrelle, vespertilion...)
Position dans l'arbre phylogénétique
modifier| |
Les études génétiques récentes (2003) montrent que la position réelle des chiroptères dans l'arbre phylogénétique est différente de la position classique. Les chiroptères étaient autrefois pensés comme proches parents des primates et des dermoptères, mais ils en sont en fait assez éloignés[153].
| Conception ancienne | Conception récente |
|---|---|
|
|
Phylogénie des familles
modifierSelon Amador et al. (2016)[154], les 21 familles de chauves-souris partagent les relations suivantes :
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Paléontologie et histoire évolutive
modifierLa plus ancienne chauve-souris connue a été trouvée fin 2007 aux États-Unis : elle vivait au Wyoming à l'Éocène, il y a 52,5 millions d'années, et a été baptisée Onychonycteris finneyi. Les restes fossilisés et quasi complets ont été datés de 50 millions d'années. Ses membres supérieurs indiquent que l'animal pratiquait le vol battu, ses membres inférieurs indiquent qu'il était un grimpeur agile, capable de marcher à quatre pattes au sol et de se suspendre à l'aide de ses puissantes griffes. Sa denture indique qu'il consommait de préférence des insectes mais l'organisation de son oreille interne montre qu'il ne disposait pas de l'écholocation, technique aujourd'hui répandue chez toutes les chauves-souris et qui consiste à émettre des ultrasons pour éviter les obstacles et localiser les proies. Cette découverte clôt un débat scientifique, datant des années 1960, sur la nécessité ou non de l'écholocation comme condition préalable à l'apparition du vol chez les chiroptères.
L'histoire évolutive précoce des chauves-souris fait encore l'objet de nombreuses hypothèses. Il existe cependant un consensus parmi les scientifiques sur leur succès évolutif qui a été largement favorisé par leur capacité au vol battu et à l'écholocalisation, deux innovations adaptatives clés qui leur ont permis, à l'instar des dinosaures aviens, de coloniser rapidement des niches écologiques aériennes laissées vacantes après la disparition des ptérosaures lors de l'extinction Crétacé-Paléogène[155],[156].
Selon la théorie classique, les deux sous-ordres descendent d'un ancêtre commun, déjà capable de voler et d'écholocation. Ces groupes auraient divergé il y a 50 Ma. On a découvert des fossiles de Ptéropodidés datés au moins du milieu de l'Oligocène[157]. Cependant, dans les années 1980 et 1990, une autre hypothèse a considéré que les Megachiroptera était en fait un groupe proche des primates, plus précisément des lémuriens (en effet les tarsiers ressemblent beaucoup aux mégachiroptères). Dans cette hypothèse, le vol et l'écholocation serait une simple convergence évolutive[158]. D'ailleurs, au XVIIIe siècle, Georges-Louis Leclerc de Buffon ne considérait pas ces animaux comme des chauves-souris à part entière[159]. Cette hypothèse a été invalidée par les analyses phylogénétiques récentes, qui indiquent une plus longue histoire commune avec le clade des microchiroptères que l'hypothèse primate ne le permet[160],[161].
D'autres études ont récemment suggéré que certaines familles de microchiroptères frugivores comme les Rhinolophidae, les Rhinopomatidae et les Megadermatidae pourraient être plus proches de ce groupe que de celui des microchiroptères[160],[162].
Les chiroptères et l'Homme
modifierServices écosystémiques
modifierQuand ils sont encore présents dans les agroécosystèmes[163] et en tant que prédateurs de ravageurs (autrefois dits nuisibles) des champs, des rizières[164], de l'arboriculture fruitière et des forêts[165], mais aussi des moustiques qui comptent parmi les principaux vecteurs de maladies zoonotiques (maladies souvent en expansion dans le cadre du dérèglement climatique) et de la diffusion d'espèces invasives et de maladies émergentes, les chiroptères sont sources d'importants services écosystémiques[166]. Des rassemblements (hotspots) de chiroptères ont aussi été observés dans de grands espaces verts urbains — avec par exemple 16 espèces appartenant à 5 familles ; Emballonuridae, Molossidae, Noctilionidae, Phyllostomidae et Vespertilionidae dans les espaces verts d'une ville brésilienne de 4 millions d'habitants, située près de la forêt tropicale[167].
À titre d'exemple pour le secteur agricole, une étude a montré en 2015, que dans les champs de maïs américain, là où les chauves-souris sont encore présentes, elles rendent de précieux services d’auxiliaire de l’agriculture : une expérience de terrain a consisté à couvrir certaines parcelles de filets pour empêcher que les chiroptères n’y mangent les papillons de nuit[166]. Dans les parcelles encore accessibles non seulement le nombre de parasites du maïs a été fortement réduit par rapport aux parcelles-témoin, mais un effet inattendu a été démontré par l’étude : un champignon parasite (et la toxine fongique une aflatoxine produite par ce champignon) ont aussi régressé là où les chauves-souris pouvaient chasser[166]. Les auteurs plaident pour une meilleure protection des chauves-souris dans les agroécosystèmes, car elles sont des « prédateurs voraces des ravageurs des cultures », ravageurs qui font perdre chaque année plusieurs milliards de dollars américains aux agriculteurs. En protégeant les cultures de l’année, les chiroptères limitent aussi le nombre de larves de l’année suivante, ce qui réduit les dommages aux cultures ultérieures[166]. Cette étude est une démonstration locale, mais le maïs est cultivé sur plus de 150 millions d'hectares dans le monde[166]. Les auteurs ont estimé que les chauves-souris fournissent un service d’une valeur dépassant le milliard de dollars par an pour la seule récolte du maïs dans le monde[166].
Statut de protection
modifier- Au niveau mondial
Depuis 1979, au niveau international, la convention de Bonn et la convention de Berne[168] demandent aux États contractants d'assurer la protection de toutes les espèces de chauves-souris décrites dans les annexes, ainsi que la protection des gîtes de reproduction et d'hibernation.
De nombreux pays mettent en place des programmes de protection des espèces mais aussi de leurs habitats (arbres sénescents, bois mort, grottes, mines ou tunnels abandonnés, greniers, gîtes souterrains dont certains rassemblent en hivernage les individus de colonies couvrant plusieurs milliers de km2[169]…).
- Europe
En 1992, en Europe, la directive « Habitats naturels - Faune - Flore » demande aux pays de la Communauté européenne la protection stricte de toutes les espèces de chiroptères (elles figurent à l'annexe IV), ainsi que la désignation de zones spéciales de conservation pour les 12 espèces figurant à l'annexe II.
Eurobats publie des documents d'aide et conseil, de type guides de bonnes pratiques, pour la gestion forestière notamment[170].
- France
Toutes les espèces de chauves-souris présentes en France sont intégralement protégées depuis l'arrêté ministériel du relatif aux mammifères protégés sur l'ensemble du territoire[171] confirmé par l'arrêté ministériel du relatif à la protection des mammifères[172] selon l'article L. 411-1 du code de l'environnement. Il est donc interdit de les détruire, les mutiler, les capturer ou les enlever, de les perturber intentionnellement ou de les naturaliser, ainsi que de détruire, altérer ou dégrader leur milieu. Qu'elles soient vivantes ou mortes, il est aussi interdit de les transporter, colporter, de les utiliser, de les détenir, de les vendre ou de les acheter.
19 espèces sont classées dans la liste rouge de la faune menacée de France et 13 espèces sont présentes sur la liste rouge de l'UICN.
- Suisse
Les 28 espèces présentes en Suisse sont protégées par l'Ordonnance du sur la protection de la nature et du paysage (Ordonnance sur la protection de la nature et du paysage, OPN) art 14 et 20 et compléments.
- Wallonie
Les 21 espèces présentes en Wallonie sont protégées par l'annexe IIa du décret Natura 2000 du transposant les directives européennes[173].
Protection et plans de restauration
Les législations ont peu à peu évolué pour protéger les chauves-souris et leurs habitats.
Dans le monde entier des opérations conduites par des gouvernements et/ou des ONG visent à protéger ou restaurer des populations de chauves-souris. En France, il existe des plans de restauration et un écoduc dit « chiroptéroduc » a été créé dans le cadre des mesures conservatoires mises en œuvre durant la construction de l'autoroute A65 Langon-Pau[174]. Des centres de soins pour la faune sauvage peuvent contribuer à soigner des chiroptères blessés ou à identifier certaines pathologies.
Aspects culturels
modifier« Vampirisme »
modifierLes chauves-souris ne sucent pas le sang des humains ; seules quelques espèces subtropicales (vampires) qui se nourrissent ordinairement de sang du bétail blessé peuvent faire, très rarement, un écart de régime[175].
Quelques espèces de chauves-souris des régions tropicales, de la famille des Desmodontinae et dites « vampires », peuvent dans de très rares cas sucer[176] le sang d'humains durant leur sommeil. Dans ces régions à risque, l'usage d'une moustiquaire suffit pour s'en protéger ainsi que des infections qu'elles pourraient transmettre[175].
Idées reçues
modifier- À moins d'être saisies sans précaution, les chauves-souris ne sont pas agressives. Il est extrêmement rare en milieu tropical d'être mordu par une chauve-souris vampire et en Europe il est rarissime d'être attaqué et d'attraper par morsure une maladie grave comme la rage[177]. Comme tout animal sauvage, elles constituent toutefois un vecteur potentiel d'infections diverses et ne doivent pas être manipulées sans protection[114].
- Les chauves-souris ne s'accrochent pas dans les cheveux, cette idée reçue venant du fait qu'elle s'approchent près des têtes à la tombée de la nuit, pour manger les insectes volants, notamment les moustiques qui tentent de piquer les hommes[178].
- En phase de repos, les chauves-souris ne sont pas toutes suspendues, la tête en bas. Les postures sont diverses et variées selon les espèces, voire au sein d'une même espèce[179].
- Les chauves-souris ne sont pas aveugles.
- Les chauves-souris ne construisent pas de nid. Elles utilisent les gîtes naturels ou artificiels (combles, clochers, ponts, etc.) ; elles ne modifient en aucun cas le gîte qui leur est offert.
- Les chauves-souris ne font pas tout par la bouche. Elles possèdent les mêmes orifices que les humains, remplissant le même usage.
- Les chauves-souris ne s'attaquent pas aux boiseries ; ce ne sont pas des rongeurs.
- Il n'y a aucun risque de voir les chauves-souris pulluler : elles ont un petit par an, le plus souvent un tous les deux ans.
- Seule une espèce est à la fois hématophage et dangereuse pour l'Homme : elle se trouve en Amérique du Sud.
Selon le biologiste Laurent Tillon, les récits sur les chauve-souris qui sucent le sang, tels des vampires, ou qui s'accrochent aux cheveux, sont des légendes forgées par les anciens dans les campagnes et « dont la fonction première était d'effrayer les jeunes filles pour les empêcher de sortir une fois la nuit tombée[180] ».
Symbolisme
modifierLes chauves-souris ont été longtemps persécutées en Occident à cause de leurs prétendus maléfices. En les clouant aux portes des granges, on croyait lutter contre les mauvais sorts.
Les chauves-souris sont sacrées aux Tonga, en Australie, en Bosnie et en Afrique de l'ouest. Elles sont souvent considérées comme la manifestation physique d'un esprit errant. Elles sont intimement associées avec le mythe des vampires à qui on prête la capacité de se métamorphoser en animaux, notamment en chauves-souris. Elles sont aussi le symbole des fantômes, de la mort et des maladies[181].
Pour les Amérindiens (tels les Creeks, les Cherokees et les Apaches), elles représentent un esprit malin[182]. En Chine, elles sont le symbole de bonheur et de prospérité[183]. En Pologne et en Macédoine du Nord, elles sont considérées comme des animaux de bon augure[184].
Dans la culture occidentale, les chauves-souris sont souvent assimilées à la nuit avec une connotation de malheur ou de mort[181].
Elle est également l'emblème de la marque de rhum Bacardi.
Dans la symbolique de l'ornement funéraire, des sabliers ailés représentent le temps et comportent souvent des ailes d'oiseau et parfois de chauve-souris.
La chauve-souris a également pu être associée à l'homosexualité et plus précisément l'homosexualité féminine. Natalie Clifford Barney, célèbre femme de lettre du XXe siècle et ouvertement lesbienne, possédait plusieurs bijoux créés par René Lalique et offerts par ses amantes, représentant des chauves-souris. Ceux-ci sont désormais exposés au musée des Arts décoratifs de Paris[185].
-
Peson à poudre d'or, culture Akan (Muséum de Toulouse).
-
Sablier ornant la porte du caveau funéraire de la famille Fortoul des Magnans, cimetière de Jausiers, Alpes-de-Haute-Provence, France.
-
Chauve-souris (détail) Personnage des "Trois Royaumes" : l'un des romans classiques les plus populaires en Chine.
-
Cul-de-lampe.
Héraldique
modifierLa chauve-souris est un meuble héraldique très rare. Elle est posée de front, les ailes étendues. Elle peut être placée également en cimier comme dans les armes des comtes de Merode-Mesterloo et de la ville de Barcelone. La chauve-souris est aussi le cimier de la ville de Valence.
-
Armes de Barcelone.
-
Armes de Valence (Espagne).
-
Blason d'Ourdis-Cotdoussan.
Mythologie
modifierLe cocatrix est un animal fabuleux qui possède selon la légende une tête de coq, des ailes de chauve-souris et un corps de serpent ou de coq.
Camazotz est un dieu chauve-souris dans la religion maya.
Légende
modifierLa chauve-souris et le cloître de la cathédrale de Tréguier : « Au temps jadis, une souris vint à demander l'hospitalité à une hirondelle qui avait bâti son nid dans une vieille cheminée et couvait ses œufs ; celle-ci, que son mari avait abandonnée, y consentit, mais à la condition que, durant trois jours, la souris couverait à sa place. La souris accomplit sa tâche, puis elle partit. Voilà les petits éclos, mais ils étaient couverts de poils au lieu des plumes, et ils avaient une tête et un corps de souris, avec des oreilles et des ailes crochues comme le diable. L'hirondelle en mourut de chagrin ; après ses funérailles, la reine des hirondelles fit enfermer les orphelins dans le cloître de la cathédrale de Tréguier et leur défendit, sous peine de mort, de ne jamais sortir à la lumière du soleil. Voilà pourquoi on ne voit jamais de chauve-souris pendant le jour[186]. »
Dans la culture
modifierLittérature
modifierLe roman Dracula de Bram Stoker, paru en 1897, a initié le personnage du comte Dracula et a encré l'image du vampire dans la culture.
Bruce Wayne reprend l'imagerie de la chauve-souris pour incarner Batman, un super-héros sans super-pouvoirs, luttant contre le crime à Gotham City. Conçu par Bob Kane et Bill Finger, il est apparu dans un comic pour la première fois en 1939 et est depuis édité chez DC Comics.
Billy Bat est un manga coécrit par Naoki Urasawa et Takashi Nagasaki, dans le manga Billy Bat est à la fois le comic écrit par le personnage principal et également le héros dudit comic.
Kenneth Oppel a écrit une tétralogie fantaisiste autour des chiroptères (Silverwing, Sunwing, Firewing et Darkwing).
Pour apaiser la peur que la chauve-souris provoquait chez les gens, le conteur africain Amadou Hampâté Bâ a inventé une histoire pour expliquer le fait que la chauve-souris a des ailes alors que c’est un mammifère. Dans un conte extrait des « Nouveaux contes de la savane »[188], il explique l’origine de la chauve-souris par le croisement d’un renard et d’un oiseau.
Jean de La Fontaine a écrit plusieurs fables mettant en scène des chauves-souris : La Chauve-souris, le Buisson, et le Canard ou La Chauve-souris et les deux Belettes.
Les chauves-souris jouent aussi un rôle humoristique dans la série de BD La Brousse en folie.
Jeux vidéo
modifierLes chauve-souris sont des ennemis très réguliers dans les jeux vidéo. Souvent faibles, ce sont des obstacles réguliers au sein d'environnements nocturnes ou sombres comme les grottes, ou encore dans les lieux étranges ou effrayants comme les manoirs. C'est notamment le cas dans Castlevania.
Les Pokémons Nosferapti et Nosferalto de la première génération sont des chiroptères, c'est également le cas de leur évolution Nostenfer introduit dans la génération suivante, et aussi de Chovsourir et de Rhinolove dans Pokémon Noir et Blanc, ainsi que Sonistrelle et Bruyverne dans Pokémon X et Y. Ils sont tous de type Vol.
Night Hunter d'Ubisoft permet d'incarner le comte Dracula et de se transformer en chauve-souris, un des premiers jeux-vidéos permettant une telle mécanique.
Vampyrette est un familier possible dans Dofus.
Cinéma
modifierIl y a eu de nombreux films et séries reprenant les personnages du comte Dracula ou de Batman, le premier est essentiellement vu dans des films d'horreur tandis que le second est une des figures emblématiques des films de super-héros ; ce dernier a également eu le droit à un film mélangeant son univers à celui de Lego.
Les chiroptères, ou par extension les vampires, apparaissent dans de nombreuses œuvres comme L'Etrange Noël de Mr Jack ou Indiana Jones et le Temple maudit.
Le Bal des vampires est un film de Roman Polanski.
La Nuit des chauves-souris est un film américain réalisé par Louis Morneau, sorti en 1999.
Batricia est la chauve-souris dans les As de la jungle.
La Chauve-souris pas si chauve est le titre donné en français à l'un des épisodes de la série télévisée d'animation Tom et Jerry Tales.
Musique
modifierUne opérette de Johann Strauss fils créée à Vienne en 1874 s'intitule Die Fledermaus - La chauve-souris.
Divers
modifierIl existe une Rue Chauve-Souris à Liège, en Belgique.
Pour concevoir l'Éole, une machine volante à la voilure complexe, l'ingénieur français Clément Ader a imité les ailes de la chauve-souris.
La chauve-souris est le symbole emblématique du logo de la Fédération française de spéléologie.
Le célèbre chanteur de hard-rock Ozzy Osbourne (croyant avoir affaire à une chauve-souris en plastique) a malencontreusement décapité avec ses dents une chauve-souris vivante ; geste qui contribuera cependant à sa légende sulfureuse de "Prince des Ténèbres"[189].
Notes et références
modifierNotes
modifier- Orthographe recommandée par les rectifications orthographiques de 1990.
- (l'astérisque — et non l'Astérix, qui pourtant serait bien à sa place ici en Gaule — précédant le mot indique que la forme du mot a été reconstruite par les linguistes)
- La famille lexicale du mot latin căvannus est, selon certaines sources[27] reliée à celle de l'adjectif et substantif latin căvus signifiant « creux » ou « trou », et que l'on retrouve en français dans les mots « cave », « caverne », « caveau », « excavation » ou « cavité ». Tous ces mots sont issus de la racine indo-européenne commune *ƙeu-[28] (« enfler, arrondir »), qu'on retrouve aussi dans « enceinte », « cumuler », « comble ». Et l'on sait que la chauve-souris affectionne surtout les grottes, les combles ou les greniers comme habitat, plus que la chouette en tout cas à laquelle ses mœurs l'ont fait comparer. Toujours est-il que le vieux-francique *cawa, le gaulois *cauannos, le grec ancien κικκάβη ("kikkabê") et le latin căvannus[29] (signifiant selon le cas : chouette hulotte ou hibou) seraient tous en revanche plus certainement issus d'une autre racine indo-européenne commune : *kău ou *kaw- (« hurler »)[30], racine qu'on retrouve aussi dans les mots français « chat-huant » et « chouan ».
- Ce vol, « parfois entrecoupé de brefs intervalles de vol plané, peut permettre chez les meilleurs voiliers une vitesse de 40 km/heure avec dix battements par seconde et des migrations d'assez grande amplitude ». Cf André Beaumont, Pierre Cassier, Daniel Richard, Biologie animale. Les Cordés : anatomie comparée des vertébrés, Dunod, , p. 215
- Le pouce libre est utile « durant le vol pour positionner le bord d'attaque de la voilure, tout comme pour les déplacements à pied. L'ancrage du pouce est facilité par sa griffe ». Cf Laurent Arthur, Michèle Lemaire, Les Chauves-souris de France Belgique Luxembourg et Suisse, éditions Biotope, (lire en ligne), n.p..
- Le doigt II comporte une phalange, le doigt III (le seul bien développé) deux ou trois phalanges, le doigt IV une seule.
- Le détecteur est constitué d'un microphone qui capte les ultrasons, et d'un système électronique qui rend audible pour l'homme les cris ultrasonores en abaissant les fréquences jusqu'au spectre sonore que nous entendons. Couplé avec un ordinateur et un logiciel graphique de représentation des sons, il permet d'identifier les espèces, selon une méthode mise au point par Michel Barataud qui pendant près de quinze ans, capture des chauves-souris sur le dos desquelles il colle de petites gélules chimioluminescentes. Le mammifère relâché, Barataud le poursuit à pied pour l'enregistrer, ce qui lui permet d'associer une espèce à un spectrogramme. Cf Michel Barataud, Yves Tupinier, Écologie acoustique des chiroptères d'Europe. Identification des espèces, étude de leurs habitats et comportements de chasse, Biotope, , 360 p..
- Les fréquences des ondes ultrasonores sont comprises entre 15 000 et 150 000 Hz (hertz) alors que celles de la voix humaine sont comprises entre 125 et 210 Hz. L’oreille humaine perçoit en principe les sons entre 20 Hz et 20 000 Hz mais avec l’âge croissant l’audition des fréquences supérieures à 12 000 Hz diminue. Cf champ auditif de quelques espèces animales.
- Critères de détermination basés sur la fréquence, l'amplitude, la durée, l'intensité, la structure et le rythme du signal
- avec une vitesse de propagation du son de 340 m/s, le son parcourt 170 cm aller-retour au cours de cette durée. La chauve-souris ne peut détecter que des proies situées à plus de 85 cm environ.
- Selon la chiroptérologue Clara Brook, les chauves-souris ont développé ces voies pour permettre d'abord le vol très coûteux sur le plan métabolique (« Une chauve-souris en vol élèvera son métabolisme de base jusqu’à 15 fois par rapport au repos, contre 7 fois chez un rongeur en pleine course ou 2 à 3 fois chez un humain ». Ces voies auraient par la suite favorisé leur immunité antivirale et leur longévité. Les chauves-souris ont une durée de vie extraordinairement longue – la plus longue, rapportée à la taille de tous les mammifères – qui, selon nous, est un sous-produit de ces voies de résilience cellulaire développées pour le vol. Cf Nathaniel Herzber, « Les secrets de la chauve-souris, « souche à virus » au système immunitaire d’exception », sur lemonde.fr, .
- Chasse en vol, chasse à l'affût, chasse au sol (glanage)…
- Comme l'explique Marc Gozlan dans l'article cité ci-dessous, ces virus nouvellement identifiés chez les chauves-souris capturées au Laos, et dont la séquence génétique n’a rien d’anodin [ni de banal, donc], ont paradoxalement été désignés par l'acronyme « BANAL ». On devine qu’il s’agit de la concaténation de "bat" (chauve-souris, en anglais) et d’"anal", ces virus ayant été isolés à partir de prélèvements rectaux de chauves-souris.
- (le sarbecovirus est un sous-genre de bétacoronavirus regroupant les coronavirus liés au syndrome respiratoire aigu sévère, soit entre autres le SRAS et la Covid-19)
- De nombreuses études avancent des hypothèses concernant les facteurs susceptibles d'attirer les chauves-souris aux abords des éoliennes : facteurs d'attraction « directe » (ressemblance des éoliennes avec les arbres, assimilation à un gîte…), facteurs d'attraction « indirecte » (terrain de chasse favorable pour capturer des insectes qui s'agglomèrent en haut de ces structures, selon un comportement appelé sommitisme (en)). Cf (en) Paul M. Cryan, Robert M. R. Barclay, « Causes of Bat Fatalities at Wind Turbines: Hypotheses and Predictions », Journal of Mammalogy, vol. 90, no 6, , p. 1330–1340 (DOI 10.1644/09-MAMM-S-076R1.1).
- Les deux principales causes de mortalité sont la collision et le barotraumatisme. Les oiseaux ne sont victimes que de collisions, et dans une proportion plus grande que les chauves-souris dont le sonar permet de détecter les pales. Lorsque le vent fait 40 % (vitesse à laquelle la noctule est capable de voler), les éoliennes tournent parfois à près de quatorze tours par minute, impliquant des vitesses de rotation en bout de pale de plus de 300 kilomètres à l'heure. La noctule subit un barotraumatisme, c'est-à-dire que la pression de l'air arrivant sur elle fait imploser ses viscères instantanément, comme les autopsies le révèlent. Cf (en) Erin F. Baerwald, Genevieve H. D'Amours, Brandon J. Klug, Robert M.R. Barclay, « Barotrauma is a significant cause of bat fatalities at wind turbines », Current Biology, vol. 18, no 16, , p. 695-696, (en) Michael Lawson, Dale Jenne, Robert Thresher, Daniel Houck, Jeffrey Wimsatt, Bethany Straw, « An investigation into the potential for wind turbines to cause barotrauma in bats », Plos One, vol. 15, no 12, (DOI 10.1371/journal.pone.0242485).
Références
modifier- (en) Global pattern of bat species richness, carte de répartition mondiale de la richesse spécifique des chauve-souris, tirée de (en) Davi Mello Cunha Crescente Alves, Jose Alexandre Felizola Diniz-Filho, Kelly Souza, Sidney Feitosa Gouveia, « Geographic variation in the relationship between large-scale environmental determinants and bat species richness », Basic and Applied Ecology, vol. 27, no 1, , p. 2 (DOI 10.1016/j.baae.2017.12.002)
- (en) Connor J Burgin, Jocelyn P Colella, Philip L Kahn et Nathan S Upham, « How many species of mammals are there? », Journal of Mammalogy, Baltimore, Allen Press (d), OUP et ASM, vol. 99, no 1, , p. 1-14 (ISSN 0022-2372 et 1545-1542, OCLC 1800234, DOI 10.1093/JMAMMAL/GYX147)..
- (en) Don E. Wilson et DeeAnn M. Reeder, Mammal Species of the World: A Taxonomic and Geographic Reference, JHU Press, (ISBN 978-0-8018-8221-0, lire en ligne).
- (en) Don E. Wilson et DeeAnn M. Reeder, Bats in Question: The Smithsonian Answer Book, Smithsonian Institution, (ISBN 978-1-58834-511-0, lire en ligne).
- (en) Ricardo Moratelli et Charles H. Calisher, « Bats and zoonotic viruses: can we confidently link bats with emerging deadly viruses? », Memórias do Instituto Oswaldo Cruz, vol. 110, no 1, , p. 1–22 (ISSN 0074-0276, DOI 10.1590/0074-02760150048, lire en ligne, consulté le ).
- (en) Nancy Jennings, RSPB Spotlight Bats, Bloomsbury Publishing, (lire en ligne), p. 8.
- (en) Emma C Teeling, Mark S Springer, Ole Madsen, Paul Bates, Stephen J O'brien et William J Murphy, « A molecular phylogeny for bats illuminates biogeography and the fossil record », Science, Amérique septentrionale, AAAS, vol. 307, no 5709, , p. 580-584 (ISSN 0036-8075 et 1095-9203, OCLC 1644869, PMID 15681385, DOI 10.1126/SCIENCE.1105113).
- « La chauve-souris : un mammifère volant », sur vienne-nature.asso, (consulté le ).
- Christian Dietz, Otto von Helversen, Dietmar Nill (traduction Dubourg-Savage), L’encyclopédie des chauves-souris d’Europe et d’Afrique du Nord, Delachaux et Niestlé, (1re éd. 2007), 400 p.
- Arrêté ministériel pris en application de la loi n° 76-629 du 10 juillet 1976 relative à la protection de la nature (code de l'environnement).
- « Littré - chiroptère - définition, citations, étymologie », sur www.littre.org (consulté le ).
- Livret édité par le Parc naturel régional de la Guyane dans le cadre du programme OYANA et par l’Office National des Forêts de Guyane, « Les Chauves-souris de Guyane et d’Amapá », sur LivretChiroptere.pdf (consulté le ), p.3, § "Étymologie".
- Georges Cuvier, Tableau élémentaire de l'histoire naturelle des animaux, Baudouin, imprimeur..., (lire en ligne).
- « CHIROPTÈRES : Etymologie de CHIROPTÈRES », sur www.cnrtl.fr (consulté le ).
- (de) Eduard Rüppell, Philipp Jakob Cretzschmar et alii, Atlas zu der Reise im nördlichen Afrika 1826-1828, chapter: Säugethiere [« Atlas du voyage en Afrique du Nord, Chapitre : Mammifères »], (lire en ligne), page 151, Planche 29, illustrations a et b, entre les pages 74 et 75 du chapitre.
- Chloé Gurdjian, « Les 6 choses à savoir sur la chauve-souris », GEO, , § 1 : Pourquoi la « chauve-souris » s’appelle comme ça ? (lire en ligne, consulté le ).
- Editions Quae, « Les chauves-souris sont-elles des souris chauves ? », sur la Science Simplement.fr, (consulté le ).
- CNRTL : Centre National de Ressources Textuelles et Lexicales, « chauve-souris », sur cnrtl.fr, (consulté le ), définition, onglet « Lexicographie ».
- Paul Robert, Alain Rey, Josette Rey-Debove, Le Petit Robert 1, Dictionnaires Le Robert, éd. de 1990, 2175 p. (ISBN 2-85036-066-X), page 297, entrée « chauve-souris ».
- Dictionnaire étymologique et historique du français, Larousse, à l'article chauve-souris.
- Dictionnaire étymologique du français, éditions Le Robert, en annexe II, article chouette, 2.
- Emmanuèle Baumgartner & Philippe Ménard, Dictionnaire étymologique et historique de la langue française, Librairie Générale Française, coll. « Le Livre de Poche - Les Usuels de Poche », , 848 p. (ISBN 978-2-253-16004-5), page 748, à l’entrée « souris ».
- Voir aussi les articles suivants dans le Wiktionnaire : chauve-souris, et aussi chauvesouris, et même souris-chauve.
- CNRTL : Centre National de Ressources Textuelles et Lexicales, « chauve-souris », sur cnrtl.fr, (consulté le ), onglet « Etymologie ».
- Émile Littré, « « chauve-souris », définition dans le dictionnaire Littré », sur littre.org, (consulté le ).
- Dictionnaire de l’Académie française, huitième édition (1932-1935), cité dans : « Chauve-souris », sur La langue française (consulté le ), § 1.3.
- « cavannus », sur World of Dictionary.com, (consulté le ), § 3 « Related ».
- (en) Julius Pokorny, « Indo-European Etymological Dictionary », sur web.archive.org, (consulté le ), pages 592-594, entrée : « Root / lemma: ƙeu- » vers le milieu du défilement.
- (en) Charlton T. Lewis, Charles Short, « A Latin Dictionary », sur perseus.tufts.edu, (consulté le ).
- (en) Julius Pokorny, « Indo-European Etymological Dictionary », sur academiaprisca.org, (consulté le ), pages 535-536, entrée : « Root / lemma: kău- » vers le milieu du défilement.
- Le dictionnaire Gaffiot donne dans sa réédition de 1963 pour căvannus la traduction « hibou » : (la + fr) Félix Gaffiot, Dictionnaire illustré Latin-Français, Librairie Hachette, ISBN ancien : 59119-XIX-1165-29, 1963 (rééd.), puis 2000 (rééd.), 1720 p. (ISBN 978-2011667656 et 2011667658), page 280. Mais dans l’édition consultable en ligne on trouve, pour la même entrée et la même référence d’Eucher de Lyon, la traduction : « chouette hulotte » : Félix Gaffiot, « Dictionnaire Gaffiot latin-français », sur lexilogos.com, (consulté le ), page 280 entrée cǎvannus.
- Gloses de Raschi, éd. A. Darmesteter, Paris, 1909, p. 28, cité dans : CNRTL : Centre National de Ressources Textuelles et Lexicales, « chauve-souris », sur cnrtl.fr (consulté le ), onglet « Etymologie ».
- Marie de France, Fables, 23, 9, citée dans : CNRTL : Centre National de Ressources Textuelles et Lexicales, « chauve-souris », sur cnrtl.fr (consulté le ), onglet « Etymologie ».
- « Définition de chauve-souris », sur La langue française (consulté le ).
- Dauzat et Séguy, cités dans : CNRTL : Centre National de Ressources Textuelles et Lexicales, « chauve-souris », sur cnrtl.fr (consulté le ), onglet « Etymologie ».
- CNRTL : Centre National de Ressources Textuelles et Lexicales, « chauve-souris », sur cnrtl.fr, (consulté le ), onglet « Synonymie ».
- Yann Lagarde et le chiroptérologue Jean-François Julien, « La chauve-souris : à l'origine d'un animal "diabolique" », sur franceculture.fr, (consulté le ).
- (en) M.J. Kluger, J.E. Heath, « Vasomotion in the bat wing: a thermoregulatory response to internal heating », Comp Biochem Physiol, vol. 32, no 2, , p. 219-226 (ISSN 0010-406X, DOI 10.1016/0010-406x(70)90935-7).
- (en) Andrew N. Makanya, Jacopo P. Mortola, « The structural design of the bat wing web and its possible role in gas exchange », J Anat., vol. 211, , p. 687-967 (DOI 10.1111/j.1469-7580.2007.00817.x).
- Mathieu Vidard, « Les Chauves-souris », émission La Tête au carré sur France Inter, .
- (en) Photo de Thyroptera discolor sur Bat Photos - Natural History of Bats, Maymester 2004.
- Guerin Mickaël, Trait d’histoire de vie chez Thyroptera tricolore, chauve-souris de la famille des Thyropteridés. Stage CNRS Années 2004-2005 lire le document pdf.
- Daniel Richard, Patrick Chevalet, Nathalie Giraud, Fabienne Pradere, Thierry Soubaya, Biologie, Dunod, , p. 78
- Morell V (2014) When the bat sings ; Science 20 June 2014: Vol. 344 no. 6190 p. 1334-1337 ; DOI:10.1126/science.344.6190.1334 (résumé)
- « Pteropodidae - an overview | ScienceDirect Topics », sur www.sciencedirect.com (consulté le ).
- Laurent Tillon, Les Fantômes de la nuit. Des chauves-souris et des hommes, Éditions Actes Sud, , p. 78.
- H. Hartridge, « The avoidance of objects by bats in their flight », The Journal of Physiology, vol. 54, nos 1-2, , p. 54–57 (ISSN 0022-3751, DOI 10.1113/jphysiol.1920.sp001908, lire en ligne, consulté le ).
- Donald R. Griffin et Robert Galambos, « The sensory basis of obstacle avoidance by flying bats », Journal of Experimental Zoology, vol. 86, no 3, , p. 481–506 (ISSN 0022-104X et 1097-010X, DOI 10.1002/jez.1400860310, lire en ligne, consulté le ).
- Jim Lovensheimer, « Jerome Kern. By Stephen Banfield. New Haven, CT: Yale University Press, 2006. - Frank Loesser. By Thomas L. Riis. New Haven, CT: Yale University Press, 2008. - Kander and Ebb. By James Leve. New Haven, CT: Yale University Press, 2009. - To Broadway, To Life!: The Musical Theater of Bock and Harnick. By Philip Lambert. New York: Oxford University Press, 2011. », Journal of the Society for American Music, vol. 6, no 3, , p. 383–389 (ISSN 1752-1963 et 1752-1971, DOI 10.1017/s1752196312000247, lire en ligne, consulté le ).
- Tupinier, Yves, « Le monde acoustique des chauves-souris », Acoustique & Techniques, vol. 61, (lire en ligne).
- (en) Nancy B Simmons 1, Kevin L Seymour, Jörg Habersetzer, Gregg F Gunnell, « Primitive early Eocene bat from Wyoming and the evolution of flight and echolocation », Nature, vol. 451, no 7180, , p. 818-821 (DOI 10.1038/nature06549)
- (en) M S Springer, E C Teeling, O Madsen, M J Stanhope, W W de Jong, « Integrated fossil and molecular data reconstruct bat echolocation », Proc Natl Acad Sci USA, vol. 98, no 11, , p. 6241-6246 (DOI 10.1073/pnas.111551998)
- (en) Emma C Teeling 1, « Hear, hear: the convergent evolution of echolocation in bats? », Trends Ecol. Evol., vol. 24, no 7, , p. 351-354 (DOI 10.1016/j.tree.2009.02.012).
- (en) Zhen Liu, Peng Chen, Dong-Ming Xu, Fei-Yan Qi, Yuan-Ting Guo, Qi Liu, Jing Bai, Xin Zhou, Peng Shi, « Molecular convergence and transgenic evidence suggest a single origin of laryngeal echolocation in bats », iScience, vol. 25, no 4, (DOI 10.1016/j.isci.2022.104114).
- (en) Emma C. Teeling, Mark Scally, Diana J. Kao, Michael L. Romagnoli, Mark S. Springer & Michael J. Stanhope, « Molecular evidence regarding the origin of echolocation and flight in bats », Nature, vol. 403, no 6766, , p. 188-192 (DOI 10.1038/35003188.).
- (en) Taro Nojiri, Laura A.B. Wilson, Camilo López-Aguirre et al., « Embryonic evidence uncovers convergent origins of laryngeal echolocation in bats », Current Biology, vol. 31, no 7, 201o, p. 1353-1365 (DOI 10.6084/m9.figshare.13297787).
- (en) Coen P. H. Elemans, Andrew F. Mead et col, « Superfast Muscles Set Maximum Call Rate in Echolocating Bats », Science, vol. 333, no 6051, , p. 1885-1888 (DOI 10.1126/science.1207309).
- Russo Danilo, Gareth Jones, « « Identification of Twenty-Two Bat Species (Mammalia: Chiroptera) from Italy by Analysis of Time-Expanded Recordings of Echolocation Calls », Journal of Zoology, vol. 258, no 1, , p. 91-103.
- par une équipe de scientifiques de l'université de Leeds (Royaume-Uni) et de l'université Princeton (États-Unis) qui a validé cette hypothèse en soumettant de grandes chauves-souris marron (Eptesicus fuscus à une impulsion magnétique 5 000 fois plus puissante que le champ magnétique terrestre - Étude publiée dans PLoS One).
- « La boussole des chauves-souris », Sciences et Avenir.fr, (lire en ligne).
- E. L. Stone, G. Jones et S. Harris, « Street Lighting Disturbs Commuting Bats », Current Biology, (DOI 10.1016/j.cub.2009.05.058, lire en ligne).
- (en) Christian C. Voigt et Daniel Lewanzik, « Trapped in the darkness of the night: thermal and energetic constraints of daylight flight in bats », Proceedings of the Royal Society, (lire en ligne).
- « Cohabiter avec les chauves-souris - Actualités - LPO », sur www.lpo.fr (consulté le ).
- François Prud'Homme, Les chauves-souris ont-elles peur de la lumière ?, Quæ, , p. 185.
- (en) M. B. Fenton, N. B. Simmons, Bats: A World of Science and Mystery., University of Chicago Press, , p. 116.
- CNRTL : Centre National de Ressources Textuelles et Lexicales, « nicher / nichage », sur cnrtl.fr (consulté le ).
- (en) G. S. Wilkinson, J. M. South, « Life history, ecology and longevity in bats », Aging Cell., vol. 1, no 2, , p. 124–131 (DOI 10.1046/j.1474-9728.2002.00020.x).
- Laurent Tillon, Les Fantômes de la nuit. Des chauves-souris et des hommes, Éditions Actes Sud, , p. 57.
- Arthur Béague, « Les chauves-souris et l'hiver », sur L'eau Vive, .
- Lycée de Ceret, « L'écholocation et l'hibernation des chauves souris », , p. 10.
- (en) Thomas H. Kunz, Ecological and Behavioral Methods for the Study of Bats, Smithsonian Institution Press, , p. 53
- Frédéric Keck, Arnaud Morvan (dir.), Chauves-souris. Rencontres aux frontières entre les espèces, CNRS éditions, , p. 112
- (en) A. J. Podlutsky, A. M. Khritankov, N. D. Ovodov, S. N. Austad, « A New Field Record for Bat Longevity », The Journals of Gerontology Series A Biological Sciences and Medical Sciences, vol. 60, no 11, , p. 66 (DOI 10.1093/gerona/60.11.1366).
- François Prud’Homme, 40 idées fausses sur les chauves-souris, Quæ, , p. 48-49
- (en) J. Munshi-South, G. S. Wilkinson, « Bats and birds: Exceptional longevity despite high metabolic rates », Ageing Research Reviews, vol. 9, no 1, , p. 12–19 (DOI 10.1016/j.arr.2009.07.006).
- (en) Pablo Szekely, Yael Korem, Uri Moran, Avi Mayo, Uri Alon, « The Mass-Longevity Triangle: Pareto Optimality and the Geometry of Life-History Trait Space », PLoS Comput Biol, vol. 11, no 10, (DOI 10.1371/journal.pcbi.1004524, lire en ligne).
- (en) Joanna Kacprzyk et al., « A Potent Anti-Inflammatory Response in Bat Macrophages May Be Linked to Extended Longevity and Viral Tolerance », Acta Chiropterologica, vol. 19, no 2, , p. 219- 228 (DOI 10.3161/15081109ACC2017.19.2.001).
- (en) Nicole M. Foley, « Growing old, yet staying young: The role of telomeres in bats’ exceptional longevity », Science Advances, vol. 4, no 2, (DOI 10.1126/sciadv.aao0926).
- Pascal Douek, Éric Boulanger, Fabien Guez, Le grand livre des secrets de la longévité, Éditions Leduc, , p. 36
- Décret no 2002335 du portant publication de l'amendement à l'accord relatif à la conservation des chauves-souris en Europe.
- Laurent Tillon, Les Fantômes de la nuit. Des chauves-souris et des hommes, Éditions Actes Sud, , p. 149.
- François Prud’Homme, 40 idées fausses sur les chauves-souris, Quæ, , p. 66-104
- Hutterer R, Ivanova T, Meyer-Cords C. et al., Bat migrations in Europe : a review of banding data and literature, Bonn, Federal Agency for Nature Conservation, .
- AHLE´N, I. 1997a. Migratory behaviour of bats at south Swedish coasts. Zeitschrift fu¨r Sa¨ugetierkunde 62:375–380.
- R.M.R. Barclay 1984, « Observations on the migration, ecology and behaviour of bats at Delta Marsh, Manitoba », Canadian Field Naturalist, vol. 98, no 3, , p. 331–336.
- I. Alhén et H.J. Baagøe, « Use of ultrasound detectors for bat studies in Europe—experiences from field identification, surveys and monitoring », Acta Chiropterologica, vol. 1, no 2, , p. 137–150 (lire en ligne [PDF]).
- Josef Bryja (Hongrie).
- Ingemar Ahle, N, Hans J. Baagøe et Lothar Bach, [Behavior of scandinavian bats during migration and foraging at sea], Journal of Mammalogy, Journal of Mammalogy (American Society of Mammalogists), 90(6):1318–1323, 2009.
- R.A. Holland, K. Thorup, M.J. Vonhof, W.W. Cochran et M. Wikelski, « Navigation: bat orientation using Earth’s magnetic field », Nature, vol. 444, , p. 702.
- B. Nicholls et P.A. Racey, « Bats avoid radar installations: could electromagnetic fields deter bats from colliding with wind turbines? », PLOS ONE, vol. 2, no 3:e297, (DOI 10.1371/journal.pone.0000297).
- (en) B. Nicholls et P.A. Racey, « The aversive effects of electromagnetic radiation on forgaing bats—a possible means of discouraging bats from approaching wind turbines », PLoS ONE, vol. 4, no 7:e6246, (DOI 10.1371/journal.pone.0006246).
- (en) D. Neumann, « Adaptations of Chironomids to Intertidal Environments », Annual Review of Entomology, vol. 21, , p. 387-414 (résumé).
- (en) Lanna Cheng et H. Hashimoto, « The marine midge Pontomyia (Chironomidae) with a description of females of P.oceana Tokunaga », Systematic Entomology, vol. 3, no 3, , p. 189–196 (DOI 10.1111/j.1365-3113.1978.tb00115.x, résumé).
- E.K.V. Kalko, et H-U. Schnitzler. 1989. The echolocation and hunting behaviour of Daubenton's bat, Myotis daubentoni. Behaviour Ecology Sociobiology 24:225–238.
- B.M. Siemers, P. Stilz et H-U. Schnitzler, « The acoustic advantage of hunting at low heights above water: behavioural experiments on the European ‘trawling bats’ Myotis capaccini, M. dasycneme and M. daubentonii », Journal of Experimental Biology, vol. 204, , p. 3843–3854 (lire en ligne).
- Beck, A. 1995. Fecal analyses of European bat species Myotis . 32/33:109–119.
- Ana G Popa-Lisseanu et Christian C Voigt, Relier l’Europe : Retracer les migrations des chauves-souris grâce aux empreintes isotopiques contenues dans leurs poils, 2008
- Cryan et al. 2004.
- Hobson et al. 2004.
- Site GCP, page sur la disparition des chauve-souris.
- Site maxiscience, les araignées redoutables prédatrices pour les chauves-souris.
- (en) Martin Nyffeler et Mirjam Knörnschild, « Bat predation by spiders », Plos One, Danemark, Trine Bilde, Aarhus University, (DOI 10.1371/journal.pone.0058120, lire en ligne, consulté le ).
- Clément Léger, « Bat parasites (Acari, Anoplura, Cestoda, Diptera, Hemiptera, Nematoda, Siphonaptera, Trematoda) in France (1762–2018): a literature review and contribution to a checklist », Parasite, vol. 27, , p. 61 (ISSN 1776-1042, PMID 33206593, DOI 10.1051/parasite/2020051, lire en ligne ).
- Entomologie médicale et vétérinaire, page 408.
- (en) Klára J. Petrželková, Jan Zukal, « Does a live barn owl (Tyto alba) affect emergence behaviour of serotine bats (Eptesicus serotinus)? », Acta Chiropterologica, vol. 5, no 2, , p. 177-184 (DOI 10.3161/001.005.0202).
- J.G. Boyles, P.M. Cryan, G.F. McCracken et T.H. Kunz, « Economic Importance of Bats in Agriculture », Science, vol. 332, no 6025, , p. 41-42 (DOI 10.1126/science.1201366, lire en ligne [PDF]).
- avec l'AFP, « USA: des chauves-souris décimées », Le Figaro.fr, (lire en ligne).
- Source : Science, .
- L'anagramme de « chauve-souris » est « souche à virus ».
- (en) Xing-Yi Ge, Ning Wang, Wei Zhang et Ben Hu, « Coexistence of multiple coronaviruses in several bat colonies in an abandoned mineshaft », Virologica Sinica, vol. 31, no 1, , p. 31–40 (ISSN 1995-820X, DOI 10.1007/s12250-016-3713-9, lire en ligne, consulté le ).
- (en) M. L. Baker, T. Schountz et L.-F. Wang, « Antiviral Immune Responses of Bats: A Review », Zoonoses and Public Health, vol. 60, no 1, , p. 104–116 (ISSN 1863-2378, DOI 10.1111/j.1863-2378.2012.01528.x, lire en ligne, consulté le ).
- (en) Youssef Arnaout, Evelyne Picard-Meyer, Emmanuelle Robardet et Julien Cappelle, « Assessment of virus and Leptospira carriage in bats in France », PLOS ONE, vol. 18, no 10, , e0292840 (ISSN 1932-6203, PMID 37862301, PMCID PMC10588846, DOI 10.1371/journal.pone.0292840, lire en ligne, consulté le )
- « Les secrets de la chauve-souris, « souche à virus » au système immunitaire d’exception », Le Monde.fr, (lire en ligne, consulté le ).
- « sur les chauves-souris »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) par l'Institut Scientifique de Santé Publique (I.S.P.), Section Épidémiologie, en collaboration avec l'Institut Scientifique de Santé Publique (I.S.P.), Section Rage & Parasitologie et la Communauté française de Belgique - Direction Générale de la Santé (mise à jour : )- Page consultée en .
- « COVID-19 Is Just The Beginning. Here's Why. | Answers With Joe » [vidéo], sur YouTube (consulté le ).
- Docteur Bruno LINA, virologue, "C dans l'air" du vendredi , à 0 h 24 min.
- (en) Stéphanie Jacquet, Michelle Culbertson, Chi Zhang, Adil El Filali, Clément De La Myre Mory et al., « Adaptive duplication and genetic diversification of protein kinase R contribute to the specificity of bat-virus interactions », Science Advances, vol. 8, no 47, (DOI 10.1126/sciadv.add75 ).
- Coralie Lemke, « Coronavirus : la chauve-souris abrite des maladies fatales », sur Sciences et Avenir, (consulté le ).
- (en) Kevin J. Olival et David T. S. Hayman, « Filoviruses in Bats: Current Knowledge and Future Directions », Viruses, vol. 6, no 4, , p. 1759–1788 (DOI 10.3390/v6041759, lire en ligne, consulté le ).
- Des chauves-souris réservoir du virus Ebola Fiche 231 - sur le site de l'IRD (Institut de recherche pour le développement). Site consulté le .
- Éric Leroy, X. Pourrut et J.-P. Gonzalez, « Les chauves-souris, réservoirs du virus Ebola : le mystère se dissipe », Médecine/Sciences, vol. 22, no 1, (DOI 10.7202/012237ar, lire en ligne [PDF]).
- Hervé Ratel, « Coronavirus et chauve-souris : une longue histoire », Sciences et Avenir, (lire en ligne, consulté le ).
- Camille Gaubert, « Coronavirus chinois : pourquoi la chauve-souris ne serait pas la seule coupable », Sciences et Avenir, (lire en ligne, consulté le ).
- (en) Chelmala Srinivasulu & Sanjay Molur du CCINSA [Chiroptera Conservation and Information Network of South Asia (« Réseau de Conservation et d'Information sur les Chiroptères d'Asie du Sud »)], « BATS DON’T CAUSE OR SPREAD COVID-19 » [« Les chauves-souris ne causent ni ne propagent la Covid-19 »], sur Zoo’s Print, Zoo Reach.org, (consulté le ). Plusieurs arguments et références de cet article sont repris en français dans l'article suivant : natagora "La nature avec vous", « Chauve-souris et coronavirus : démêler le vrai du faux », sur natagora.be, (consulté le ).
- Erwan Sallard, « Les interférons de type I et III : des effecteurs de l’immunité innée antivirale », Planet Vie - ENS, (lire en ligne, consulté le ).
- (en) Mythili Dileepan et alii, extrait de la revue : Virulence Volume 12, 2021, « Seroprevalence of SARS-CoV-2 (COVID-19) exposure in pet cats and dogs in Minnesota, USA » [« Séroprévalence de l’exposition au SARS-CoV-2 (COVID-19) chez les chats et les chiens de compagnie au Minnesota, États-Unis »], sur Taylor & Francis Online, ou tandfonline.com, (consulté le ).
- François Grégoire, « Covid-19. Les animaux domestiques contaminés peuvent-ils transmettre le virus ? On vous répond », Ouest-France, (lire en ligne, consulté le ).
- natagora "La nature avec vous", « Chauve-souris et coronavirus : démêler le vrai du faux », sur natagora.be, (consulté le ).
- Audrey Dufour, « Que nous apprend la découverte de nouveaux coronavirus chez des chauves-souris au Laos ? », La Croix, (lire en ligne, consulté le ).
- Marc Gozlan, « Des coronavirus de chauves-souris très proches du SARS-CoV-2 identifiés au Laos », Le Monde, (lire en ligne, consulté le ).
- Jean-Marie Huraux, Traité de virologie médicale, De Boeck Secundair, , p. 555.
- La contamination ne se fait que si du sang ou de la salive entrent directement dans les yeux, le nez, la bouche ou une blessure.
- En cas de doute faire immédiatement une désinfection locale puis consulter un médecin qui décidera si une vaccination doit être pratiquée.
- François Prud'homme, Les chauves-souris ont-elles peur de la lumière ? : 100 clés pour comprendre les chauves-souris, Versailles, Éditions Quae, , 207 p. (ISBN 978-2-7592-1970-4, ISSN 2261-3188, lire en ligne), p. 23.
- François Baud, « Chauves-souris, rage et vampires », Musées de Genève, , p. 15-18.
- (en) M. Kaplan, « Notes on bats rabics in India and Germany : Document Nations Unies », WHO Rabics 47, .
- Haut Conseil de la santé publique (2013), Avis relatif à la vaccination antirabique préventive, traitement post-exposition et suivi sérologique des personnes régulièrement exposées au virus de la rage (voyageurs, professionnels, chiroptérologues), Avis publié le .
- Haut Conseil de la santé publique (2013), Vaccination antirabique préventive, traitement post-exposition et suivi sérologique des personnes régulièrement exposées au virus de la rage (voyageurs, professionnels, chiroptérologues) publié le .
- Commission de Protection des Eaux, du Patrimoine, de l’Environnement, du Sous-sol et des Chiroptères, « Nature et pollutions, L’essentiel de ce qu’il faut savoir sur l’environnement et les multiples agressions qu’il subit », sur CPEPESC (consulté le ).
- A Caravieri, R Scheifler (2012) Effets des substances chimiques sur les Chiroptères: état des connaissances, pdf 65 p. ; avec plan-actions-chiropteres.fr
- Bulletin d'information de Radio-Canada (avec vidéo) sur le Syndrome du nez blanc (au Québec)
- Brève d'information sur la présence de coronavirus chez les chauves-souris européennes.
- Dai Fukui, Toshihide Hirao, Masashi Murakami et Hirofumi Hirakawa ; Effects of treefall gaps created by windthrow on bat assemblages in a temperate forest ; ; Forest Ecology and Management, vol. 261, Issue 9, 1 May 2011, Pages 1546-1552 (Résumé)
- S. Boldogh, D. Dobrosi et P. Samu, « The effects of the illumination of buildings on house-dwelling bats and its conservation conséquences », Acta Chiropterologica, vol. 9, (lire en ligne [PDF]).
- (voir la vidéo : http://www.sciencemag.org/news/2017/09/why-do-bats-crash-smooth-surfaces-they-never-see-them-video-reveals?_ga=2.32649718.995006870.1505145618-1420427352.1480973542)
- Stefan Greif, Sándor Zsebők, Daniela Schmieder, Björn M. Siemers & al. “Acoustic mirrors as sensory traps for bats” ; Science : vol. 357, no 6355, p. 1045-1047 DOI:10.1126/science.aam7817
- Peter Stilz & al. (2017) “Perspective Echolocation How glass fronts deceive bats “ |Science | | vol. 357, Issue 6355, p. 977-978 | DOI: 10.1126/science.aao2989
- Société française pour l'étude et la protection des mammifères, « Le déploiement des éoliennes, un problème majeur pour la biodiversité : assisterons-nous silencieusement à la disparition des chauves-souris ? » [PDF], (consulté le ).
- Société française pour l'étude et la protection des mammifères, « Éolien : la fin des chauve-souris ? », L'Écologiste, vol. 23, no 59, .
- Muséum national d'Histoire naturelle, « Où et comment implanter les éoliennes pour épargner les chauves-souris ? », sur www.mnhn.fr (consulté le ).
- Erin F. Baerwald, G.H. D'Amours, B.J. Klug et R.M.R. Barclay, « Barotrauma is a significant cause of bat fatalities at wind turbines », Current Biology, vol. 18, (lire en ligne).
- Identification des chauves-souris de France.
- Frédéric Delsuc, Jean-François Mauffrey et Emmanuel Douzery, « Une nouvelle classification des mammifères », Pour la science, vol. 303, (lire en ligne [PDF]).
- (en) Lucila I. Amador, R. Leticia Moyers Arévalo, Francisca C. Almeida, Santiago A. Catalano et Norberto P. Giannini, « Bat Systematics in the Light of Unconstrained Analyses of a Comprehensive Molecular Supermatrix », Journal of Mammalian Evolution, (ISSN 1064-7554, DOI 10.1007/s10914-016-9363-8).
- (en) Nancy B. Simmons, « An Eocene Big Bang for bats », Science, vol. 307, no 5709, , p. 527-528 (DOI 10.1126/science.1108871)
- (en) Sophia C. Anderson, Graeme D. Ruxton, « The evolution of flight in bats: a novel hypothesis », Mammal Review, vol. 50, no 4, , p. 426-439 (DOI 10.1111/mam.12211)
- (ADW, 2009).
- Pettigrew JD, Jamieson BG, Robson SK, Hall LS, McAnally KI et Cooper HM, « Phylogenetic relations between microbats, megabats and primates (Mammalia: Chiroptera and Primates) », Phil. Trans. R. Soc. B, vol. 325, no 1229, , p. 489-559 (lire en ligne [PDF]).
- Description de la Roussette.
- (en) GN Eick, DS Jacobs et CA Matthee, « A nuclear DNA phylogenetic perspective on the evolution of echolocation and historical biogeography of extant bats (chiroptera) », Molecular biology and evolution, vol. 22, no 9, , p. 1869–86 (PMID 15930153, DOI 10.1093/molbev/msi180, lire en ligne).
- (en) « Primitive Early Eocene bat from Wyoming and the evolution of flight and echolocation », Nature, (DOI 10.1038/nature06549, résumé).
- (en) RM Adkins et RL Honeycutt, « Molecular phylogeny of the superorder Archonta », Proceedings of the National Academy of Sciences, vol. 88, no 22, , p. 10317–10321 (PMID 1658802, lire en ligne [PDF]).
- Kalda, O., Kalda, R., & Liira, J. (2015). Multi-scale ecology of insectivorous bats in agricultural landscapes. Agriculture, Ecosystems & Environment, 199, 105-113.
- Puig-Montserrat, X., Torre, I., López-Baucells, A., Guerrieri, E., Monti, M., Ràfols-García, R.... & Flaquer, C. (2015). Pest control service provided by bats in Mediterranean rice paddies: Linking agroecosystems structure to ecological functions. Mammalian Biology-Zeitschrift für Säugetierkunde.
- Maas, B., Karp, D. S., Bumrungsri, S., Darras, K., Gonthier, D., Huang, J. C. C.,... & Williams‐Guillén, K. (2015). Bird and bat predation services in tropical forests and agroforestry landscapes. Biological Reviews.
- Josiah J. Maine & Justin G. Boylesa (2015) Bats initiate vital agroecological interactions in corn ; Gretchen C. Daily, Stanford University, Stanford, CA ; doi: 10.1073/pnas.1505413112 (résumé et [www.pnas.org/lookup/suppl/doi:10.1073/pnas.1505413112/-/DCSupplemental. photos du site d'expérimentation (avant et après pose des filets)].
- de Araújo, M. L. V. S., & Bernard, E. (2015). Green remnants are hotspots for bat activity in a large Brazilian urban area. Urban Ecosystems, 1-10 (résumé)
- [1] Annexe II (Convention relative à la conservation de la vie sauvage et du milieu naturel de l'Europe et [2] Annexe IV (Convention relative à la conservation de la vie sauvage et du milieu naturel de l'Europe)
- ex: Eurobats no 2 « Protection et gestion des gîtes souterrains pour les chiroptères » (ISBN 978-92-95058-06-4) ([Télécharger ce document, de 21 pages, en PDF) (fr)].
- Plaquette intitulée « Chauves-souris et gestion forestière » téléchargeable (Version française 2009)
- « Journal officiel du 19 juin 1981, p. 54760 », sur legifrance.gouv.fr.
- Arrêté du fixant la liste des mammifères terrestres protégés sur l'ensemble du territoire et les modalités de leur protection consultable en ligne.
- L'ensemble de la loi sur la conservation de la nature est consultable en ligne.
- (voir photo p 8/24 in de presse : Concilier aménagement du territoire et préservation de la biodiversité)
- Chauve-souris Vampire sur Terra Nova - Consulté en .
- ou plus exactement laper le sang qui s'écoule de leur légère morsure avec leur salive anticoagulante.
- En Europe le risque d'attraper la rage par morsure, léchage ou griffure est minime : en un peu plus d'un quart de siècle, seules 8 personnes ont été ainsi contaminées entre 1977 et 2003 (3 en Ukraine, 2 en Russie, 1 en Finlande, 1 en Lettonie et 1 en Angleterre) - Information sur les chauves-souris par l'Institut Scientifique de Santé Publique (I.S.P.), Section Épidémiologie, en collaboration avec l'Institut Scientifique de Santé Publique (I.S.P.), Section Rage & Parasitologie et la Communauté française de Belgique - Direction Générale de la Santé (mise à jour : )- Page consultée en .
- François Prud'homme, Les chauves-souris ont-elles peur de la lumière ? : 100 clés pour comprendre les chauves-souris, Versailles, Éditions Quae, , 207 p. (ISBN 978-2-7592-1970-4, ISSN 2261-3188, lire en ligne), p. 26.
- Frederic Keck, Arnaud Morvan, Chauves-souris. Rencontres aux frontières entre les espèces, CNRS Editions, , p. 71.
- Laurent Tillon, Les Fantômes de la nuit. Des chauves-souris et des hommes, Éditions Actes Sud, , p. 18.
- Manon Corriveau, « Sourissimo la chauve-souris » (consulté le )
- DEHONDT Christophe, « Le Symbolisme des Animaux » (consulté le )
- En chinois, la prononciation de « chauve-souris », « 蝠 » (fú) est identique à celle de « 福 » (fú) « bonheur, chance, prospérité ». Voir Fondation Baur, Musée des arts d’Extrême-Orient Bestiaire chinois, p.4, ainsi que Wiktionnaire 蝠 et 福.
- « Origine et signification de la Chauve-Souris dans les provinces du Levant espagnol »
- « Les bijoux de Natalie Clifford-Barney », sur madparis.fr (consulté le ).
- Légende recueillie par G. Le Calvez, instituteur à Caulnes à la fin du XIXe siècle, citée par Le Télégramme no 20288, 22 septembre 2010
- « Kernascléden. Les chauves-souris prêtes pour la réouverture », sur ouest-france.fr,
- Amadou Hampâté Bâ, « Nouveaux contes de la savane » (éd. Stock 1999)
- La Rédaction, « Ozzy Osbourne arrache la tête d’une chauve-souris », sur Rolling Stone, (consulté le )
Voir aussi
modifierBibliographie
modifier- C. Dietz, O. Helversen, Illustrated identification key to the bats of Europe, 2004, 73 pages, 228 photographies et 14 dessins. Publication électronique. Version 1.0 / 15.12.04.
- Plaquette intitulée « Chauves-souris et gestion forestière » téléchargeable (Version française 2009).
- L. Arthur, M. Lemaire, Les Chauves-souris- Maîtresses de la nuit, Éditions Delachaux et Niestlé, 1999 (ISBN 2-603-01147-2).
- W. Schober, E. Grimmberger, Les Chauves-souris d’Europe, Éditions Delachaux et Niestlé, 1991, 223 pages (ISBN 2-603-00748-3)
- Le Guide des chauves-souris en Poitou-Charentes, Olivier Prévost, geste édition (ISBN 2-84561-162-5)
- Protection et gestion des gîtes souterrains pour les Chiroptères, 2007/2008, ONU/Eurobats, 21 pages (ISBN 978-92-95058-07-1).
- J. Fairon et al. Guide pour l'aménagement des combles et clochers des églises et d'autres bâtiments. Édité par le Ministère de la Région wallonne, Direction générale des Ressources naturelles et de l’Environnement. Brochure technique no 4. Édition 2033. 79 pages. Lire en ligne.
- Gary Grant, Kelly Gunnell, Carol Williams, Landscape and Urban Design for Bats and Biodiversity (Design urbain et des paysages pour les chauves-souris et la biodiversité), Bat Conservation Trust, Landscape Institute ; 35 p., Ed:NHBS
- Daniel Demontoux, « Des mammifères vraiment extra-ordinaires ! Les chauves-souris », Couleurs de Provence Alpes Méditerranée, Nice, Nice-matin, , p. 28 à 35 (ISSN 1287-9436)
- « La chauve-souris sort de l’ombre », Terre & nature (hors-série), 2008, 31 p. (ISSN 1661-2558)
Filmographie
modifierArticles connexes
modifier- Bat Conservation International
- Biospéologie
- Chiroptera (classification phylogénétique)
- Liste alphabétique des noms de genres de chiroptères
- Liste alphabétique des noms vernaculaires de chiroptères
- Liste détaillée des familles et genres de chiroptères
- Nuit européenne de la chauve-souris
- Pollution lumineuse
- Syndrome du nez blanc
- Souris (homonymie)
Liens externes
modifierTaxonomie
modifier- (en) Référence Fauna Europaea : Chiroptera (consulté le )
- (fr + en) Référence ITIS : Chiroptera Blumenbach, 1779
- (en) Référence Animal Diversity Web : Chiroptera
- (en) Référence NCBI : Chiroptera (taxons inclus)
Autres liens externes
modifier- «Chauves-souris, les ailes du virus», La Méthode scientifique, France Culture,
- Dossier sur les chauves-souris sur Futura environnement.
- Journal francophone de chiroptérologie
- Les chauves-souris d'expérimentation sur le site du Conseil canadien de protection des Animaux.
- Loxias 16: Mythologie de la chauve-souris dans la littérature et dans l'art
- Bienvenue sur la planète chauve-souris... le site du muséum de Bourges, spécialisé sur les chauves-souris.
- Chauve-souris blessée ou petit tombé du nid, que faire ?
- Contacts chiroptères régionaux en France
- PNUE Site officiel du Programme des Nations unies pour l'Environnement. 2011 Année de la chauve-souris