Changement conformationnel
En biochimie, un changement conformationnel est la transition entre deux géométries moléculaires, souvent induite par des facteurs environnementaux.
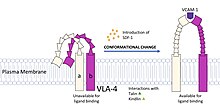
Une macromolécule est le plus souvent flexible et dynamique, chaque configuration tridimensionnelle possible définissant une conformation. La forme d'une macromolécule peut se modifier en réponse à un changement dans les paramètres environnementaux tels que la température, le pH (acidité, basicité), le champ électrique, la salinité, la lumière (sur les chromophores), la phosphorylation ou la liaison d'un ligand. Ces modifications structurelles peuvent être d'ampleur variable, de l'ordre de quelques dizaines de picomètres jusqu'au nanomètre, et de rapidité également très variable, de l'ordre de la nanoseconde jusqu'à la seconde ; elles sont associées à des phénomènes physiologiques tels que l'allostérie[1] et la catalyse des enzymes[2].
Les changements conformationnels jouent un rôle fonctionnel important pour toute une variété de protéines, par exemple :
- les canaux ioniques[3] ;
- la catalyse enzymatique[4] ;
- la formation de complexes de protéines (en)[5] ;
- les mécanorécepteurs et la mécanotransduction (en)[6] ;
- la motilité et les protéines motrices[7] ;
- la régulation de la cinétique enzymatique[8]
- les transporteurs ABC[9] ;
- le transport membranaire de métabolites[10].
Il existe de nombreuses techniques biophysiques permettant d'étudier les changements conformationnels des macromolécules, comme la cristallographie, la résonance magnétique nucléaire (RMN), la résonance paramagnétique électronique (RPE) avec une sonde radicalaire, le dichroïsme circulaire, l'échange hydrogène-deutérium (en) et le transfert d'énergie entre molécules fluorescentes (FRET). L'interférométrie par double polarisation permet quant à elle de mesurer les changements conformationnels des biomolécules en temps réel et à très haute résolution.
Une méthode spécifique d'optique non linéaire, dite de génération de seconde harmonique (doublage de fréquence), est applicable à l'étude des changements conformationnels des protéines[11].
Notes et références
modifier- (en) Zimei Bu et David J. E. Callaway, « Chapter 5 - Proteins MOVE! Protein dynamics and long-range allostery in cell signaling », Advances in Protein Chemistry and Structural Biology, vol. 83, , p. 163-221 (PMID 21570668, DOI 10.1016/B978-0-12-381262-9.00005-7, lire en ligne)
- (en) James S. Fraser, Michael W. Clarkson, Sheena C. Degnan, Renske Erion, Dorothee Kern et Tom Alber, « Hidden alternative structures of proline isomerase essential for catalysis », Nature, vol. 462, no 7273, , p. 669-673 (PMID 19956261, PMCID 2805857, DOI 10.1038/nature08615, lire en ligne)
- (en) B. Hille, Ion Channels of Excitable Membranes, 3e éd., Sinauer Associates, 2001, Sunderland, États-Unis, p. 5. (ISBN 978-0-87893-321-1)
- (en) Shina C. L. Kamerlin et Arieh Warshel, « At the dawn of the 21st century: Is dynamics the missing link for understanding enzyme catalysis? », Proteins, vol. 78, no 6, , p. 1339-1375 (PMID 20099310, PMCID 2841229, DOI 10.1002/prot.22654, lire en ligne)
- (en) David J. E. Callaway, Tsutomu Matsui, Thomas Weiss, Laura R. Stingaciu, Christopher B. Stanley, William T. Heller et Zimei Bu, « Controllable Activation of Nanoscale Dynamics in a Disordered Protein Alters Binding Kinetics », Journal of Molecular Biology, vol. 429, no 7, , p. 987-998 (PMID 28285124, PMCID 5399307, DOI 10.1016/j.jmb.2017.03.003, lire en ligne)
- (en) Iain D. Nicholl, Tsutomu Matsui, Thomas M. Weiss, Bela Farago, David J.E. Callaway et Zimei Bu, « α-Catenin Structure and Nanoscale Dynamics in Solution and in Complex with F-Actin », Biophysical Journal, vol. 115, no 4, , p. 642-654 (PMID 30037495, PMCID 6104293, DOI 10.1016/j.bpj.2018.07.005, lire en ligne)
- (en) Jonathan Howard, Mechanics of motor proteins and the cytoskeleton, 1re édition, Sinauer Associates, 2001, Sunderland, États-Unis. (ISBN 9780878933334)
- (en) Voet Donald, Biochemistry, 4e éd., John Wiley & Sons, 2011, Hoboken, États-Unis. (ISBN 9780470570951) (OCLC 690489261)
- (en) A. Ponte-Sucre, ABC Transporters in Microorganisms, Caister Academic, 2009. (ISBN 978-1-904455-49-3)
- (en) P. Singleton, Bacteria in Biology, Biotechnology and Medicine, 5e éd., Wiley, 1999, États-Unis. (ISBN 978-0-471-98880-9)
- (en) Joshua S. Salafsky et Bruce Cohen, « A Second-Harmonic-Active Unnatural Amino Acid as a Structural Probe of Biomolecules on Surfaces », The Journal of Physical Chemistry B, vol. 112, no 47, , p. 15103-15107 (PMID 18928314, DOI 10.1021/jp803703m, lire en ligne)