Brucine
La brucine est un alcaloïde à saveur amère fortement apparenté à la strychnine. On peut le trouver dans certaines espèces végétales, dont la variété la mieux connue est Strychnos nux-vomica, un arbre que l'on trouve en Asie du Sud-Est.
| Brucine | |
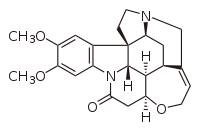
| |
| Structure | |
| Identification | |
|---|---|
| Nom UICPA | (1R)-(5S)-(7R)-(12S)-(22S)-(23R)-18,19-dimethoxy-11-oxa-4,15-diazaheptacyclo[10.9.2.0^1,5.1^4,8.0^7,23.0^15,22.0^16,21]tetraeicosan-9,16,18,20-tetraèn-14-one |
| Synonymes |
2,3-diméthoxy-strychnine |
| No CAS | |
| No ECHA | 100.006.014 |
| No CE | 206-614-7 |
| Apparence | cristaux incolores ou poudre cristalline blanche[1]. |
| Propriétés chimiques | |
| Formule | C23H26N2O4 [Isomères] |
| Masse molaire[2] | 394,463 5 ± 0,021 8 g/mol C 70,03 %, H 6,64 %, N 7,1 %, O 16,22 %, |
| Propriétés physiques | |
| T° fusion | 178 °C[1] |
| T° ébullition | 470 °C[1] |
| Solubilité | dans l'eau : faible[1], bonne dans l'alcool |
| Précautions | |
| SGH[3] | |
| H300, H330 et H412 |
|
| SIMDUT[4] | |
 D1A, |
|
| Transport | |
| Écotoxicologie | |
| LogP | 0,98[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Découverte
modifierElle fut découverte conjointement en par Joseph Bienaimé Caventou et Pierre Joseph Pelletier, qui avaient déjà découvert la strychnine. La brucine se trouve sous forme de nitrate dans les eaux-mères de la préparation de la strychnine, il suffit alors de la faire précipiter à l'ammoniac.
Toxicité
modifierBien que la brucine soit apparentée à la strychnine, elle n'est pas si toxique. Si un humain consomme plus de 2 milligrammes de brucine pure, il subira certainement des symptômes d'empoisonnement ressemblant à ceux provoqués par la strychnine.
La brucine possède un goût amer intense du même ordre que l'octaacétate de saccharose et la quassine. Son seuil de détection moyen de l'amertume chez l'homme est de 4,5 ppm[5].
Utilisations
modifierLa brucine a certains usages médicaux. Elle est utilisée principalement pour la régulation de la pression sanguine. La brucine est utilisée comme catalyseur chiral pour la décarboxylation de l'acide éthylméthylmalonique achiral, dans un mélange optiquement actif d'acide 2-méthylvalerique (1904, Asymmetrische Katalyse)[6]. Cette méthode a été découverte par Willi Marckwald.
Si l'on ajoute de l'acide formique à un mélange de brucine et de nitrate de potassium le mélange est instantanément porté au rouge.
Apparitions
modifierDans les romans
modifier- Par Alexandre Dumas :
- Dans Le Comte de Monte-Cristo, le docteur d'Avrigny soigne la tétraplégie du général Noirtier à la brucine qui l'immunise contre le poison que sa bru lui fait absorber et qu'elle a utilisé pour assassiner d'autres membres de la famille.
Attentat
modifier- En février 2024, des lettres contenant de la Brucine ont été envoyées à du moins trois bâtiments officiels à Bruxelles. Ces plis ont été réceptionnés à la Sûreté de l’Etat, au cabinet du ministre de la Justice, et au Palais de justice. Personne n’a été blessé[7].
Références
modifier- BRUCINE, ANHYDRIQUE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Brucine » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) Consumer Product Safety Commission - Study on Aversive Agents, 11/92 Final Report. [PDF]
- W. Marckwald: Ueber asymmetrische Synthese. In: Ber. dtsch. chem. Ges. 37, 349 (1904).
- Agence France-Presse, « Une poudre « toxique » expédiée à des bâtiments officiels à Bruxelles (procureur) », sur Mediapart, (consulté le )

