Aminolyse
L'aminolyse est un cas particulier de solvolyse faisant intervenir une amine primaire –NH2, voire de l'ammoniac NH3 ; la réaction avec l'ammoniac est également appelée ammonolyse. Il s'agit donc d'une substitution nucléophile SN1 ou SN2 voire d'une réaction d'élimination dans laquelle le nucléophile est une molécule du solvant.
Le remplacement d'un halogène sur un groupe alkyle R–X par une amine primaire R’–NH2 pour former une amine secondaire R–NH–R’ avec élimination de l'halogénure d'hydrogène HX est un exemple d'aminolyse :
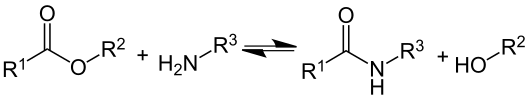
La réaction d'une amine primaire R–NH2 ou secondaire R–NH–R’ avec un acide carboxylique R’’–COOH ou avec un dérivé d'acide carboxylique pour former un amide R’’–CO–NH–R ou R’’–CO–NRR’ avec élimination d'une molécule d'eau H2O est une autre réaction d'aminolyse, très utilisée notamment en synthèse peptidique. La simple addition d'une amine sur un acide carboxylique conduit d'abord à un sel de l'acide organique et de la base ; pour que la réaction chimique se produise véritablement, l'acide carboxylique doit préalablement être « activé », ce qu'on fait généralement en le convertissant en un dérivé plus réactif, comme un anhydride ou un halogénure d'acide, ou à l'aide d'agents de couplage tels que des carbodiimides R–N=C=N–R’ ou l'anhydride propylphosphonique. Dans certains cas, des températures supérieures à 200 °C peuvent suffire à éliminer l'eau sans laisser le sel se former, ce qui donne directement le peptide sans avoir besoin d'activer l'acide carboxylique, mais le composé obtenu est généralement instable à cette température et peut se décomposer. Le choix de l'agent de couplage et du carboxyle à activer peut être déterminant dans une synthèse peptidique afin d'éviter la formation de racémiques.
La formation d'amides est l'une des réactions faisant intervenir l'ammoniac NH3, mais il existe d'autres voies possibles, comme avec le carbonate d'ammonium (NH4)2CO3, les chlorures d'acyles R–COCl et anhydrides d'acides R–CO–O–CO–R’[1]. Le carbonate d'ammonium, par exemple, permet de convertir les acides carboxyliques en sels d'ammonium, donnant par exemple de l'acétate d'ammonium CH3COONH4 à partir d'acide acétique CH3COOH[2] :
L'acétate d'ammonium est ensuite traité par chauffage à reflux à 170 °C pour déshydrater le sel et éliminer l'excès d'acide acétique et d'eau en donnant de l'acétamide CH3CONH2 :
L'aminolyse est l'une des voies de dégradation du polytéréphtalate d'éthylène (PET), un polyester couramment utilisé par exemple pour les bouteilles en plastique[3]. Elle fait intervenir du diéthylènetriamine H2N–CH2–CH2–NH–CH2–CH2–NH2 (DETA) ou du triéthylènetétramine H2N–CH2–CH2(–NH–CH2–CH2)2–NH2 (TETA) à une température de 200 à 210 °C[4] avec élimination d'éthylène glycol HOH2C–CH2OH. Cette réaction donne des amides primaires symétriques, des diamides primaires ou secondaires asymétriques et des diamides secondaires symétriques. Le matériau résiduel peut être recyclé dans le durcissement de polyépoxydes.
-
Dégradataion du PET avec des polyamines par aminolyse.
Notes et références
modifier- (en) « Making amides », sur Chemguide (consulté le ).
- (en) Jim Clark, « Simple Reactions of Carboxylic Acids as Acids », sur Chemistry LibreTexts (consulté le ).
- (en) « Polyethylene Terephthalate (PET): A Comprehensive Review », sur Omnexus: Plastics & Elastomers (consulté le ).
- (en) Tadeusz Spychaj, Ewa Fabrycy, Stanislawa Spychaj et Michal Kacperski, « Aminolysis and aminoglycolysis of waste poly(ethylene terephthalate) », Journal of Material Cycles and Waste Management, vol. 3, , p. 24-31 (DOI 10.1007/s10163-000-0036-5, lire en ligne)