Acide hexafluorotitanique
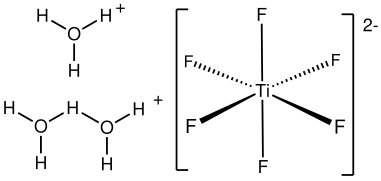
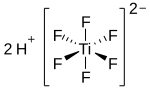
L’acide hexafluorotitanique, ou simplement acide fluorotitanique, est un composé chimique de formule théorique H2TiF6. Il est distribué commercialement en solution aqueuse, généralement à une concentration de 60 % en masse[1],[4]. Il existe également sous forme d'hydrates H2TiF6·nH2O, avec n = 4, 6, et probablement 10[5]. Le tétrahydrate (n = 4) et l'hexahydrate (n = 6) ont chacun un point de fusion congruent à −12 et 0 °C. Le décahydrate (n = 10) se décompose à −79 °C en hexahydrate et en glace. Le tétrahydrate connaît une transition de phase à −57 °C. La cristallographie aux rayons X à partir des monocristaux obtenus de l'hexahydrate a permis de déterminer la présence des cations H3O+ et H5O2+ coordonnés à des anions [TiF6]2−[5]. L'hexahydrate H2TiF6·6H2O est isomorphe à celui d'acide hexafluorosilicique H2SiF6·6H2O.
| Acide hexafluorotitanique | |
| |
| Structure de l'acide hexafluorotitanique | |
| Identification | |
|---|---|
| Synonymes |
acide fluorotitanique |
| No CAS | |
| No ECHA | 100.037.676 |
| No CE | 241-460-4 |
| PubChem | 161221 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore à l'odeur piquante[1] |
| Propriétés chimiques | |
| Formule | H2F6Ti |
| Masse molaire[2] | 163,873 ± 0,001 g/mol H 1,23 %, F 69,56 %, Ti 29,21 %, |
| Propriétés physiques | |
| T° fusion | 0 °C[3] (solution aqueuse) |
| T° ébullition | 100 °C[3] (solution aqueuse) |
| Miscibilité | miscible avec l'eau[1] |
| Masse volumique | ~ 1,5 g/cm3[1] pour une solution aqueuse à 60 % d'acide en masse |
| Précautions | |
| SGH[1] | |
| H290, H314, H301+H311+H331, P280, P301+P310+P330, P303+P361+P353, P304+P340+P310, P305+P351+P338+P310 et P403+P233 |
|
| NFPA 704[4] | |
| Transport[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'acide hexafluorotitanique peut être préparé en dissolvant du dioxyde de titane TiO2 dans de l'acide fluorhydrique HF[6],[7] :
Il peut également être préparé en faisant réagir du titane métallique avec HF[7] :
Il forme des sels avec divers cations, comme l'hexafluorotitanate de potassium K2TiF6.
Notes et références
modifier- Entrée « Dihydrogen hexafluorotitanate(IV), aqueous solution » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2 janvier 2023 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Hexafluorotitanic acid solution, consultée le 2 janvier 2023.
FDS : (en) « Hexafluorotitanic acid solution » [PDF], sur sigmaaldrich.com, Sigma-Aldrich, (consulté le ) - « Fiche du composé Dihydrogen hexafluorotitanate, 60% w/w aq. soln. », sur Alfa Aesar (consulté le ).
- (de) D. Mootz, E.-J. Oellers et M. Wiebcke, « Hexafluorotitan(IV)-Säure: Untersuchungen zur Bildung und Struktur kristalliner Hydrate », Zeitschrift für anorganische und allgemeine Chemie, vol. 564, no 1, , p. 17-25 (DOI 10.1002/zaac.19885640103, lire en ligne).
- (de) Gmelin Institut für Anorganische Chemie und Grenzg, Titan, Springer, 2013, p. 289. (ISBN 978-3-662-13217-3)
- (en) Cuie Wen, Surface Coating and Modification of Metallic Biomaterials, Woodhead Publishing, 2015, p. 163. (ISBN 978-1-78242-316-4)