1,4-Dioxine
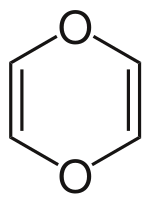
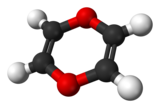
La 1,4-dioxine (parfois appelée simplement dioxine ou p-dioxine) est un composé hétérocyclique de formule C4H4O2. C'est aussi le nom générique des composés comportant ce type d'hétérocycle. Son caractère aromatique a été discuté, mais l'on considère aujourd'hui que ce composé est non-aromatique, bien qu'ayant 8 électrons π délocalisables[3].
| 1,4-Dioxine | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 1,4-dioxine | |
| Synonymes |
p-dioxine |
|
| No CAS | ||
| PubChem | 78968 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide incolore | |
| Propriétés chimiques | ||
| Formule | C4H4O2 [Isomères] |
|
| Masse molaire[1] | 84,073 4 ± 0,004 1 g/mol C 57,14 %, H 4,8 %, O 38,06 %, |
|
| Propriétés physiques | ||
| T° ébullition | 75 °C[2] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Il existe, en plus la 1,4 dioxine, deux formes isomères de la dioxine, la 1,2-dioxine (ou o-dioxin), qui, due à ses caractéristiques proches des peroxydes, est beaucoup plus instable, et une autre, la 1,3-dioxine qui est aussi particulièrement instable voire inexistante.
Synthèse
modifierLa 1,4-dioxine peut être préparée par cycloaddition, notamment par réaction de Diels-Alder[4].
Dérivés
modifierLe mot « dioxine » fait en général référence à des composés ayant un noyau de dioxine où sont attachés d'autre substituants. Par exemple, la dibenzo-1,4-dioxine est un composé dont la structure est un noyau de 1,4-dioxine fusionné avec deux cycles benzéniques.
Polychlorodibenzo-p-dioxines
modifierÀ cause de leur extrême importance comme polluants, le terme « dioxine » est très souvent utilisé dans la littérature scientifique pour désigner les dérivés chlorés de la dibenzo-1,4-dioxine, appelés polychlorodibenzo-p-dioxines (PCDD), dont l'élément le plus connu est la 2,3,7,8-tétrachlorodibenzo-p-dioxine (TCDD), dite « dioxine de Seveso ».
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- CRC Handbook of Data on Organic Compounds, 2d Edition, Weast,R.C and Grasselli, J.G., ed(s)., CRC Press, Inc., Boca Raton, FL, 1989, 1.
- (en) Science of Synthesis : Houben-Weyl Methods of Molecular Transformations Vol. 16 : Six-Membered Hetarenes with Two Identical Heteroatoms (lire en ligne), page 15
- (en) R. Alan Aitken, J. I. G. Cadogan and Ian Gosneya, « Effect of ring strain on the formation and pyrolysis of some Diels–Alder adducts of 2-sulfolene (2,3-dihydrothiophene 1,1-dioxide) and maleic anhydride with 1,3-dienes and products derived therefrom », J. Chem. Soc., Perkin Trans. 1, , p. 927–931 (DOI 10.1039/p19940000927)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « 1,4-Dioxin » (voir la liste des auteurs).